2. 昆明理工大学附属昆华医院儿科, 云南 昆明 650032
先天性心脏病是胎儿期心脏及大血管发育异常而导致的先天畸形,是小儿最常见的心脏病[1]。本课题组前期对2010年10月至2012年10月在我院行体外受精-胚胎移植术成功并分娩、生后入住我科NICU的试管婴儿先天性心脏病发病情况进行调查,结果显示150例试管婴儿中患先天性心脏病者33例(22%)[2],而自然受孕的活产婴儿中先天性心脏病的发病率仅为6‰~10‰[1, 3]。心脏的发育是一个复杂的过程,涉及多种基因在不同时间和空间上的顺次精确表达,并受多种转录因子的调控。心脏特异性同源盒基因NKX2.5是心脏发育过程中重要的转录因子,是所有脊椎动物心脏发生中最早表达的转录因子之一[4],研究发现,该基因突变导致基因产物的转录活性下降,并影响其他心脏发育相关因子发挥作用,从而影响心脏发育,导致先天性心脏病[5-6]。转录因子T-同源盒基因5(T-box 5, TBX5)已被确认为心手综合征(Holt-Oram syndrome, HOS)的致病基因[7],2004年首次在非HOS的散发性先天性心脏病患者中检测到TBX5基因的突变[8]。本研究对确诊为先天性心脏病的试管婴儿和自然受孕儿进行NKX2.5基因和TBX5基因突变筛查,旨在探讨试管婴儿和自然受孕儿间是否存在NKX2.5基因和TBX5基因突变差异,现将结果报道如下。
1 资料与方法 1.1 研究对象2010年10月至2013年11月在云南省第一人民医院经临床体检和心脏彩超检查诊断为先天性心脏病的试管婴儿68例和自然受孕儿98例为研究对象,均为汉族。68例试管婴儿组中,男36例,女32例;中位年龄1岁2个月(范围:3 d至3岁2个月)。98例自然受孕组中,男52例,女46例;中位年龄1岁11个月(范围:7 d至5岁)。两组间年龄、性别的比较差异无统计学意义(P > 0.05)。
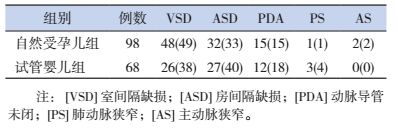
两组患儿均为散发性单纯性先天性心脏病病例,其中室间隔缺损(ventricular septal defect, VSD)74例,房间隔缺损(atrial septal defect, ASD)59例,动脉导管未闭(patent ductus arteriosus, PDA)27例,肺动脉狭窄(pulmonary stenosis, PS)4例,主动脉狭窄(aortic stenosis, AS)2例,见表 1。
| 表 1 试管婴儿组和自然受孕组先天性心脏病类型 [n(%)] |
另选取非先天性心脏病儿童39例作参照研究,均为汉族。其中试管婴儿18例,男9例,女9例;中位年龄1岁(范围:6 d至2岁2个月);自然受孕婴儿21例,男11例,女10例;中位年龄1岁4个月(范围:8 d至3岁)。两组间年龄、性别的比较差异无统计学意义(P > 0.05)。
本研究经云南省第一人民医院伦理委员会批准,并征得患儿监护人的知情同意。
1.2 基因突变检测抽取外周血2 mL,以EDTA溶液抗凝,采用常规酚-氯仿法提取DNA。参考文献[9-10]或根据基因序列设计引物,引物序列见表 2~3,由上海捷瑞生物工程有限公司合成。
| 表 2 NKX2.5基因编码区1和2引物序列 |
| 表 3 TBX5基因编码区4、5、8引物序列 |
PCR扩增:反应体系50 μL,基因组DNA 0.25 ng,上下游引物各1 μL,10×Taq Buffer 5 μL,dNTP 3 μL,Taq DNA Polymerase 2.5 u。扩增产物用1%琼脂糖凝胶电泳,EB染色,紫外灯下鉴定产物并照相保存。
NKX2.5基因编码区1扩增条件:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸40 s,35个循环,72℃终延伸5 min;编码区2扩增条件:94℃预变性5 min,94℃变性30 s,50℃退火30 s,72℃延伸60 s,35个循环,72℃终延伸5 min。
TBX5基因编码区4扩增条件:94℃预变性5 min,94℃变性30 s,60℃退火30 s,72℃延伸30 s,35个循环,72℃终延伸5 min;编码区5扩增条件:94℃预变性5 min,94℃变性30 s,54℃退火30 s,72℃延伸25 s,35个循环,72℃终延伸5 min;编码区8扩增条件:94℃预变性5 min,94℃变性30 s,65℃退火30 s,72℃延伸35 s,35个循环,72℃终延伸5 min。
DNA测序:PCR产物用DNA胶回收试剂盒(TaKaRa MiniBEST Agarose Gel DNA Extraction Kit)纯化后,送华大基因公司测序。测序结果与GenBank中人NKX2.5基因(ID:1482)和人TBX5基因(ID:6910)的标准序列比对。
1.3 统计学分析采用SPSS 16.0统计软件进行统计学分析。计数资料以百分率(%)表示,组间比较采用χ2检验。采用Hardy-Weinberg平衡检验基因型频率的代表性。P < 0.05为差异有统计学意义。
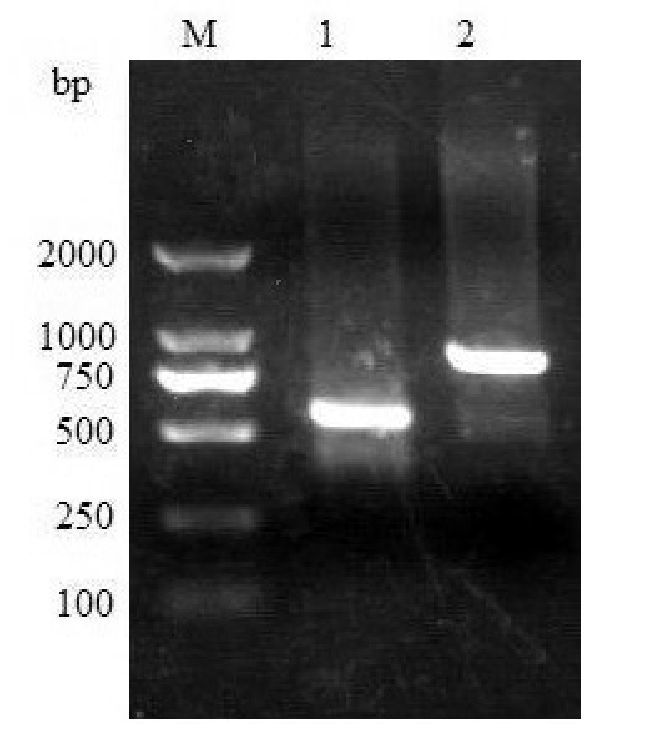
2 结果 2.1 NKX2.5基因检测结果PCR结果:PCR扩增产物经琼脂糖电泳验证,以DNA Marker作为对照,PCR反应产物的长度与设计的各片段大小与预期值符合(图 1)。
|
图 1 NKX2.5编码区1和2的PCR产物电泳图 M:2 000 bp DNA ladder Marker;1:NKX2.5编码区1,549 bp;2:NKX2.5编码区2,859 bp。 |
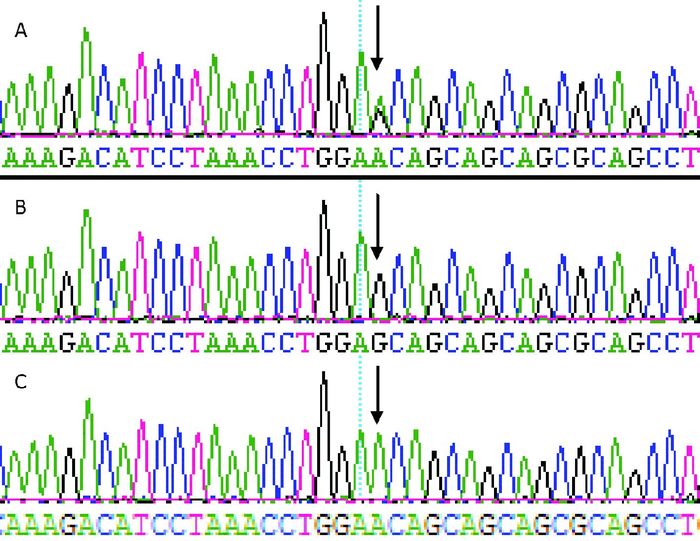
DNA测序结果:患先天性心脏病的试管婴儿组和自然受孕儿组中,在NKX2.5基因编码区1均发现第63位碱基发生突变(c.63A > G),有3种类型,分别为A/G、G/G、A/A(图 2)。编码区2中,两组均未发现突变。
|
图 2 NKX2.5基因突变测序结果 在NKX2.5基因编码区1发现第63位碱基发生突变(c.63A > G)。A:A/G杂合子;B:G/G纯合子;C:A/A纯合子。箭头所指为突变位点。 |
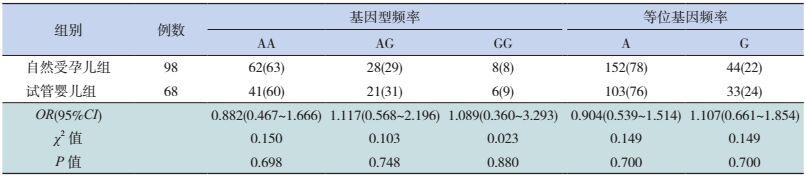
NKX2.5基因编码区1多态性位点在自然受孕儿组和试管婴儿组的等位基因与基因型频率:在NKX2.5基因编码区1中,c.63A > G位点的基因型分布符合Hardy-Weinberg定律(P > 0.05)。表 4显示试管婴儿组和自然受孕儿组c.63A > G位点的基因型及等位基因频率比较差异无统计学意义(P > 0.05)。
| 表 4 两组先天性心脏病患儿c.63A > G位点的基因型分布及等位基因频率 [n(%)] |
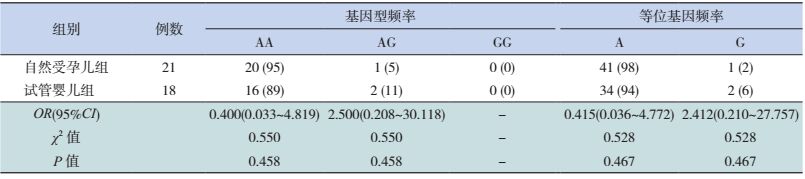
本研究同时选取经心脏彩超检查排外先天性心脏病的自然受孕儿21例和试管婴儿18例作参照研究。NKX2.5基因编码区1 c.63A > G位点的基因型分布符合Hardy-Weinberg定律(P > 0.05)。两组婴儿在c.63A > G位点仅发现杂合突变,均未发现纯合突变,其基因型及等位基因频率两组比较差异无统计学意义,见表 5。
| 表 5 非先天性心脏病儿童c.63A > G位点的基因型分布及等位基因频率 [n(%)] |
2.2 TBX5基因检测结果
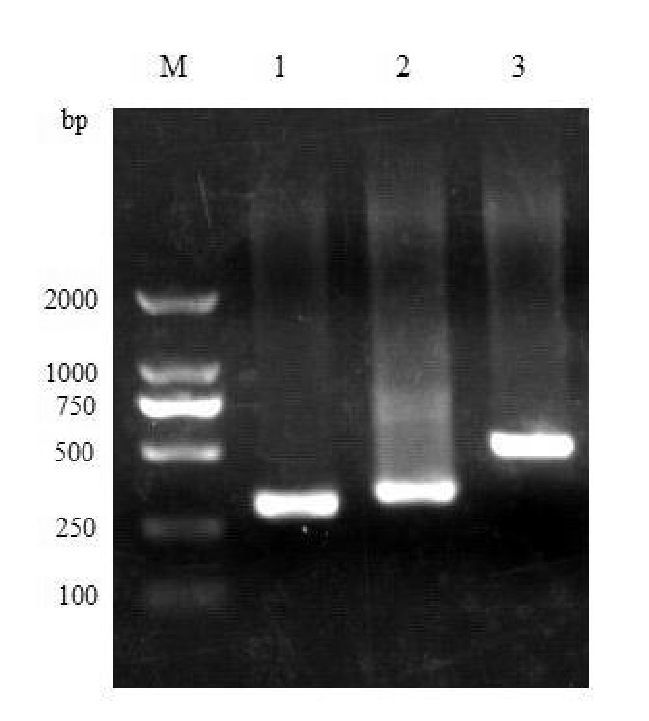
PCR结果:以DNA Marker作为对照,PCR反应产物的长度与所设计的各片段大小与预期值符合(图 3)。
|
图 3 TBX5编码区4、5、8的PCR产物电泳图 M:2 000 bp DNA ladder Marker;1:TBX5编码区4,307 bp;2:TBX5编码区5,335 bp;3: TBX5编码区8,512 bp。 |
DNA测序结果:在先天性心脏病自然受孕儿组和试管婴儿组中,均未发现TBX5基因编码区4、5、8突变。
3 讨论美国Dott等[11]研究发现试管婴儿存在先天缺陷的可能性是普通婴儿的2~4倍,其中先天心脏缺陷较多见,其发生率是自然受孕儿的2~3倍。Koivurova等[12]通过随机选择多重配对研究,证实了上述观点。但需进一步多中心、大样本的研究方能更准确地反映试管婴儿先天心脏缺陷的发病情况。
先天性心脏病是一种多基因遗传病,主要是由于胚胎期遗传因素和环境因素共同作用导致心脏血管异常发育引起,遗传度为55%~65%[13]。基因的表达受转录因子调控,心脏发育过程中有大量转录因子参与,转录因子突变是多种先天性心脏病遗传学方面的主要病因,经动物模型和人类研究证实,NKX2.5、TBX5、GATA4、PTPN11、TFAP2B、EVC/EVC2、ZIC3基因与先天性心脏病有关[14-16],目前认为NKX2.5、TBX5、GATA4基因影响心脏发育最为重要。
人类心脏的发育要经历一系列复杂的过程。NKX2.5基因是心脏前体细胞最早的标志物,参与心脏发育的各个过程,在心肌分化前即开始表达,正常表达对心房及心室发育、动脉干分隔、房室瓣形成及房室传导的维持均起重要作用,且对成熟心脏发挥正常功能亦必不可少。人类NKX2.5基因定位于5q35.1,包含2个外显子,编码324个氨基酸。1998年Schott等[4]首次在4个单纯性先天性心脏病家系中检出NKX2.5同源盒结构域的3种点突变,证实其与先天性心脏病相关。这些先天性心脏病包括ASD、VSD、法洛四联症、右室双出口、三尖瓣畸形等,在已经找到的约40种突变中,包括6种缺失突变、2种插入突变,其余为转换与颠换(包含7种无义突变)[17-20]。本研究检测了自然受孕儿组和试管婴儿组共166例先天性心脏病患儿的NKX2.5基因,结果显示第63位碱基腺嘌呤(A)突变为鸟嘌呤(G),其所编码的21位氨基酸密码子分别为GAA和GAG,均编码谷氨酸,属于同义突变,并没有改变蛋白质的构成,是一个单核苷酸多态性位点。国内研究亦报道,在先天性心脏病患者中检测到c.63A > G这一多态位点[21-24]。韩增强等[25]对81例单纯性先天性心脏病患者的NKX 2.5基因进行突变检测,亦发现c.63A > G,并提出这一位点与ASD之间可能存在相关性。石琳等[26]研究发现,VSD和法洛四联症NKX2.5基因第一外显子的c.63A > G的G基因型频率和等位基因频率显著高于健康对照组,这一多态性与中国先天性心脏病有明显的相关性,具有G等位基因的人发生VSD和法洛四联症的危险性相对增高。NKX2.5基因c.63A > G多态性位点主要见于国内研究报道,可能是中国先天性心脏病的潜在分子机制之一。本研究未发现c.63A > G基因型频率和等位基因频率在试管婴儿组和自然受孕组中的分布有显著性差异,推测可能是该位点主要与先天性心脏病患病有关。本研究还选取经心脏彩超检查排外先天性心脏病的39例自然受孕儿和试管婴儿作参照研究,结果显示在c.63A > G位点仅发现杂合突变,未发现纯合突变。因此,本研究提示辅助生殖技术可能未引起NKX2.5基因突变。
人类TBX5基因定位于12q24.1,cDNA全长2 133 bp,8个外显子,编码518个氨基酸。TBX5被确认为HOS的致病基因,HOS属常染色体显性遗传病,病人表现为以ASD为主的心脏异常和上肢不同部位、不同程度的畸形,也可出现VSD、二尖辨脱垂、肺动脉狭窄(包括外周动脉)等畸形[27]。Reamon-Buettner等[8]首次在ASD、房室间隔缺损患者中检测到了TBX5基因的突变。本研究在自然受孕儿组和试管婴儿组共166例先天性心脏病患儿中,均未检测到TBX5基因突变,与王佼等[28]的研究结果一致。当然,此研究结果可能与样本量较少有关,这也是本研究的局限,今后将继续收集样本进行后续检测。
2013年,Tararbit等[29]报道,除法洛四联症外,试管婴儿与自然受孕儿的其他类型先天性心脏病发生率无差异。Bahtiyar等[30]研究指出,试管婴儿先天性心脏病患病率增高可能主要与双胎试管婴儿有关。这提示,将双胎纳入影响因素进行下一步研究,也许会有新的发现。本研究检测了患先天性心脏病的68例试管婴儿和98例自然受孕儿,均检测到NKX2.5基因c.63A > G多态性位点,但两组间该位点基因型及等位基因分布无明显差异;另外,均未检测到TBX5基因突变,提示辅助生殖技术可能未引起NKX2.5基因和TBX5基因突变。表观遗传调控(DNA甲基化、翻译后组蛋白修饰和非编码RNA调控等)在心肌的分化和发育中的作用日益受到关注[15],NKX2.5基因和TBX5基因的表观遗传学改变与先天性心脏病的关系值得进一步探究。
| [1] | 桂永浩. 先天性心脏病概述[M]//王卫平. 儿科学. 第8版. 北京: 人民卫生出版社, 2013: 292-293. |
| [2] | 许小艳, 杨景晖, 麻新梅, 等. 试管婴儿新生儿期并发症及出生缺陷分析[J]. 中国当代儿科杂志, 2015, 17 (4): 350–355. DOI:10.7499/j.issn.1008-8830.2015.04.012 |
| [3] | 宁寿葆. 先天性心血管畸形[M]//江载芳, 申昆玲, 沈颖. 诸福棠实用儿科学(下册). 第8版. 北京: 人民卫生出版社, 2015: 1535. |
| [4] | Schott JJ, Benson DW, Basson CT, et al. Congenital heart disease caused by mutations in the transcription factor NKX2-5[J]. Science, 1998, 281 (5373): 108–111. DOI:10.1126/science.281.5373.108 |
| [5] | McElhinney DB, Geiger E, Blinder J, et al. NKX2.5 mutations in patients with congenital heart disease[J]. J Am Coll Cardiol, 2003, 42 (9): 1650–1655. DOI:10.1016/j.jacc.2003.05.004 |
| [6] | Reamon-Buettner SM, Hecker H, Spanel-Borowski K, et al. Novel NKX2-5 mutations in diseased heart tissues of patients with cardiac malformations[J]. Am J Pathol, 2004, 164 (6): 2117–2125. DOI:10.1016/S0002-9440(10)63770-4 |
| [7] | Bruneau BG, Nemer G, Schmitt JP, et al. A murine model of Holt-Oram syndrome defines roles of the T-Box transcription factor Tbx5 in cardiogenesis and disease[J]. Cell, 2001, 106 (6): 709–721. DOI:10.1016/S0092-8674(01)00493-7 |
| [8] | Reamon-Buettner SM, Borlak J. TBX5 mutations in non-Holt-Oram syndrome (HOS) malformed hearts[J]. Hum Mutat, 2004, 24 (1): 104. |
| [9] | Zhang WM, Li XF, Ma ZY, et al. GATA4 and NKX2.5 gene analysis in Chinese Uygur patients with congenital heart disease[J]. Chin Med J, 2009, 122 (4): 416–419. |
| [10] | Pabst S, Wollnik B, Rohmann E, et al. A novel stop mutation truncating critical regions of the cardiac transcription factor NKX2-5 in a large family with autosomal-dominant inherited congenital heart disease[J]. Clin Res Cardiol, 2008, 97 (1): 39–42. DOI:10.1007/s00392-007-0574-0 |
| [11] | Dott M, Rasmussen SA, Hogue CJ, et al. Association between pregnancy intention and reproductive-health related behaviors before and after pregnancy recognition, National Birth Defects Prevention Study, 1997-2002[J]. Matern Child Health J, 2010, 14 (3): 373–381. DOI:10.1007/s10995-009-0458-1 |
| [12] | Koivurova S, Hartikainen AL, Gissler M, et al. Neonatal outcome and congenital malformations in children born after in-vitro fertilization[J]. Hum Reprod, 2002, 17 (5): 1391–1398. DOI:10.1093/humrep/17.5.1391 |
| [13] | Hoffman JI, Kaplan S. The incidence of congenital heart disease[J]. J Am Coll Cardiol, 2002, 39 (12): 1890–1900. DOI:10.1016/S0735-1097(02)01886-7 |
| [14] | He A, Kong SW, Ma Q, et al. Co-occupancy by multiple cardiac transcription factors identifies transcriptional enhancers active in heart[J]. Proc Natl Acad Sci, 2011, 108 (14): 5632–5637. DOI:10.1073/pnas.1016959108 |
| [15] | Clark CD, Zhang B, Lee B, et al. Evolutionary conservation of Nkx2.5 autoregulation in the second heart field[J]. Dev Biol, 2013, 374 (1): 198–209. DOI:10.1016/j.ydbio.2012.11.007 |
| [16] | Greulich F, Rudat C, Kispert A. Mechanisms of T-box gene function in the developing heart[J]. Cardiovasc Res, 2011, 91 (2): 212–222. DOI:10.1093/cvr/cvr112 |
| [17] | Gioli-Pereira L, Pereira AC, Mesquita SM, et al. NKX2.5 mutations in patients with non-syndromic congenital heart disease[J]. Int J Cardiol, 2009, 138 (3): 261–265. |
| [18] | Stallmeyer B, Fenge H, Nowak-Göttl U, et al. Mutational spectrum in the cardiac transcription factor gene NKX2.5(CSX) associated with congenital heart disease[[J]. Clin Genet, 2010, 78 (6): 533–540. DOI:10.1111/cge.2010.78.issue-6 |
| [19] | Reamon-Buettner SM, Borlak J. NKX2-5:an update on this hypermutable homeodomain protein and its role in human congenital heart disease (CHD)[J]. Hum Mutat, 2010, 31 (11): 1185–1194. DOI:10.1002/humu.v31:11 |
| [20] | Hatemi AC, Güleç C, Cine N, et al. Sequence variations of NKX2-5 and HAND1 genes in patients with atrial isomerism[J]. Anadolu Kardiyol Derg, 2011, 11 (4): 319–328. |
| [21] | 陈萍, 黄国英, 常才, 等. Csx/Nkx2.5基因在胚胎心脏的表达及在先天性心脏病中的突变检测[J]. 中华围产医学杂志, 2005, 8 (4): 230–233. |
| [22] | 刘兴元, 杨奕清, 杨颖, 等. NKX2-5基因与先天性心脏病的关系[J]. 国际心血管病杂志, 2009, 36 (4): 232–235. |
| [23] | 许耘红, 何穗镕, 李丽青. 心脏发育相关基因NKX2.5和GATA4突变与先天性心脏病的相关性[J]. 中国临床药理学杂志, 2016, 32 (22): 2111–2113. |
| [24] | Wang Z, Zou L, Zhong R, et al. Associations between two genetic variants in NKX2-5 and risk of congenital heart disease in Chinese population:a meta-analysis[J]. PLoS One, 2013, 8 (8): e70979. DOI:10.1371/journal.pone.0070979 |
| [25] | 韩增强, 唐胤, 陈彧, 等. 81例单纯性先天性心脏病患者NKx 2.5基因突变筛查及关联研究[J]. 中国循环杂志, 2011, 26 (6): 461–464. |
| [26] | 石琳, 申阿东, 李晓峰, 等. 中国先天性心脏病Nkx2.5基因突变筛查及关联研究[J]. 首都医科大学学报, 2005, 26 (5): 525–528. |
| [27] | Holt M, Oram S. Familial heart disease with skeletal malformations[J]. Br Heart J, 1960, 22 : 236–242. DOI:10.1136/hrt.22.2.236 |
| [28] | 王佼, 朱善良, 杨世伟, 等. NKX2.5、GATA4、TBX5基因突变与散发性先天性心脏病的相关性研究[J]. 中国循环杂志, 2014, 29 (z1): 33–34. |
| [29] | Tararbit K, Lelong N, Thieulin AC, et al. The risk for four specific congenital heart defects associated with assisted reproductive techniques:a population-based evaluation[J]. Hum Reprod, 2013, 28 (2): 367–374. DOI:10.1093/humrep/des400 |
| [30] | Bahtiyar MO, Campbell K, Dulay AT, et al. Is the rate of congenital heart defects detected by fetal echocardiography among pregnancies conceived by in vitro fertilization really increased?:a case-historical control study[J]. J Ultrasound Med, 2010, 29 (6): 917–922. DOI:10.7863/jum.2010.29.6.917 |
 2017, Vol. 19
2017, Vol. 19