2. 中国医学科学院北京协和医院风湿免疫科, 北京 100730
系统性红斑狼疮(systemic lupus erythematosus, SLE)是以多脏器受累、血清中多种自身抗体阳性为特点的自身免疫性疾病,其中肾脏被认为是最常受累的器官。随着SLE诊治水平的不断提高,患者生存期不断延长,SLE的一些较为少见的脏器并发症,如肺动脉高压(pulmonary arterial hypertension),因其严重影响患者的心功能和生存期日益受到重视。成人确诊肺动脉高压的金标准是通过右心导管检查,得到静息状态下平均肺动脉压(mPAP)≥25 mm Hg[1]。但依据该标准,每位患者都需进行右心导管这一有创性检查,且参考数据为成人数据,直接应用于儿科有困难。考虑到目前尚无专用于儿童肺动脉高压的诊断标准,对于儿童的相关研究也比较少,故本文采用广义上的肺高压(pulmonary hypertension, PH),即超声心动图提示肺动脉收缩压≥40 mm Hg[2],通过对15例合并PH的儿童SLE病例进行回顾性分析,探讨SLE合并PH(SLE-PH)儿童患者的临床特点、与PH相关的临床症状以及PH对预后的影响等,以提高对该疾病的认识。
1 资料与方法 1.1 研究对象收集1998年12月至2016年7月在北京协和医院住院诊断为SLE-PH的儿童患者的临床资料,对资料完整的全部15例进行分析。所有患者均符合美国风湿病学会(ACR)1997年推荐的SLE分类标准[3]。
1.2 PH的诊断标准静息状态下,彩色多普勒超声心动图显示肺动脉收缩压≥40 mm Hg,并且除外心脏瓣膜病变、间质性肺病、肺血栓栓塞等病史者,诊断为PH[2]。
1.3 数据收集通过填写表格的形式收集资料,核对后输入计算机数据库。内容包括人口学特征、临床表现及体征、SLE受累系统评估、自身免疫性抗体以及SLE活动指标如血沉、补体等实验室检查结果、超声心动图检查结果、治疗及用药情况等。在诊断PH的同时评定同期的SLE疾病活动指数(SLEDAI)。
1.4 统计学分析采用SPSS 22.0软件进行统计学分析。计量资料用中位数(四分位数间距)[M(QR)]表示,组间比较采用Wilcoxon秩和检验。计数资料用例数和百分率(%)表示,组间比较采用Fisher精确概率检验。P < 0.05为差异具有统计学意义。
2 结果 2.1 一般情况15例SLE-PH患儿中,男2例,女13例。SLE起病年龄中位数为12.5岁(范围:7~16岁),诊断PH时的年龄中位数为16.0岁(范围:10~17岁)。从最初起病到确诊PH的间隔时间中位数为2.0年(范围:0.2~7年),从SLE的确诊到PH诊断的间隔时间中位数为0.1年(范围:0~6.5年)。15例患者静息状态下的肺动脉收缩压中位数为60 mm Hg(范围:42~101 mm Hg)。
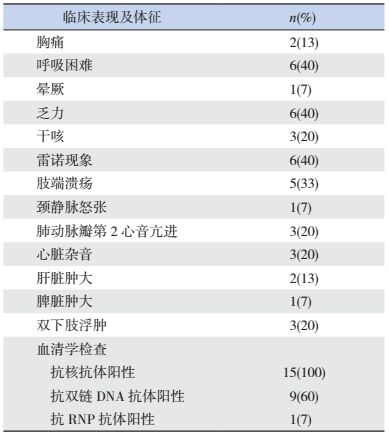
2.2 临床表现及实验室指标15例SLE-PH患者中,SLE方面的表现包括:蝶形红斑10例,口腔溃疡及肢端溃疡4例,脱发1例,关节炎7例,肾脏损害9例,血液系统损害8例;PH方面的表现包括:WHO心功能1级7例,2级5例,3级2例,4级1例,超声心动图示中量以上心包积液4例,右室内径28±8 mm,右房内径33±8 mm。15例患儿诊断PH时的SLEDAI评分为10±5分。雷诺现象见于40%的患儿,与呼吸困难、乏力等共同成为SLE-PH患儿最常见的临床表现,其他症状和体征的病例分布见表 1。15例患儿的抗核抗体均为阳性,60%的患儿出现抗dsDNA抗体阳性,但抗RNP抗体阳性者只有1例。
| 表 1 SLE-PH患儿的临床症状及实验室指标 (n=15) |
2.3 不同程度PH活动指标的比较
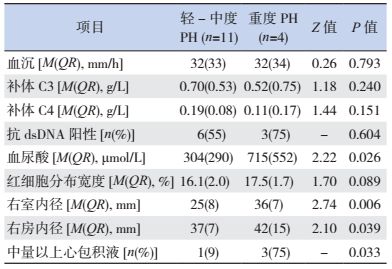
本研究以肺动脉收缩压70 mm Hg为界,将病例分为两组,即轻-中度PH和重度PH组[4-5]。可以看出,与轻-中度PH组相比,重度PH组患儿的右室扩张等超声心动图表现更重,血尿酸、红细胞分布宽度等反映微小动脉痉挛的指标更高,而两组患者的SLE活动指标如补体C3、C4、血沉水平,以及抗dsDNA阳性率等差异无统计学意义,见表 2。
| 表 2 轻-中度和重度PH患儿的SLE活动指标及超声心动图表现的比较 |
2.4 治疗情况及转归
诊断PH后中位随访时间8.0年(范围:0.5~18.1年)。除了强心、利尿、抗凝等基础治疗外,有13例患儿应用激素及免疫抑制剂治疗;1例急性血管反应试验阳性患儿应用钙离子通道拮抗剂;2例患儿应用靶向药物治疗(波生坦31.25 mg,每日2次,或他达拉非10 mg,每日1次)。随访过程中有2例患儿死亡,其中1例确诊SLE-PH时WHO心功能4级,另1例确诊时WHO心功能3级,死因均为呼吸循环衰竭。其他患儿病情平稳,表现为心功能分级、超声心动图各指标、血流动力学指标等未见明显加重,规律门诊随诊。
3 讨论在以成人为对象的研究中,研究类型不同,SLE患者发生PH的几率也有所不同:回顾性研究显示的数据约为0.5%~6%,而前瞻性研究则更高,达9%~14%[6]。一项关于1980例中国成人SLE患者的大样本调查研究显示,我国SLE-PH患病率约为3.8%[7],远低于SLE血液系统受累(56.1%)、SLE关节受累(54.5%)、狼疮性肾炎(47.4%),甚至低于神经精神性狼疮(4.8%)[8]。巴西一项基于800余例患儿的多中心回顾分析则显示,儿童患者中SLE-PH大约占2%[9]。但从本课题组此前对儿童结缔组织病合并PH的研究来看[10-11],由于认识不足等原因,儿童SLE-PH的发生和漏诊情况可能被大大低估了。
SLE-PH是一种严重影响患者生活质量和预后的疾病。一旦罹患PH,SLE患者的生活质量和生存时间将受到严重影响,PH已成为导致SLE患者死亡的重要原因。如北京协和医院曾经分析近30年来住院的成人及儿童SLE患者的死亡原因,发现SLE-PH是继神经精神性狼疮、狼疮性肾炎后,导致SLE患者死亡的第3位原因。而在病程超过3年的SLE住院患者中,PH高居死因首位[12]。基于这些原因,SLE-PH应当引起更多的重视。
从本研究结果可见,儿童SLE-PH患者从最初起病到诊断PH、从诊断SLE到诊断PH的间隔时间跨度较大,从半年以内到6~7年不等(成人患者从诊断SLE到诊断PH的时间往往更长,平均即达5年左右[13])。值得注意的是,多数患者在诊断PH时并无典型的临床症状[9],这使其更容易被漏诊,或误诊为其他风湿病;由于肺部受累的症状隐匿,部分患者得不到及时诊断和合理治疗。因此对于首次确诊的SLE,儿科风湿免疫医师应在相关科室的协助下掌握PH的病情评估。
此前有研究表明,SLE病程较长是并发PH的一个独立危险因素[13]。心悸、活动后气短等症状也是PH的提示,但只有不足30%的患者因出现了这些症状而确诊[7]。本研究的15例患儿当中有6例(40%)出现雷诺现象,提示雷诺现象是儿童SLE-PH的常见临床表现。既往也有文献报道雷诺现象与SLE-PH密切相关[14]。分析原因,可能是雷诺现象主要源于肢端细小动脉的痉挛收缩,而肺部的细小动脉也可发生类似改变(即肺部的雷诺现象),逐渐引起肺小动脉慢性闭塞,进而导致PH。同样地,SLE患儿如有心脏、肾脏等处的细小动脉挛缩表现,也应警惕PH的发生[15-16]。还有人提出,抗RNP抗体阳性[13]、血栓栓塞事件[17]等可能与SLE-PH有关联。但血栓栓塞在儿童患者中普遍认为比较少见[9];抗RNP抗体阳性在儿童结缔组织病并发PH,包括SLE-PH中虽有报道[18-19],但本研究对所有15例SLE-PH患儿进行检测,结果只有1例在确诊时存在抗RNP抗体阳性,因此对抗RNP在儿童SLE-PH患者中的早期提示意义还需进一步积累资料。总之,SLE病程较长、存在雷诺现象等,均为儿童SLE并发PH的提示线索,对于这些患儿应重视PH早期筛查,为早期诊断、早期治疗提供机会。
对于怀疑PH的患者,将超声心动图肺动脉收缩压设定为≥40 mm Hg被认为是最好的诊断标准[2]。对SLE-PH患儿除了超声心动图检查,还应重视综合评估。根据2015年欧洲心脏病学会的更新版指南[20],包括SLE在内的结缔组织病所致的PH属第1大类动脉型PH。但由于SLE的复杂性,不同发病机制引起的PH,其病理生理学类型可能并不完全相同[8]。例如SLE继发心脏瓣膜病变(如SLE所致的心内膜炎)可引起左心疾病导致的PH(指南推荐的PH分类第2大类),SLE继发肺间质病变可引起低氧血症导致的PH(指南推荐的PH分类第3大类),SLE继发肺血栓栓塞可引起慢性血栓栓塞导致的PH(指南推荐的PH分类第4大类)。因此在早期筛查出高危患儿之后,还应根据情况进行右心导管、胸部CT、肺通气灌注显像、肺功能等全面的检查和评估,以真正明确诊断。
SLE-PH患儿开始治疗的时机,对预后起着决定性作用。治疗越早,心功能受损越小,患儿远期预后也就更好。除了治疗原发病SLE,PH的治疗主要包括支持治疗(避免过度体力劳动,适当限制入量,使用强心剂、利尿剂、必要时抗凝),合理使用钙离子通道拮抗剂缓解血管痉挛,以及免疫抑制治疗等[21-22]。有研究表明,针对病程相对短,病情进展较快,但无明确右心衰竭表现的早期PH,免疫抑制治疗将使患者获益最大[23]。而如果到了WHO心功能分级Ⅲ~Ⅳ级,往往也就丧失了早期治疗的机会。本研究中2例死亡患儿在确诊SLE-PH时,心功能均为Ⅲ~Ⅳ级也印证了这一点。近20年来,随着对PH病理生理机制认识的不断深入,PH的靶向药物包括前列环素及其类似物,内皮素受体拮抗剂,5型磷酸二酯酶抑制剂等[24-25],也得到了越来越多的应用。
SLE-PH患者多预后不良[26]。有报道显示,初诊后2年内的病死率为25%~50%[27]。但有研究表明,与成人SLE-PH往往是疾病晚期不可逆损害的表现不同,SLE-PH在儿童患者中有时是可逆的,甚至多达半数患儿经过治疗有所缓解[9]。本研究15例患儿在0.5~18.1年的随访中,13例患儿治疗后病情平稳。以上研究结果提示,对于SLE-PH患儿,早期积极合理治疗,包括及时加用PH靶向药物延缓肺血管和右心重构,可改善患儿预后。
本研究发现,PH的轻重程度与反映SLE疾病活动度的指标(如补体C3、C4、ESR水平,抗dsDNA阳性率等)似乎并无明显关联,这可能与样本例数少有关。但结合此前也有类似的研究结果[13],提示PH或许并不完全反映SLE病情活动。
总之,对于SLE患儿,特别是病程较长、有心悸或活动后气短等症状、病史中出现雷诺现象的患儿,需考虑到合并PH的可能,应重视肺动脉压的早期筛查,不应由于肺部症状隐匿而忽略相关的病情判断。对SLE合并PH的患儿,不可由于SLE无明显活动而对PH诊治掉以轻心,而应根据情况及时进行右心导管、胸部CT、肺通气灌注显像、肺功能等全面的检查和评估,以便尽早进行合理治疗,改善预后。
| [1] | Hoeper MM, Bogaard HJ, Condliffe R, et al. Definitions and diagnosis of pulmonary hypertension[J]. J Am Coll Cardiol, 2013, 62 (25 Suppl): D42–D50. |
| [2] | Ruiz-Irastorza G, Garmendia M, Villar I, et al. Pulmonary hypertension in systemic lupus erythematosus:prevalence, predictors and diagnostic strategy[J]. Autoimmun Rev, 2013, 12 (3): 410–415. DOI:10.1016/j.autrev.2012.07.010 |
| [3] | Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus[J]. Arthritis Rheum, 1997, 40 (9): 1725. |
| [4] | Cossío-Aranda J, Zamora KD, Nanda NC, et al. Echocardiographic correlates of severe pulmonary hypertension in adult patients with ostium secundum atrial septal defect[J]. Echocardiography, 2016, 33 (12): 1891–1896. DOI:10.1111/echo.2016.33.issue-12 |
| [5] | Konstantinides S, Geibel A, Olschewski M, et al. A comparison of surgical and medical therapy for atrial septal defect in adults[J]. N Engl J Med, 1995, 333 (8): 469–473. DOI:10.1056/NEJM199508243330801 |
| [6] | Xia YK, Tu SH, Hu YH, et al. Pulmonary hypertension in systemic lupus erythematosus:a systematic review and analysis of 642 cases in Chinese population[J]. Rheumatol Int, 2013, 33 (5): 1211–1217. DOI:10.1007/s00296-012-2525-y |
| [7] | Li M, Wang Q, Zhao J, et al. Chinese SLE Treatment and Research group (CSTAR) registry:Ⅱ. Prevalence and risk factors of pulmonary arterial hypertension in Chinese patients with systemic lupus erythematosus[J]. Lupus, 2014, 23 (10): 1085–1091. DOI:10.1177/0961203314527366 |
| [8] | 王迁, 李梦涛, 曾小峰, 等. 系统性红斑狼疮相关肺动脉高压的诊治共识[J]. 中国临床医生杂志, 2015, 43 (7): 10–12. |
| [9] | Anuardo P, Verdier M, Gormezano NW, et al. Subclinical pulmonary in childhood systemic lupus erythematosus associated with minor disease manifestations[J]. Pediatr Cardiol, 2017, 38 (2): 234–239. DOI:10.1007/s00246-016-1504-6 |
| [10] | 邢燕, 宋红梅, 吴晓燕, 等. 小儿结缔组织病并发的肺动脉高压临床分析[J]. 中华儿科杂志, 2008, 46 (11): 822–826. DOI:10.3321/j.issn:0578-1310.2008.11.007 |
| [11] | 宋红梅, 魏珉. 儿童结缔组织病相关性肺动脉高压的诊断与治疗[J]. 中华儿科杂志, 2008, 46 (11): 847–850. DOI:10.3321/j.issn:0578-1310.2008.11.012 |
| [12] | Fei Y, Shi X, Gan F, et al. Death causes and pathogens analysis of systemic lupus erythematosus during the past 26 years[J]. Clin Rheumatol, 2014, 33 (1): 57–63. DOI:10.1007/s10067-013-2383-3 |
| [13] | Huang C, Li M, Liu Y, et al. Baseline characteristics and risk factors of pulmonary arterial hypertension in systemic lupus erythematosus patients[J]. Medicine (Baltimore), 2016, 95 (10): e2761. DOI:10.1097/MD.0000000000002761 |
| [14] | Kasparian A, Floros A, Gialafos E, et al. Raynaud's phenomenon is correlated with elevated systolic pulmonary arterial pressure in patients with systemic lupus erythematosus[J]. Lupus, 2007, 16 (7): 505–508. DOI:10.1177/0961203307080629 |
| [15] | Price LC, Wort SJ, Perros F, et al. Inflammation in pulmonary arterial hypertension[J]. Chest, 2012, 141 (1): 210–221. DOI:10.1378/chest.11-0793 |
| [16] | Hassoun PM, Mouthon L, Barbera JA, et al. Inflammation, growth factors, and pulmonary vascular remodeling[J]. J Am Coll Cardiol, 2009, 54 (1 Suppl): S10–S19. |
| [17] | Akdogan A, Kilic L, Dogan I, et al. Pulmonary hypertension in systemic lupus erythematosus:pulmonary thromboembolism is the leading cause[J]. J Clin Rheumatol, 2013, 19 (8): 421–425. DOI:10.1097/RHU.0000000000000037 |
| [18] | Takatsuki S, Soep JB, Calderbank M, et al. Connective tissue disease presenting with signs and symptoms of pulmonary hypertension in children[J]. Pediatr Cardiol, 2011, 32 (6): 828–833. DOI:10.1007/s00246-011-9950-7 |
| [19] | Huggins JL, Holland MJ, Brunner HI. Organ involvement other than lupus nephritis in childhood-onset systemic lupus erythematosus[J]. Lupus, 2016, 25 (8): 857–863. DOI:10.1177/0961203316644339 |
| [20] | Galiè N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the Diagnosis and Treatment of Pulmonary Hypertension[J]. Rev Esp Cardiol (Engl Ed), 2016, 69 (2): 177. |
| [21] | Kommireddy S, Bhyravavajhala S, Kurimeti K, et al. Pulmonary arterial hypertension in systemic lupus erythematosus may benefit by addition of immunosuppression to vasodilator therapy:an observational study[J]. Rheumatology (Oxford), 2015, 54 (9): 1673–1679. DOI:10.1093/rheumatology/kev097 |
| [22] | Prabu A, Gordon C. Pulmonary arterial hypertension in SLE:what do we know?[J]. Lupus, 2013, 22 (12): 1274–1285. DOI:10.1177/0961203313505010 |
| [23] | Sitbon O, Jaïs X, Savale L, et al. Upfront triple combination therapy in pulmonary arterial hypertension:a pilot study[J]. Eur Respir J, 2014, 43 (6): 1691–1697. DOI:10.1183/09031936.00116313 |
| [24] | Galiè N, Rubin LJ, Hoeper M, et al. Treatment of patients with mildly symptomatic pulmonary arterial hypertension with bosentan (EARLY study):a double-blind, randomised controlled trial[J]. Lancet, 2008, 371 (9630): 2093–2100. DOI:10.1016/S0140-6736(08)60919-8 |
| [25] | Rubin LJ, Badesch DB, Barst RJ, et al. Bosentan therapy for pulmonary arterial hypertension[J]. N Engl J Med, 2002, 346 (12): 896–903. DOI:10.1056/NEJMoa012212 |
| [26] | Chow SL, Chandran V, Fazelzad R, et al. Prognostic factors for survival in systemic lupus erythematosus associated pulmonary hypertension[J]. Lupus, 2012, 21 (4): 353–364. DOI:10.1177/0961203311429815 |
| [27] | 周广宇, 梁薇薇, 刘锋. 系统性红斑狼疮合并肺动脉高压38例临床分析[J]. 中华风湿病学杂志, 2009, 13 (8): 552–554. |
 2017, Vol. 19
2017, Vol. 19