抗N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor, NMDAR)脑炎是一种中枢神经系统自身免疫性脑炎。患者血清及脑脊液中可检测到NMDAR的自身抗体,以癫癎发作、意识水平下降、严重的智力减退、精神症状等脑功能障碍为主要表现。该病在儿童青少年群体中的发病率高于成人,小于18岁的脑炎患者中超过40%为抗NMDAR脑炎患者[1-2]。国外研究发现,大剂量激素和丙种球蛋白冲击治疗对部分抗NMDAR脑炎患者有效,但仍有30%的患者无效或遗留严重的神经功能损伤,死亡率为4%,需要进一步应用利妥昔单抗或环磷酰胺作为二线免疫治疗[3]。环磷酰胺是广谱的免疫抑制剂,能有效抑制B淋巴细胞介导的体液免疫和T细胞参与的细胞免疫,已广泛应用于各种免疫系统疾病的治疗,与利妥昔单抗相比具有价格低廉、使用方便等优点。然而迄今国内关于环磷酰胺治疗抗NMDAR脑炎的详细方案、疗效及安全性的研究尚未见报道。本研究对2014~2016年收治的一线方案治疗效果欠佳、采用环磷酰胺序贯治疗的抗NMDAR脑炎中的6例儿童患者的疗效及安全性进行分析总结。
1 资料与方法 1.1 研究对象收集2014年6月至2016年2月广州医科大学附属第二医院神经内科收治并确诊为抗NMDAR脑炎的6例患儿,其中男3例、女3例,年龄8(2~17)岁。6例患者血清、脑脊液的抗NMDAR-IgG均为阳性(抗NMDAR-IgG检测由欧蒙杭州医学实验诊断公司完成)。
收集6例患儿的临床资料,评估疗效及观察不良反应,随访至2016年12月。
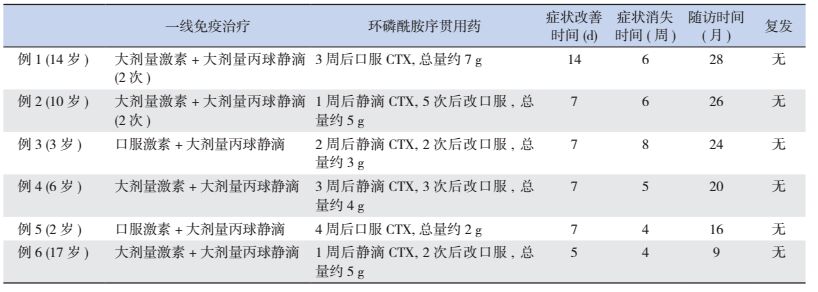
1.2 治疗6例患儿均首先使用激素联合大剂量丙种球蛋白的一线治疗方案。4例患儿静滴甲泼尼龙,每天15~20 mg/kg,5 d后改口服并逐渐减量,4~6个月内减停;2例口服甲强龙(每天16~20 mg),两周后逐渐减停。6例均联合静滴丙种球蛋白,每天0.4 g/kg×5 d。一线免疫冲击治疗后,观察1~4周,6例患儿仍有明显神经功能障碍,进一步接受环磷酰胺序贯治疗。4例患儿静滴环磷酰胺,每周一次(每次200~250 mg/m2),2~5次后改为口服(每日2~2.5 mg/kg),并每月减量0.5~0.8 mg/kg,认知能力基本恢复正常后逐渐减量;另2例患儿采用环磷酰胺口服(每日2~3 mg/kg),持续2~3个月,认知能力基本恢复正常后逐渐减量,4~6个月内减停。
2 结果 2.1 6例患儿的临床特征6例患儿中3例起病前一个月内有“发热、感冒”史。1例患儿在起病后15 d内确诊;4例在1~3个月内确诊;1例患儿从起病至确诊7个月。
5例患儿以癫癎发作为首发症状(其中3例为癫癎持续状态),1例首发症状为渐进性反应迟钝、懒言少动及继之出现的癫癎发作。其它症状包括意识障碍、精神症状和智力下降、认知障碍,以及不自主运动、植物神经功能异常、运动障碍。其中3例男性患儿出现运动障碍:1例上肢瘫,2例四肢肌张力减低,不能站立、行走。
6例患儿头部MRI的T1、T2序列均未发现明显异常,1例患儿的T2 Flair序列发现额叶皮层下白质内少量点状高信号病变。
6例患儿急性期脑电图背景呈慢波节律改变(4例患儿为全脑各导弥漫性2~5赫兹中-中高波幅慢活动;2例患儿背景脑波减慢为6~7赫兹,但额区和颞区阵发性中低波幅2~3赫兹慢波长程出现),慢活动背景下见单个或短程尖波、尖慢波呈同步性或局灶性发放。经有效免疫治疗,患儿临床症状减轻,3个月、半年及1年后复查脑电图:脑电活动改善,慢波逐渐消失;免疫治疗6个月后6例患儿的EEG基本正常。
2.2 疗效及安全性观察经一线免疫治疗1~4周后,6例患儿在精神症状、癫癎发作、不自主运动方面减轻;3例意识水平有所改善,能进行简单对答;所有患儿均仍有反应迟钝,失语、失读、失写、失算、失用、运动障碍等高级皮层功能受损的症状。使用环磷酰胺序贯治疗后,7 d内6例患儿均能进行简单切题对答;2~3周内,3名学龄期患儿能进行简单计算,读写能力有较大改善,生活自理能力基本恢复;2~3个月内,6例患儿认知功能均基本恢复至病前水平,生活自理能力恢复正常。随访6个月时,3例患儿就读高中或小学,1例患儿就读幼儿园大班、2例患儿在家学习,家长反映接受新知识的能力与同龄儿无异。截至最后随访时间(出院后第28个月),患儿均无癫癎发作,无精神症状,行走正常,生活均能自理;其中4例患儿成绩中等或偏下,1名幼儿就读普通幼儿园,1名幼儿在家看护。见表 1。
| 表 1 6例患儿免疫治疗方案及疗效 |
6例患儿在治疗期间均未出现血尿,也无腹痛、腹泻、纳差等胃肠道症状。患儿使用环磷酰胺后的1个月内每周检查一次血常规、肝肾功能,1个月后每两周检查一次血常规、肝肾功能,至环磷酰胺停用。1例在环磷酰胺治疗2个月后出现白细胞偏低(3.3×109/L),减量后血象恢复正常;6例患儿的肝肾功能均未发现异常。
3 讨论抗NMDAR脑炎儿童患者起病较为隐匿,早期症状如言语减少、反应迟钝、躁狂、缄默等精神行为异常容易被家长忽略。本组患儿均因反复抽搐以难治性癫癎入院,入院后才发现严重认知障碍。国外研究发现,90%的抗NMDAR脑炎起病1个月会出现下述症状中的至少3项:记忆力减退、精神症状、言语障碍、抽搐、不自主运动、意识水平下降[4]。因此对于新发抽搐的患儿要详细询问病史并进行高级皮层功能检查,一旦发现患儿有皮层功能损害或者脑电图弥漫性或额颞叶慢活动改变,应该及早检测脑脊液和血清中特异性抗NMDAR抗体以明确诊断。本组6例患儿均有特征性的口舌部不自主运动如反复伸缩舌头、舔咬唇、噘嘴、咀嚼样动作,但发作程度和频率个体差异较大。这种不自主运动症状对于抗NMDAR脑炎的诊断具有重要价值,应加以注意。此外患儿出现阵发性躁动、凝视、亚木僵状态,或不自主运动(震颤、发作性肌张力障碍)时,极易被误诊为癫癎发作或癫癎持续状态,有必要进行视频脑电图监测予以鉴别。
抗NMDAR脑炎的病因尚未明确,可能与肿瘤,感染及某些自身免疫性疾病有关。由于中枢神经系统外的某些诱因(畸胎瘤或感染)刺激淋巴细胞产生抗体,同时这些被激活的B细胞透过血脑屏障进入脑实质并增殖分化为浆母细胞和浆细胞,在鞘内及脑实质内产生更多的抗体[5]。抗NMDAR抗体的靶点为NMDAR的NRI亚基,自身免疫攻击使神经元细胞膜上的NMDAR发生内移,暴露于细胞膜表面的NMDAR数量减少,导致其介导的突触后电流减少,神经元不能完成正常生理功能。目前研究发现,神经元表面的NMDAR数量减少是可逆的,当自身抗体减少或消失后,NMDAR数量逐渐增多,甚至可恢复到正常水平[6]。NMDA神经元主要分布于海马、额叶皮层、杏仁核和下丘脑,直接参与学习过程,与突触重塑和记忆的形成、提取有关, 在维持正常的意识水平、思维活动中也发挥作用。患者这些脑区的NMDA神经元受到免疫攻击会出现神经元异常放电、学习记忆障碍、认知功能减退、意识水平下降和精神行为异常[7]。这种脑功能损伤在相当程度上是可逆的,MRI影像检查大多没有明显的结构性变化,通过及时有效的免疫治疗,患者神经功能损害能部分甚至完全恢复[8]。本研究观察到6例患儿经过系统的免疫治疗后,临床症状消失,受损的神经功能基本恢复,与上述结论一致。
一项关于577例抗NMDAR脑炎病人的研究发现,48%的不伴肿瘤患者对大剂量激素、丙球、血浆置换等一线治疗方案有效,其余52%的患者需要进行二线免疫治疗;而且环磷酰胺和利妥昔单抗单独或联合使用能对73%~84%一线治疗效果不佳的患者有很好的治疗作用,两者疗效相近,因此推荐早期进行免疫治疗,特别是对于不伴肿瘤的患者建议及时使用二线免疫治疗[9]。环磷酰胺能使T淋巴细胞、B淋巴细胞的绝对数量减少,并能选择性抑制B淋巴细胞功能,降低免疫球蛋白水平、抑制淋巴细胞的母细胞转化,对于由B淋巴细胞主导的自身免疫反应抑制作用较强。利妥昔单抗是针对CD20的单克隆抗体,能使CD20+的B细胞受到免疫攻击而耗竭,从而减少抗体产生。因此这两种免疫抑制剂都能有效抑制抗NMDAR脑炎患者脑内B细胞异常增多和B细胞功能过度活跃[9]。
利妥昔单抗价格昂贵,较常出现急性输液反应,而且增加各种感染的风险。因此本研究选择环磷酰胺作为二线免疫治疗药物,6例患儿经过环磷酰胺序贯治疗后均取得理想的治疗效果,用药1~2周后,患儿记忆和认知障碍就有明显改善;2~3个月后临床症状消失,生活能力、社交能力、学习能力逐渐恢复正常;6个月复查脑电图完全或基本恢复正常。而且环磷酰胺给药方式比较灵活,可根据病人具体情况选择剂型和给药方式,每周1~2次小剂量静脉给药与每天口服给药疗效相近。同时,本研究观察到合理使用环磷酰胺是安全的,在6例患者中仅一例在用药2个月时出现一过性白细胞减少,经过减少用药剂量,白细胞很快恢复正常;患儿的肝肾功能均正常,2名大于12岁的女性患儿月经情况正常。
综上,对于一线免疫治疗疗效欠佳的抗NMDAR脑炎患儿,推荐使用环磷酰胺作为序贯治疗药物以提高疗效,可避免遗留严重的神经功能损害。
| [1] | Dalmau J, Gleichman AJ, Hughes EG, et al. Anti-NMDA-receptor encephalitis:case series and analysis of the effects of antibodies[J]. Lancet Neurol, 2008, 7 (12): 1091–1098. DOI:10.1016/S1474-4422(08)70224-2 |
| [2] | Gable MS, Sheriff H, Dalmau J, et al. The frequency of autoimmune N-methyl-D-aspartate receptor encephalitis surpasses that of individual viral etiologies in young individuals enrolled in the California Encephalitis Project[J]. Clin Infect Dis, 2012, 54 (7): 899–904. DOI:10.1093/cid/cir1038 |
| [3] | Dalmau J, Lancaster E, Martinez-Hernandez E, et al. Clinical experience and laboratory investigations in patients with anti-NMDAR encephalitis[J]. Lancet Neurol, 2011, 10 (1): 63–74. DOI:10.1016/S1474-4422(10)70253-2 |
| [4] | Armangue T, Petit-Pedrol M, Dalmau J, et al. Autoimmune encephalitis in children[J]. J Child Neurol, 2012, 27 (11): 1460–1469. DOI:10.1177/0883073812448838 |
| [5] | Dalmau J, Tüzün EE, Wu HY, et al. Paraneoplastic anti-N-methyl-D-aspartate receptor encephalitis associated with ovarian teratoma[J]. Ann Neurol, 2007, 61 (1): 25–36. DOI:10.1002/ana.v61:1 |
| [6] | Hughes EG, Peng X, Gleichman AJ, et al. Cellular and synaptic mechanisms of anti-NMDA receptor encephalitis[J]. J Neurosci, 2010, 30 (17): 5866–5875. DOI:10.1523/JNEUROSCI.0167-10.2010 |
| [7] | Irani SR, Bera K, Waters P, et al. N-methyl-D-aspartate antibody encephalitis:temporal progression of clinical and paraclinical observations in a predominantly non-paraneoplastic disorder of both sexes[J]. Brain, 2010, 133 (Pt 6): 1655–1667. |
| [8] | Zuliani L, Graus F, Giometto B, et al. Central nervous system neuronal surface antibody associated syndromes:review and guidelines for recognition[J]. J Neurosurg Psychiatry, 2012, 83 (3): 638–645. |
| [9] | Titulaer MJ, McCracken L, Gabilondo I, et al. Treatment and prognostic factors for long-term outcome in patients with anti-NMDA receptor encephalitis:an observational cohort study[J]. Lancet Neurol, 2013, 12 (2): 157–165. DOI:10.1016/S1474-4422(12)70310-1 |
 2017, Vol. 19
2017, Vol. 19