呼吸道合胞病毒(respiratory syncytial virus, RSV)是婴幼儿急性呼吸道感染最常见的病原,常引起2岁内儿童发生毛细支气管炎及肺炎,目前缺乏特异性治疗。虽然大部分患儿预后良好,但少数RSV感染患儿可出现反复喘息,严重时可进展为重症肺炎甚至导致死亡。根据世界卫生组织估计,全世界每年感染RSV的人数约有6 400万,其中约16万人死亡[1]。RSV感染后不同的预后与RSV载量及机体病毒感染后的防御能力有关[2]。
干扰素(interferon, IFN)是机体产生的抗病毒及免疫调节的重要物质[3]。根据IFN氨基酸序列及特异性受体的不同,IFN分为Ⅰ型、Ⅱ型和Ⅲ型。近年来Ⅰ型IFN在呼吸系统抗病毒治疗中初见成效,但是具有全身性副作用。Ⅲ型IFN也叫λ干扰素(lambda interferon, IFN-λ),包括IFN-λ1、IFN-λ2、IFN-λ3和IFN-λ4。其中IFN-λ1~3和Ⅰ型IFN类似,具有抗病毒、免疫调节及抗肿瘤活性,但是由于IFN-λ的受体具有组织特异性,局限表达于上皮组织细胞,使其抗病毒作用更具有靶向性[4],且全身副作用少于Ⅰ型、Ⅱ型干扰素[5],理论上极有可能成为治疗呼吸道病毒感染的新秀。但是国内外研究呼吸道病毒与IFN-λ之间关系的资料不
多[6-8]。IFN-λ1作为IFN-λ中重要的一员,已有研究表明其在呼吸道病毒感染患者中的表达水平显著提高[4]。本研究观察RSV感染后患儿呼吸道上皮细胞中IFN-λ1表达水平的变化,以及IFN-λ1的表达水平与RSV载量的关系,为IFN-λ与病毒之间关系的后续相关研究提供有益参考。
1 资料与方法 1.1 研究对象选取2015年6月至2016年6月于湖南省人民医院儿童医学中心因呼吸道感染住院的患儿,采集患儿起病5 d内双侧鼻咽拭子各1份,其中1份鼻咽拭子进行直接免疫荧光抗原检测呼吸道常见7种病毒(包括RSV);选取其中有且仅有RSV检测阳性的患儿为RSV感染组,排除:(1)病程超过5 d;(2)痰培养、血培养结果阳性;(3)合并其他慢性疾病,如先天性心脏病、哮喘、免疫功能缺陷、遗传代谢性疾病等的患儿;共120例,其中男67例,女53例,年龄范围为0~5岁。采集同期来我院行健康体检儿童(1周内无就医情况,无发热、咳嗽等呼吸道症状)入院当天双侧鼻咽拭子各1份,同样取其中1份检测呼吸道常见7种病毒,以鼻咽拭子直接免疫荧光病毒抗原检测阴性的健康儿童为健康对照组,共50例,其中男27例,女23例,年龄范围为0~8岁。
1.2 标本采集所有入组研究对象取双侧鼻咽拭子各1份。由经过培训的护士将咽拭子由鼻伸入鼻咽部,伸入长度与从耳垂部到鼻尖的长度一致,拭子伸入后轻轻捻动转圈取样后洗脱至生理盐水中,1份行直接免疫荧光病毒抗原检测,另1份存至-80℃冰箱。
1.3 7项呼吸道病毒检测7项呼吸道病毒检测试剂盒购自上海贝西生物科技有限公司,呼吸道病毒抗原7项检测由湖南省人民医院检验科完成。
1.4 实时荧光定量PCR法检测IFN-λ1 mRNA和RSV mRNA表达将咽拭子样本室温解冻并混匀,取200 μL样本,用RNAsimple总RNA提取试剂盒(北京天根生化科技有限公司)提取总RNA,所有操作完全按试剂盒说明书进行。针对RSV病毒基因组设计特异性引物RSV-F和RSV-R,Taqman荧光探针RSV-P;针对IFN-λ1基因组设计特异性引物IFN-λ1-F和IFN-λ1-R,Taqman荧光探针IFN-λ1-P;根据管家基因GAPDH基因组设计特异性引物GAPDH-F和GAPDH-R,Taqman荧光探针GAPDH-P(表 1)。所有引物序列由上海百力格公司设计并合成。
| 表 1 GAPDH、IFN-λ1、RSV mRNA的引物和探针核苷酸序列 |
将样本提取的总RNA进行PCR反应。反应体系(湖南圣湘生物有限公司):将RSV-F/R/P(50 pmol/μL)各0.2 μL、GAPDH-F/R/P(50 pmol/μL)各0.2 μL、IFN-λ1-F/R/P(40 pmol/μL)各0.25 μL分别加入含Buffer 40 μL、H-Taq酶(5 U/μL)1 μL、Tth酶(5 U/μL)1 μL、Mn2+(50 mmol/L)1.5 μL、dNTPs(T)(40 pmol/μL)1.5 μL、总RNA 5 μL的混合液中。反应条件均为:95℃ 1 min,60℃ 30 min,95℃ 1 min,1个循环;95℃ 15 s,60℃ 30 s,45个循环;60℃ 30 s。
结果处理:(1)将CT值≤35的样本视为阳性,CT值在35~40的样本重复检测,两次检测CT值均 < 40则视为阳性结果,若第2次检测CT值 > 40,则视为阴性结果。(2)IFN-λ1 mRNA的相对含量=IFN-λ1 mRNA绝对定量/GAPDH mRNA绝对定量,然后将数据扩大10 000倍经log转换后进行对比分析。RSV载量为RSV mRNA绝对定量,将数据经log转换后进行对比分析。
1.5 统计学分析采用SPSS 19.0统计软件包对数据进行统计学分析。计量资料采用均数±标准差(x±s)表示,两组间比较采用t检验;多组间比较采用方差分析,组间两两比较采用SNK-q检验。连续变量相关性分析采用Pearson相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 扩增曲线各待测mRNA扩增良好,阴性对照中未见扩增曲线,提示反应体系合适且无污染。见图 1。
|
图 1 扩增曲线 A:阴性对照;B:RSV mRNA扩增曲线,C:IFN-λ1 mRNA扩增曲线,D:GAPDH mRNA扩增曲线。其中B和C均为FAM荧光通道,D为ROX荧光通道。阴性对照中所有通道均无S曲线,提示反应体系无污染。 |
2.2 不同年龄及性别RSV感染患儿IFN-λ1 mRNA的表达情况
将RSV感染组根据年龄分布分为 < 6个月组(n=48),6个月~组(n=42),1~5岁组(n=30),各年龄组患儿IFN-λ1 mRNA相对表达量分别为3.7±0.5、3.7±0.6、3.7±0.3,3组比较差异无统计学意义(F=0.79,P=0.51);根据性别分为男孩组(n=67)和女孩组(n=53),不同性别患儿IFN-λ1 mRNA相对表达量分别为3.8±0.7、3.6±0.8,两组比较差异无统计学意义(t=0.91,P=0.36)。
2.3 RSV感染组和健康对照组IFN-λ1 mRNA的表达情况对RSV感染组及健康对照组的IFN-λ1 mRNA表达量进行比较,健康对照组IFN-λ1 mRNA相对表达量(2.8±0.7)低于RSV感染组(3.7±0.8)(t=6.64,P < 0.05)。
2.4 RSV载量与IFN-λ1 mRNA的相关性分析为了解不同的RSV载量对IFN-λ1 mRNA的表达量是否有影响,采用Pearson相关分析对RSV感染组患儿IFN-λ1 mRNA的表达量和RSV载量作相关性分析,结果两者呈正相关(r=0.56,P < 0.05),见图 2。
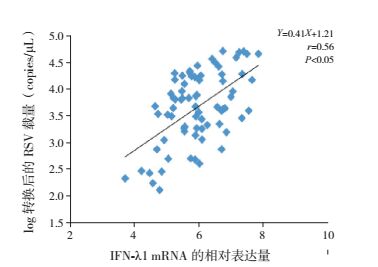
|
图 2 IFN-λ1 mRNA表达量与RSV载量的相关性分析 |
3 讨论
呼吸道病毒感染是危害儿童健康的重要疾病,儿童呼吸道病毒感染最常见的病原是RSV[9]。目前临床上可用于儿童的抗病毒药物少见,除流感病毒外,其他呼吸道常见病毒感染均缺乏特异治疗。INF-λ作为新发现的干扰素,可诱导机体抗病毒免疫,各种病毒和Toll样受体的刺激都能诱导IFN-λ表达[10],而且其受体具有组织特异性,有望成为全身副作用小的靶向抗病毒药物[11]。目前已有体外研究表明IFN-λ与呼吸道病毒感染之间关系密切[7, 12]。也有学者研究发现,IFN-λ在体内和体外的抗病毒活性有差别[13]。但目前IFN-λ在呼吸道上皮细胞中的表达水平与呼吸道病毒感染的具体关系尚不明确,仅少有的研究也多为离体实验,结论也不完全一致。因此,IFN-λ与病毒感染的确切关系有待深入研究。
在Ⅲ型IFN所有成员中,IFN-λ3的抗病毒活性最高,其次是IFN-λ1[14],但只有IFN-λ1可以在原核表达系统里高效表达,为更好地服务于后续实验,故此次研究的是IFN-λ1与RSV的关系。
本次实验利用临床鼻咽拭子研究了IFN-λ1在呼吸道上皮细胞中的表达及其与RSV的关系,实验标本均来自于临床病人,相比于体外实验,本研究得出的结果更能反映体内的情况。而且本研究选取直接免疫荧光病毒抗原检测有且仅有RSV感染,细菌培养(-)的患儿作为RSV感染组,尽可能去除混合感染的干扰,同时选取直接免疫荧光病毒抗原检测阴性的健康儿童作为对照组,排除隐性感染的干扰,使结论更趋可靠。
本次研究结果显示,RSV感染患儿的IFN-λ1 mRNA表达量高于健康儿童,与年龄及性别无关,这与Selvaggi等[4]的研究结果一致,佐证了RSV可诱导IFN-λ1表达水平上调的结论。
Contoli等[15]曾证明IFN-λ表达水平与病毒载量的关系为负相关。而本次研究发现,RSV感染组IFN-λ1 mRNA表达量与RSV载量呈正相关,提示体内RSV载量越高,IFN-λ1的表达水平越高。与本此次研究不同的是,Contoli等[15]的实验对象为哮喘患者,而本研究对象均无基础疾病,这提示IFN-λ1的表达水平可能与机体的基础状态有关。此外,Contoli等[15]研究的是鼻病毒与IFN-λ1的关系,而本研究是探讨RSV与IFN-λ1的关系,这提示可能不同的呼吸道病毒感染对IFN-λ1的诱导作用不相同。
综上所述,IFN-λ1在RSV感染进程中高表达,且IFN-λ1的表达水平与病毒载量呈正相关。作为一个重要的抗病毒和免疫调节因子,考虑IFN-λ1在病毒高复制期机体抗病毒过程中应发挥了重要作用;深入研究IFN-λ在呼吸道病毒感染中的生物学功能,对阐明呼吸道病毒感染后机体的免疫应答有一定作用,对抗病毒新药物的研究也具有重要意义。
| [1] | Maggon K, Barik S. New drugs and treatment for respiratory syncytial virus[J]. Rev Med Virol, 2004, 14 (3): 149–168. DOI:10.1002/(ISSN)1099-1654 |
| [2] | Hasegawa K, Jartti T, Mansbach JM, et al. Respiratory syncytial virus genomic load and disease severity among children hospitalized with bronchiolitis:multicenter cohort studies in the United States and Finland[J]. J Infect Dis, 2015, 211 (10): 1550–1559. DOI:10.1093/infdis/jiu658 |
| [3] | Zickert A, Oke V, Parodis I, et al. Interferon (IFN)-λ is a potential mediator in lupus nephritis[J]. Lupus Sci Med, 2016, 3 (1): e000170. DOI:10.1136/lupus-2016-000170 |
| [4] | Selvaggi C, Pierangeli A, Fabiani M, et al. Interferon lambda 1-3 expression in infants hospitalized for RSV or HRV associated bronchiolitis[J]. J Infect, 2014, 68 (5): 467–477. DOI:10.1016/j.jinf.2013.12.010 |
| [5] | Eslam M, George J. Targeting IFN-λ:therapeutic implications[J]. Expert Opin Ther Targets, 2016, 20 (12): 1425–1432. DOI:10.1080/14728222.2016.1241242 |
| [6] | Bullens DM, Decraene A, Dilissen E, et al. Type Ⅲ IFN-λ mRNA expression in sputum of adult and school-aged asthmatics[J]. Clin Exp Allergy, 2008, 38 (9): 1459–1467. DOI:10.1111/cea.2008.38.issue-9 |
| [7] | Lin M, Yu HP. Dexamethasone decreases IL-29 expression in house dust mite-stimulated human bronchial epithelial cells[J]. J Huazhong Univ Sci Technolog Med Sci, 2015, 35 (6): 823–827. DOI:10.1007/s11596-015-1513-3 |
| [8] | 王怡, 刘沙, 魏溪, 等. IL-29和TGF-β1在肺癌中的表达及临床意义[J]. 江苏大学学报(医学版), 2016, 26 (5): 458–460. |
| [9] | 刘军, 刘春艳, 谢正德, 等. 儿童急性下呼吸道合胞病毒单一感染与混合感染对照研究[J]. 中国实用儿科杂志, 2015, 30 (11): 848–851. |
| [10] | Iversen MB, Paludan SR. Mechanisms of type Ⅲ interferon expression[J]. J Interferon Cytokine Res, 2010, 30 (8): 573–578. DOI:10.1089/jir.2010.0063 |
| [11] | Pagliaccetti NE, Robek MD. Interferon-λ in the immune response to hepatitis B virus and hepatitis C virus[J]. J Interferon Cytokine Res, 2010, 30 (8): 585–590. DOI:10.1089/jir.2010.0060 |
| [12] | Ilyushina NA, Donnelly RP. In vitro anti-influenza A activity of interferon (IFN)-λ1 combined with IFN-β or oseltamivir carboxylate[J]. Antiviral Res, 2014, 111 : 112–120. DOI:10.1016/j.antiviral.2014.09.008 |
| [13] | Durbin RK, Kotenko SV, Durbin JE. Interferon induction and function at the mucosal surface[J]. Immunol Rev, 2013, 255 (1): 25–39. DOI:10.1111/imr.2013.255.issue-1 |
| [14] | Dellgren C, Gad HH, Hamming OJ, et al. Human interferon-λ3 is a potent member of the type Ⅲ interferon family[J]. Genes Immun, 2009, 10 (2): 125–131. DOI:10.1038/gene.2008.87 |
| [15] | Contoli M, Message SD, Laza-Stanca V, et al. Role of deficient type Ⅲ interferon-λ production in asthma exacerbations[J]. Nat Med, 2006, 12 (9): 1023–1026. DOI:10.1038/nm1462 |
 2017, Vol. 19
2017, Vol. 19



