肠上皮细胞紧密连接(tight junction, TJ)的完整性是维持肠黏膜屏障功能的必备条件,肠黏膜屏障功能受损,肠壁渗透性增高,肠腔内的致病菌等有害物质进入黏膜组织和循环系统,导致炎症性肠病(inflammatory bowel disease, IBD)及全身炎症反应等[1]。闭锁蛋白1(zonula occludens protein-1, ZO-1)是构成TJ的主要结构蛋白,其表达量和/或位置分布的改变均能影响肠黏膜屏障功能[2]。目前已有多项研究证实,IBD患者肠道中粘附侵袭性大肠杆菌(adherent-invasive Escherichia coli, AIEC)明显增多[3-4]。自1998年在克罗恩患者的病变回肠组织中发现具有粘附、侵袭能力的大肠杆菌(E.coli)LF82之后,该菌种被广泛用于AIEC相关的研究中[5]。E.coli LF82通过菌毛与黏膜表面受体人癌胚抗原相关细胞粘附分子6(CEACAM6)相结合,粘附、侵入肠上皮细胞,在细胞内生存并复制,介导细胞释放大量炎症因子TNF-α,而TNF-α又可诱导CEACAM6高表达,导致肠道持续性炎症[6]。同时,TNF-α可抑制ZO-1 mRNA转录而影响ZO-1的表达,从而破坏肠上皮紧密连接的完整性[7]。二十碳五烯酸(eicosapentaenoic acid, EPA)能有效预防紧密连接结构的破坏,并具有抗炎作用[8-9]。人结肠癌细胞株Caco-2细胞,在正常培养条件下,能分化并融合成连续的单层细胞,具有类似于肠上皮细胞的功能和结构[10]。因此本研究以EPA和/或E.coli LF82菌种作用于Caco-2细胞,旨在探讨EPA对E.coli LF82感染后的ZO-1 mRNA的影响。
1 材料与方法 1.1 主要试剂与仪器粘附侵袭性大肠杆菌LF82菌株(E.coli LF82,法国克莱蒙费朗第一大学Darfeuille-Michaud教授馈赠);Caco-2细胞(ATCC);DMEM高糖培养基、胰酶(Hyclone,美国);胎牛血清(Gibco,美国);酵母提取物、胰蛋白胨、琼脂糖(OXOID,英国);细胞培养瓶、细胞培养板、细菌培养皿(Corning,美国);插入式细胞培养皿(6.5 mm直径,0.4 μm孔径)、玻璃细胞培养小室(Millicell® EZ SLIDE,8孔)(Millipore,美国);氨苄青霉素、EPA(相对分子量302,Sigma,美国);Trizol(Life Technologies,美国);反转录试剂盒(Thermo Scientific,美国);2×Realstar Green Power Mixture(GenStar,北京);人TNF-α ELISA试剂盒(ExCell Biotech,上海);碱性磷酸酶(ALP)检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒(碧云天生物技术研究所);PCR引物由上海生工合成。
1.2 细菌培养及计数新鲜配置并高压灭菌LB培养基,在无菌培养板(含氨苄青霉素50 μg/mL)中挑取E.coli LF82菌株单克隆,接种于LB培养液,放入振荡孵箱,以37℃、220 r/min培养约14 h至生长平台期。吸取100 μL,连续梯度稀释,分光光度计600 nm处测定吸光值。当OD=1时,细菌培养液的浓度为1×109 CFU/mL。
1.3 Caco-2细胞培养DMEM中加入10%胎牛血清、1%双抗(青霉素和链霉素),在37℃,含5%CO2条件下培养Caco-2细胞,隔天换液,当细胞生长至80%~90%融合时,用0.25%的胰酶-EDTA常规消化、传代。将2×104个细胞(200 μL)接种于Transwell细胞培养小室内,将细胞小室放入24孔板内(含1.3 mL细胞培养液),隔天换液,并在倒置显微镜下观察细胞形态,21 d左右形成单层,即可用于后续实验。
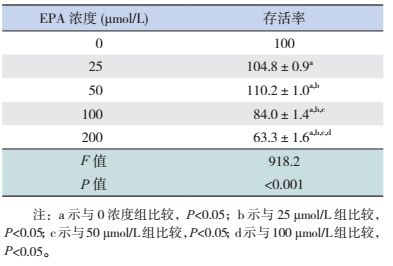
1.4 细胞干预Caco-2细胞接种于96孔板,每孔约2×104细胞,培养24 h。分5组:对照组(EPA 0浓度),EPA 25 μmol/L、50 μmol/L、100 μmol/L和200 μmol/L组,每组5个复孔,实验重复3次。孵育96 h后收集细胞及上清,检测细胞存活率、凋亡率、ZO-1 mRNA及TNF-α表达。
EPA处理96 h后,加入无血清细胞培养液和E.coli LF82(MOI=100 : 1),培养6 h、12 h,收集细胞及上清,检测ZO-1 mRNA及TNF-α的表达。
1.5 MTT法检测Caco-2细胞的细胞存活率消化处于对数生长期的各组Caco-2细胞,制成单细胞悬液并计数,调整细胞浓度至1×105/mL,以每孔2×104(200 μL)细胞接种于96孔板。分别于接种后第3、6、9、12、16、19和21天取5个孔,PBS清洗,每孔加5 mg/mL的MTT溶液20 μL,37℃孵育4 h,弃去上清液,每孔加入150 μL DMSO,室温避光震荡10 min,使紫色结晶物充分溶解。以空白孔调零,在酶联免疫检测仪上490 nm波长处测定吸光度A值,绘制细胞生长曲线;并检测各组吸光度(A)值。
Caco-2细胞存活率(%)=(AEPA-A空白)/(A对照-A空白)。
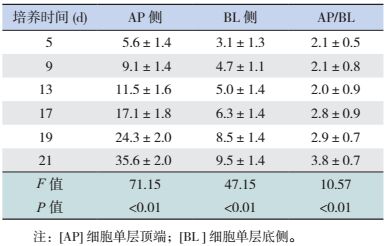
1.6 Caco-2细胞单层极性的变化分别在接种于Transwell细胞小室内的各组细胞培养至第5,9,13,17,19,21天,取Caco-2细胞单层顶端(AP侧)及底侧(BL侧)适量培养基。按ALP检测试剂盒说明书操作,酶联免疫检测仪测定各组吸光度值,根据标准曲线计算ALP含量。
1.7 流式细胞技术检测Caco-2细胞凋亡情况细胞接种于6孔板,每孔约1×105个细胞,培养24 h后分5组予以EPA干预:对照组(不含EPA),EPA 25 μmol/L、50 μmol/L、100 μmol/L和200 μmol/L组,每组5个复孔,实验重复3次。不同浓度EPA与Caco-2细胞孵育96 h,流式细胞仪检测各组细胞凋亡,操作按照Annexin V-FITC凋亡检测试剂盒说明书进行。
1.8 RT-qPCR检测ZO-1 mRNA的表达按照TRIzol试剂盒说明书提取各组细胞总RNA,逆转录cDNA,-20℃保存。采用三步法Real-time Q-PCR检测ZO-1 mRNA。反应体系为25 μL,预变性:95℃,10 min;变性:95℃,15 s;退火:53℃,30 s;延伸:72℃,35 s;循环次数:40次。ZO-1上游引物:5'-CAGAACCAAAGCCTGTG-TATG-3',下游引物:5'-TTAGGTAGGACACCAT-CAGATGGA-3'。内参GAPDH上游引物:5'-GCACC-GTCAAGGCTGAGAAC-3',下游引物:5'-ATGGTGG-TGAAGACGCCAGT-3'。以GAPDH mRNA的CT值标化ZO-1 mRNA的CT值,得到ZO-1 mRNA相对CT值,采用2-ΔΔCt法进行计算。
1.9 酶联免疫吸附法检测TNF-α的表达收集各组的上清液,采用人TNF-α ELISA试剂盒,以标准品浓度1 000 pg/mL、500 pg/mL、250 pg/mL、125 pg/mL、62.5 pg/mL、31.25 pg/mL、15.62 pg/mL、0 pg/mL的OD值作标准曲线,根据标准曲线计算待测样品TNF-α含量。
1.10 统计学分析应用SPSS 19.0统计软件进行数据处理。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验。P < 0.05为差异有统计学意义。
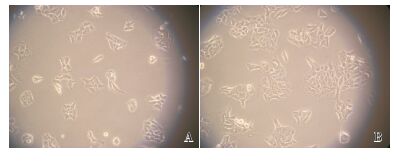
2 结果 2.1 Caco-2细胞形态学观察及生长曲线在细胞接种后第2天,倒置显微镜观察Transwell小室内的细胞:细胞呈多边形、贴壁;第5天,细胞呈上皮样形态,融合成片,细胞与细胞之间有清晰的边界且排列整齐;一周后,由于聚碳酸酯膜的影响,镜下很难清楚地观察到细胞形态。见图 1。
|
图 1 Caco-2细胞形态观察(10×20) A:培养第2天,细胞贴壁,呈多边形;B:培养第5天,细胞融合成片,边界清晰。 |
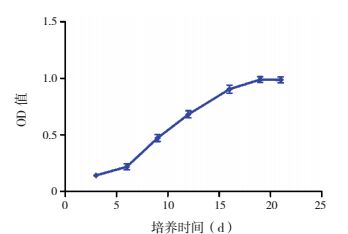
MTT结果显示,细胞接种后的前6 d生长较慢,6~16 d生长迅速,至19~21 d时细胞生长基本平稳。见图 2。
|
图 2 Caco-2细胞生长曲线图 |
2.2 Caco-2细胞单层极性检测结果
细胞单层AP侧及BL侧的碱性磷酸酶含量随培养时间延长而增加,第21天两侧碱性磷酸酶含量的比值达3.8 : 1。见表 1。
| 表 1 Caco-2细胞AP侧与BL侧碱性磷酸酶含量的动态变化 (x±s,U/L) |
2.3 MTT法检测细胞存活率
EPA浓度为25、50 μmol/L时,细胞存活率较0 μmol/L组增加(P < 0.05),其中50 μmol/L EPA组的细胞存活率高于25 μmol/L组(P < 0.05);EPA浓度为100、200 μmol/L时,细胞存活率随浓度增高而降低,并且均低于0浓度组和EPA 25 μmol/L组、50 μmol/L组,差异具有统计学意义(P < 0.05)。见表 2。
| 表 2 不同浓度EPA作用后的细胞存活率 (x±s,%) |
2.4 流式细胞术检测细胞凋亡率
EPA浓度为0、25、50、100、200 μmol/L时,细胞凋亡率分别为6.8%±0.9%、8.3%±0.9%、10.7%±2.0%、25.4%±1.8%、45.5%±1.3%,EPA浓度为25、50 μmol/L时,细胞凋亡率与0浓度组的差异无统计学意义(P > 0.05);EPA浓度为100、200 μmol/L时,凋亡率随浓度而增加,均高于0浓度组(P < 0.05)。见图 3。
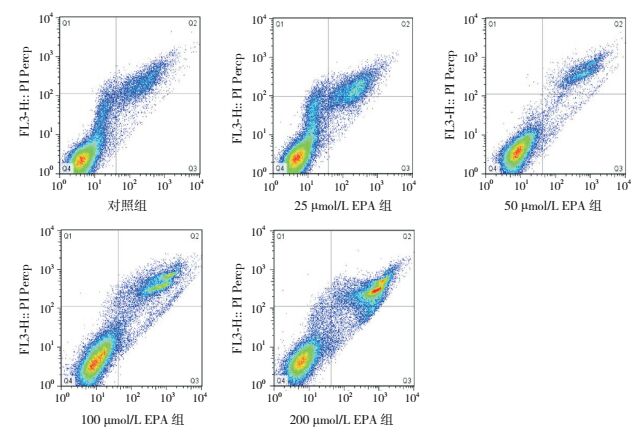
|
图 3 不同浓度EPA处理后的Caco-2细胞凋亡情况 Q2象限细胞为晚期凋亡和坏死细胞。 |
2.5 RT-qPCR检测ZO-1 mRNA的表达
单独E.coli LF82处理6 h或12 h,Caco-2细胞的ZO-1 mRNA表达随处理时间延长而减少,均少于空白处理组(P < 0.05)。EPA 25、50 μmol/L干预联合LF82处理6 h或12 h,Caco-2细胞的ZO-1 mRNA表达随EPA浓度增加而增加,均高于单独LF82处理组(P < 0.05);但ZO-1 mRNA表达不随LF82处理时间延长而变化(P > 0.05)。见图 4。
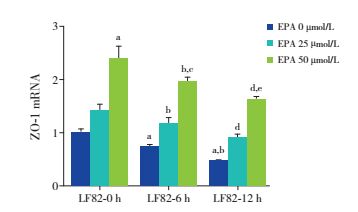
|
图 4 不同处理组Caco-2细胞的ZO-1 mRNA表达 a示与未处理的Caco-2细胞比较,P < 0.05;b示与单独LF82处理6 h组比较,P < 0.05;c示与EPA 25 μmol/L+LF82处理6 h组比较,P < 0.05;d示与单独LF82处理12 h组比较,P < 0.05;e示与EPA 25 μmol/L+LF82处理12 h组比较,P < 0.05。 |
2.6 ELISA检测培养上清中TNF-α的分泌量
单独LF82处理6 h、12 h组的TNF-α表达随处理时间延长而增加,均高于空白处理组(P < 0.05)。EPA 25、50 μmol/L干预联合LF82处理6 h或12 h,细胞上清中TNF-α的表达随EPA浓度增加而减少,均少于单独LF82处理组(P < 0.05);但TNF-α表达不随处理时间延长而变化(P > 0.05)。见图 5。
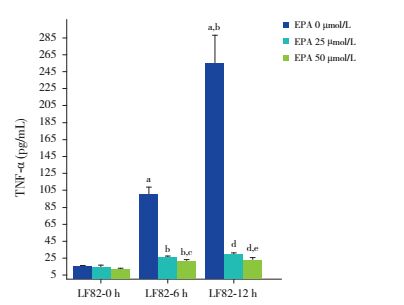
|
图 5 不同处理组Caco-2细胞的TNF-α表达 a示与未处理Caco-2细胞比较,P < 0.05;b示与单独LF82处理6 h组比较,P < 0.05;c示与EPA 25 μmol/L+LF82处理6 h组比较,P < 0.05;d示与单独LF82处理12 h组比较,P < 0.05;e示与EPA 25 μmol/L+LF82处理12 h组比较,P < 0.05。 |
3 讨论
肠上皮细胞间的紧密连接是肠黏膜屏障的基础,其受损可引起肠壁通透性增高,肠腔内毒性物质及微生物进入黏膜组织和循环系统,导致免疫紊乱及炎症反应[1]。
Caco-2细胞株来源于人结肠癌细胞,培养21 d后可形成发达的紧密连接、类小肠微绒毛结构及小肠刷状缘水解酶,能有效模拟肠黏膜屏障,被广泛作为肠黏膜屏障模型[10]。本研究显示,培养19~21 d时,Caco-2细胞分裂已趋于饱和,细胞与细胞之间形成紧密连接;第21天的细胞单层AP侧及BL侧的ALP含量比值为3.8 : 1,接近文献报道的3 : 1。表明ALP已经聚集于刷状缘侧(AP侧),细胞单层出现了明显的极化现象,与体外肠上皮细胞极性相似,说明Caco-2细胞在培养21 d左右可用于模拟肠上皮细胞。
EPA可通过抑制NF-κB信号通路发挥抗炎作用,还能有效预防热休克诱导的肠黏膜屏障损伤[8-11]。本研究显示,EPA浓度为25、50 μmol/L时,Caco-2细胞增殖呈浓度依赖性;而浓度为100、200 μmol/L时,Caco-2细胞增殖明显受抑;并且EPA浓度为100、200 μmol/L时细胞凋亡。说明小剂量EPA能诱导Caco-2细胞增殖,大剂量则诱导凋亡,可能与大剂量EPA的毒性有关。
ZO-1是第一个被确定的紧密连接相关蛋白,是紧密连接复合物中的支架蛋白,当ZO-1受到破坏,紧密连接的屏障功能随之受损[12]。本研究结果显示,EPA处理组的ZO-1 mRNA表达量增高;而在EPA预处理96 h后加入LF82,ZO-1 mRNA的表达高于单独LF82处理组。说明EPA能有效预防LF82感染后肠上皮细胞紧密连接的损伤;并发现单独LF82干预后TNF-α的表达增高,而EPA联合LF82干预的TNF-α的分泌量降低,说明EPA能抑制LF82感染诱导的炎症因子分泌。
综上所述,EPA能有效预防E.coli LF82感染后肠上皮细胞紧密连接的破坏,抑制炎症因子的分泌,对肠黏膜屏障有一定的保护作用。
| [1] | Lee SH. Intestinal permeability regulation by tight junction:implication on inflammatory bowel diseases[J]. Intest Res, 2015, 13 (1): 11–18. DOI:10.5217/ir.2015.13.1.11 |
| [2] | Tokuda S, Higashi T, Furuse M. ZO-1 knockout by TALEN-mediated gene targeting in MDCK cells:involvement of ZO-1 in the regulation of cytoskeleton and cell shape[J]. PLoS One, 2014, 9 (8): e104994. DOI:10.1371/journal.pone.0104994 |
| [3] | Martinez-Medina M, Aldeguer X, Lopez-Siles M, et al. Molecular diversity of Escherichia coli in the human gut:new ecological evidence supporting the role of adherent-invasive E.coli (AIEC) in Crohn's disease[J]. Inflamm Bowel Dis, 2009, 15 (6): 872–882. DOI:10.1002/ibd.20860 |
| [4] | Chassaing B, Darfeuille Michaud A. The commensal microbiota and enteropathogens in the pathogenesis of inflammatory bowel diseases[J]. Gastroenterology, 2011, 140 (6): 1720–1728. DOI:10.1053/j.gastro.2011.01.054 |
| [5] | Ossa JC, Ho NK, Eytan W, et al. Adherent-invasive Escherichia coli blocks interferon-γ-induced signal transducer and activator of transcription (STAT)-1 in human intestinal epithelial cells[J]. Cell Microbiol, 2013, 15 (3): 446–457. DOI:10.1111/cmi.2013.15.issue-3 |
| [6] | Darfeuille-Michaud A. Adherent-invasive Escherichia coli:a putative new E.coli, pathotype associated with Crohn's disease[J]. Int J Med Microbiol, 2002, 292 (3-4): 185–193. DOI:10.1078/1438-4221-00201 |
| [7] | Aveleira CA, Lin CS, Ambrosio AF, et al. TNF-alpha signals through PKCζ/NF-κB to alter the tight junction complex and increase retinal endothelial cell permeability[J]. Diabetes, 2010, 59 (11): 2872–2882. DOI:10.2337/db09-1606 |
| [8] | Xiao GZ, Tang LQ, Yuan FF, et al. Eicosapentaenoic acid enhances heat stress-impaired intestinal epithelial barrier function in Caco-2 cells[J]. PLoS One, 2013, 8 (9): e73571. DOI:10.1371/journal.pone.0073571 |
| [9] | Davidson J, Higgs W, Rotondo D. Eicosapentaenoic acid suppression of systemic inflammatory responses and inverse up-regulation of 15-deoxyΔ12, 14 Prostaglandin J2 production[J]. Br J Pharmacol, 2013, 169 (5): 1130–1139. DOI:10.1111/bph.12209 |
| [10] | Smetanová L, Stĕtinová V, Svoboda Z, et al. Caco-2 cells, biopharmaceutics classification system (BCS) and biowaiver[J]. Acta Medica, 2011, 54 (1): 3–8. |
| [11] | Mobraten K, Haug TM, Kleiveland CR, et al. Omega-3 and omega-6 PUFAs induce the same GPR120-mediated signalling events, but with different kinetics and intensity in Caco-2 cells[J]. Lipids Health Dis, 2013, 12 (1): 101. DOI:10.1186/1476-511X-12-101 |
| [12] | Fanning AS, Anderson JM. Zonula occludens-1 and -2 are cytosolic scaffolds that regulate the assembly of cellular junctions[J]. Ann N Y Acad Sci, 2009, 1165 : 113–120. DOI:10.1111/j.1749-6632.2009.04440.x |
 2017, Vol. 19
2017, Vol. 19