2. 中南大学湘雅二医院儿童医学中心, 湖南 长沙 410011
肾脏纤维化以成纤维细胞及基质蛋白积聚并伴随肾单位功能丧失为特征,是进展性肾脏疾病的主要病理过程[1]。转化生长因子(transforming growth factor, TGF)-β/Smad信号通路及肾小管上皮间充质转化(epithelial-mesenchymal transition, EMT)在肾脏纤维化中起关键作用[2-4]。研究发现,microRNAs(miRNAs)可通过调控TGF-β/Smad信号通路促进或抑制肾小管EMT,并最终影响肾脏纤维化进程[5-7]。
miR-145作为miRNAs家族成员之一,目前研究多集中于肿瘤及心血管领域[8-10]。新近,Yang等[11]发现miR-145通过调节α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)表达,对肺纤维化的发生起重要作用。Megiorni等[12]显示miR-145作为关键调控因子之一,下调Smad3 mRNA表达,减少囊性纤维化发病。然而,miR-145是否可参与肾脏纤维化调控且作用机制如何,尚无文献报道。本研究以TGF-β1诱导的体外肾小管间质纤维化模型为研究对象,通过pCMV-miR-145表达质粒转染人肾小管上皮细胞(HK-2),初步探讨miR-145对HK-2细胞EMT的可能作用。
1 材料与方法 1.1 材料与试剂HK-2细胞购于美国模式菌种收集中心。真核细胞表达载体pCMV-myc、感受态细胞E.coli DH5α、限制性核酸内切酶EcoRI、KpnⅠ和T4 DNA连接酶(长沙艾佳生物技术有限公司),PCR引物、质粒抽提试剂盒(上海生工生物工程有限公司),脂质体转染试剂Lipofectamine 2000(美国Invitrogen公司),胎牛血清、DMEM/F12(美国Gibco公司),miRNA实时定量聚合酶链反应(PCR)试剂盒、Matrigel胶、Transwell小室(加拿大Fermentas公司),TGF-β1(美国Pepro Tech公司),Smad3、Smad2/3和p-Smad2/3(美国Gene Tex公司),α-SMA(美国Abcam公司),纤维连接蛋白(fibronectin, FN)和Ⅰ型胶原蛋白(typeⅠ collagen, Col Ⅰ)(美国Santa Cruz公司),辣根过氧化物酶标记山羊抗鼠二抗(北京中衫金桥生物技术有限公司),β-actin(北京康为世纪生物技术有限公司),FN和ColⅠ ELISA试剂盒(武汉博士德生物工程有限公司)。
1.2 miR-145前体序列的扩增根据miRBase(www.mirbase.org)查询获得hsa-miR-145前体序列(M10000461),再通过UCSC基因组阅览器进行BLAST对比获取其基因组序列。PrimerⅠ:5'-CGGAATTCGGCTGGATGC-AGAAGAGAAC-3',PrimerⅡ:5'-GCGGTACCGCC-TTCTTCTTGAACCCTCA-3'。PrimerⅠ中加入EcoRI酶切位点,PrimerⅡ中加入KpnⅠ酶切位点。PCR反应条件:95℃预变性5 min;95℃变性30 s,63℃退火30 s,72℃延伸50 s,30个循环;72℃延伸5 min。
1.3 miR-145真核表达载体的构建miR-145基因扩增产物经琼脂糖电泳回收,T载体连接测序证实无突变后,双酶切克隆入真核表达载体pCMV-myc中,转化E.coli DH5α感受态细胞,筛选阳性克隆,送至上海生工生物工程有限公司进行测序鉴定。经酶切测序证实后将所得正确重组质粒命名为pCMV-miR-145,TiP500质粒抽提试剂盒抽提质粒保存。
1.4 细胞培养、转染及分组含10%胎牛血清、100 IU/mL青霉素和100 IU/mL链霉素的DMEM高糖培养液在37℃、5%CO2环境中培养HK-2细胞。用胰蛋白酶消化后接种于6孔培养板,待细胞融合至80%时,换成无血清培养基培养,同步化24 h后分别加入5μg/L TGF-β1培养24 h。另外,采用Lipofectamine 2000脂质载体转染HK-2细胞24 h,具体操作按试剂盒说明书进行,再给予5 μg/L TGF-β1孵育24 h。实验分组分为两部分:(1)将HK-2细胞分为对照组(未经任何处理)、空白质粒组(以pCMV-myc空白质粒转染HK-2细胞)、miR-145组(以pCMV-miR-145质粒转染HK-2细胞)。(2)将HK-2细胞分为对照组(未经任何处理)、TGF-β1组(以5 μg/L TGF-β1处理HK-2细胞24 h)、TGF-β1空白质粒组(以pCMV-myc空白质粒转染HK-2细胞后再经5 μg/L TGF-β1处理24 h);TGF-β1+miR-145组(以pCMV-miR-145质粒转染HK-2细胞后再经5 μg/L TGF-β1处理24 h)。
1.5 实时荧光定量PCR检测miR-145的表达按TRIzol试剂说明书提取总RNA,琼脂糖凝胶电泳检测RNA的完整性,RNA吸光度A260/A280为1.9~2.1时方可用于检测。miR-145的cDNA合成采用特异性颈环引物,逆转录相关操作按试剂盒说明书进行。实时荧光定量PCR严格按照试剂盒操作说明进行。PCR反应条件:95℃预变性10 min;95℃变性15 s,60℃退火和延伸60 s,共40个循环。采用U6做参考基因,计算相对表达量。miR-145相对表达量用2-ΔΔCT公式计算[13],ΔΔCT=(实验组目的基因Ct值-实验组内参基因Ct值)-(对照组目的基因Ct值-对照组内参基因Ct值),每组平行设6个样本,实验独立重复3次。
1.6 Western blot印迹分析收集细胞加裂解液30 min后离心,取5~10 μL上清BCA法测定蛋白浓度。每上样孔加30 μg总蛋白,采用10%SDS-PAGE电泳、转膜、封闭后分别加入抗人TGF-β1(1 : 400)、Smad3(1 : 500)、Smad2/3(1 : 500)、p-Smad2/3(1 : 500)、α-SMA(1 : 2 000)、FN(1 : 1 000)、ColⅠ(1 : 2 000)及β-actin(1 : 1 000)一抗,4℃孵育过夜,次日PBST洗膜,加1 : 10 000辣根过氧化物酶标记的二抗(1 : 3 000)室温孵育1 h。加ECL液在柯达4000MM化学发光成像仪曝光显像,采用Labwork 4.0图像分析软件行半定量分析。每组平行设6个样本,实验独立重复3次。
1.7 ELISA检测按FN和ColⅠ免疫试剂盒说明书分别检测细胞上清液中总FN及ColⅠ含量。每组平行设6个复孔,实验独立重复3次。
1.8 统计学分析采用SPSS 17.0统计学软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Bonferroni法,P < 0.05为差异有统计学意义。
2 结果 2.1 不同分组细胞形态特点光镜(nikon eclipse E400,日本)下显示,对照组细胞间连接紧密,呈鹅卵石样生长。TGF-β1组中细胞间隙明显增加,部分细胞与周围细胞脱离,形态由鹅卵石形转变为梭形。TGF-β1+miR-145组细胞大部分恢复为鹅卵石样,但仍有少部分为梭形,细胞脱离黏附的现象也有所减少。见图 1。
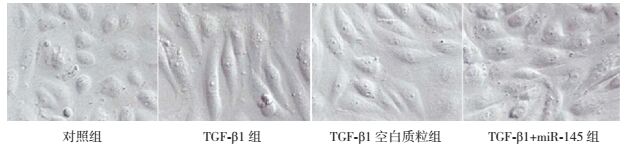
|
图 1 各组细胞光镜下形态学改变(×200) 对照组细胞连接紧密,呈鹅卵石样;TGF-β1组细胞间隙明显增加,部分细胞与周围细胞脱离,呈梭形;TGF-β1空白质粒组细胞呈梭型,间隙增加;TGF-β1+miR-145组细胞多数形态呈鹅卵石样,细胞脱离黏附较少。 |
2.2 miR-145表达质粒的构建
miR-145基因扩增片段凝胶电泳结果显示1、2、4~10号克隆在250 bp与500 bp之间有明亮特异的扩增条带(图 2)。接种1号阳性转化子,分装200 μL送检测序。采用DNAStar的MegAlign软件对插入片段进行测序,结果证实插入片段与设计序列完全匹配。
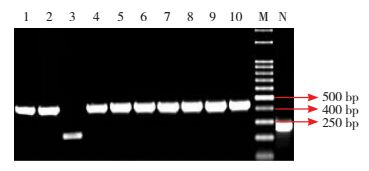
|
图 2 GR325琼脂糖凝胶电泳图 M:Marker;N:阴性对照;1、2、4~10为阳性转化子;3为阴性转化子。 |
2.3 荧光倒置显微镜检测质粒转染HK-2细胞状态
经质粒转染24 h后,在荧光倒置显微镜(奥林巴斯IX81,日本)视野下可观察到空白质粒组和miR-145组有大量细胞发出绿色荧光信号,转染率约70%以上,而对照组未见绿色荧光,见图 3。

|
图 3 质粒转染HK-2细胞的检测(荧光倒置显微镜,×80) 对照组无HK-2细胞发出荧光信号;空白质粒组和miR-145组均可见大量HK-2细胞发出绿色荧光信号。 |
2.4 miR-145表达检测
实时荧光定量PCR结果显示,各组细胞内miR-145表达比较差异有统计学意义(F=157.103,P < 0.001)。与对照组(0.526±0.024)和空白质粒组(0.537±0.016)比较,miR-145组细胞内miR-145表达(0.836±0.052)显著升高(P < 0.01);而对照组与空白质粒组比较,miR-145水平差异无统计学意义(P > 0.05)。
2.5 TGF-β1刺激对HK-2细胞miR-145表达的影响实时荧光定量PCR结果显示,予5 μg/L TGF-β1刺激24 h后,各组细胞内miR-145表达比较差异有统计学意义(F=180.225,P < 0.001)。与对照组(0.526±0.024)和TGF-β1+miR-145组(0.733±0.064)比较,TGF-β1组(0.312±0.014)和TGF-β1空白质粒组(0.331±0.018)miR-145表达明显下降(P < 0.01)。与对照组比较,TGF-β1+miR-145组miR-145表达升高(P < 0.01)。TGF-β1组和TGF-β1空白质粒组比较,miR-145水平差异无统计学意义(P > 0.05)。
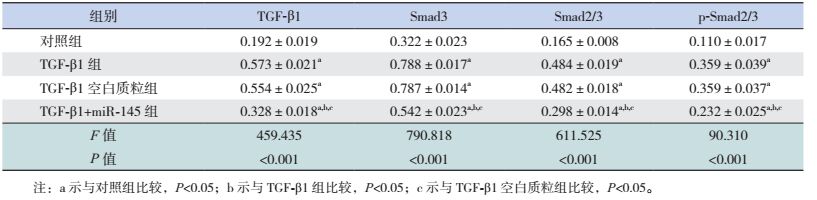
2.6 miR-145对HK-2细胞TGF-β/Smad信号蛋白的影响Western blot印迹结果显示,予5 μg/L TGF-β1刺激24 h可导致HK-2细胞TGF-β1表达明显增多。表现为与对照组比较,TGF-β1组、TGF-β1空白质粒组、TGF-β1+miR-145组细胞中TGF-β1蛋白表达量增加(P < 0.05)。而miR-145抑制TGF-β1过表达,表现为TGF-β1+miR-145组与TGF-β1组和TGF-β1空白质粒组比较,TGF-β1蛋白表达量减少(P < 0.05)。同样miR-145阻止TGF-β1激活信号蛋白Smad2/3。表现为与对照组比较,TGF-β1组、TGF-β1空白质粒组、TGF-β1+miR-145组细胞中Smad3、Smad2/3和p-Smad2/3蛋白表达量增加(P < 0.05)。而TGF-β1+miR145组与TGF-β1组和TGF-β1空白质粒组比较,Smad3、Smad2/3和p-Smad2/3蛋白表达量减少(P < 0.05),见图 4,表 1。
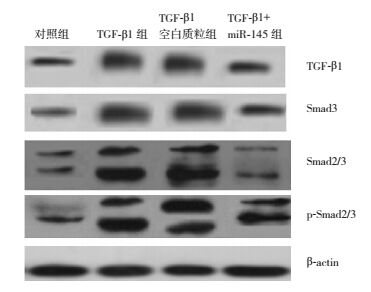
|
图 4 Western blot检测miR-145表达质粒对TGF-β1诱导HK-2细胞TGF-β/Smad信号蛋白表达的影响 |
| 表 1 各组细胞相关信号蛋白的表达比较 (n=3,x±s) |
2.7 miR-145对TGF-β1诱导HK-2细胞EMT的影响
Western blot印迹结果显示,各组细胞内α-SMA表达比较差异有统计学意义(F=150.880,P < 0.001)。TGF-β1刺激可使HK-2细胞α-SMA表达增多,表现为与对照组(0.35±0.04)比较,TGF-β1组(0.82±0.05)、TGF-β1空白质粒组(0.83±0.05)、TGF-β1+miR-145组(0.55±0.04)细胞中α-SMA蛋白表达量增加(P < 0.01)。而miR-145抑制α-SMA过表达,表现为与TGF-β1组和TGF-β1空白质粒组比较,TGF-β1+miR-145组α-SMA蛋白表达量明显减少(P < 0.01),见图 5。
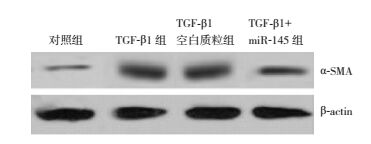
|
图 5 Western blot检测miR-145表达质粒对TGF-β1诱导HK-2细胞α-SMA蛋白表达的影响 |
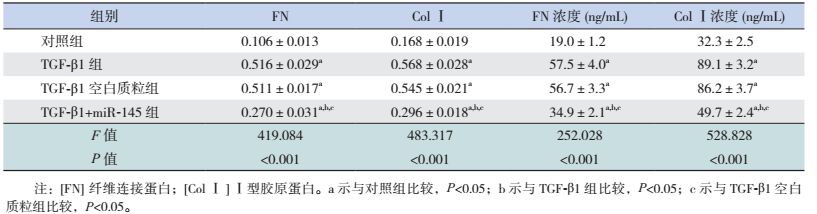
miR-145减少TGF-β1诱导HK-2细胞及培养液上清中纤维化因子FN、ColⅠ蛋白表达和含量:Western blot印迹结果显示,TGF-β1刺激可使HK-2细胞FN、ColⅠ蛋白表达增多,表现为与对照组比较,TGF-β1组、TGF-β1空白质粒组、TGF-β1+miR-145组细胞中FN和ColⅠ蛋白表达增加(P < 0.05)。而miR-145抑制FN、ColⅠ蛋白过表达,表现为TGF-β1+miR-145组与TGF-β1组和TGF-β1空白质粒组比较,FN和Col Ⅰ蛋白表达均减少(P < 0.05)。同样,TGF-β1刺激可使培养液上清中FN、ColⅠ蛋白含量增多,表现为与对照组比较,TGF-β组、TGF-β1空白质粒组、TGF-β1+miR-145组培养液上清中FN和ColⅠ浓度增加(P < 0.05)。而miR-145抑制上清液FN、ColⅠ增加,表现为TGF-β1+miR-145组与TGF-β1组和TGF-β1空白质粒组比较,FN和Col Ⅰ浓度明显减少(P < 0.05)。见图 6,表 2。
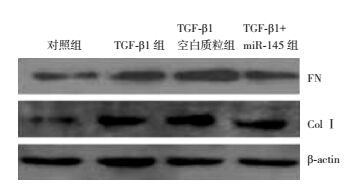
|
图 6 Western blot检测miR-145表达质粒对TGF-β1诱导HK-2细胞FN、ColⅠ蛋白表达的影响 |
| 表 2 各组细胞及培养液上清EMT蛋白的表达和含量比较 (n=3,x±s) |
3 讨论
肾脏纤维化是大多数进展性慢性肾脏病不可避免的最终结局。在各种病理状态下,肾小管上皮细胞可发生表型转化,转变为产生细胞外基质的成纤维细胞或肌成纤维细胞,这一病变过程被称为EMT。目前认为,肾小管EMT是导致肾脏纤维化的主要原因[4]。研究显示TGF-β依赖的Smad信号通路作为EMT的关键促动因素,在肾脏纤维化过程中起至关重要的调控作用[14-15]。其具体机制如下。首先,TGF-β1与其受体Ⅱ绑定可以激活Ⅰ型TGF-β受体激酶,导致Smad通路受体Smad2与Smad3磷酸化。接着,磷酸化Smad2、Smad3与Smad4绑定形成Smad复合体并进入细胞核。最后,核内Smad复合体通过调控多种EMT靶基因转录产生肾脏纤维化效应[16]。
miRNAs是一类内源性、小分子、非编码RNA,通过与多种mRNAs相互作用以调控靶基因的表达,并且诱导mRNA翻译抑制和降解[17]。miRNAs参与多种生理过程,包括胚胎发生、器官发育、肿瘤形成及EMT启动等[18-19]。新近研究发现,在乳腺癌细胞中miR-200家族成员miR-200a、miR-200b、miR-200c、miR-141和miR-429表达水平均显著下调,增强其表达可有效阻止乳腺癌细胞EMT发生[20]。同样,Chen等[21]研究显示,miR-328可通过靶定CD44抑制肾小管细胞EMT。这些结果暗示一些miRNAs可能在EMT形成及纤维化发生中发挥重要作用。
有鉴于此,本研究以TGF-β1诱导的体外肾小管间质纤维化模型为研究对象,将pCMV-miR-145转染至TGF-β1诱导的HK-2细胞,通过检测信号蛋白及EMT生物标记物表达,以期探讨miR-145对肾小管EMT的影响及可能作用机制。本研究将pre-miR-145序列克隆至真核表达载体pCMV-myc中,经核酸测序结果证实插入片段与设计序列完全匹配,提示miR-145真核表达载体pCMV-miR-145构建成功;荧光显微镜观察到空白质粒组和miR-145组细胞中有大量荧光信号,对照组未出现,从而证明真核质粒稳定地转染到HK-2细胞。实时荧光定量PCR显示,与对照组和空白质粒组比较,miR-145组细胞内miR-145表达显著上调。同时,通过预实验发现在0、12、24 h 3个不同时间点,分别予5 μg/L TGF-β1刺激HK-2细胞,观察到不同分组细胞miR-145和TGF-β1表达变化是保持一致的。即转染miR-145后,在不同时间点均可抑制TGF-β1的过表达,其中以24 h时最显著。根据TGF-β依赖Smad信号通路作用机制,因此选择以24 h为时间切入点进行分析研究。本研究显示与对照组比较,TGF-β1组中信号蛋白TGF-β1、Smad3、Smad2/3及p-Smad2/3表达均增加;这暗示TGF-β依赖的Smad信号通路激活。而TGF-β1+miR-145组与TGF-β1组和TGF-β1空白质粒组比较,TGF-β1、Smad3、Smad2/3及p-Smad2/3蛋白表达均减少。因此,本研究结果表明体外miR-145抑制TGF-β依赖的Smad信号通路活性,从而可能抑制肾小管EMT。
EMT从启动到完成的整个过程涉及多种分子生物学变化,包括转录因子的激活、特异性细胞表面蛋白的表达、细胞骨架蛋白的重建与表达、细胞外基质成分的改变等。在许多情况下,这些相关因子也成为EMT的生物标记物[22]。EMT生物标记物可分为获得标记物和丢失标记物两类,获得标记物包括α-SMA、FN和ColⅠ等;丢失标记物包括E-cadherin、扣带蛋白(zonula occludens 1, ZO-1)、细胞角蛋白(Cytokeratin)等[23]。本研究显示,与对照组比较,TGF-β1组细胞中获得标记物α-SMA、FN和ColⅠ蛋白表达增加;培养液上清中细胞外基质FN和ColⅠ浓度增高。而TGF-β1+miR-145组与TGF-β1组和TGF-β1空白质粒组比较,细胞中获得标记物α-SMA、FN和ColⅠ蛋白表达减少;培养液上清中细胞外基质FN和ColⅠ浓度减少,这同样表明miR-145可能抑制肾小管EMT。
综上所述,本研究显示在体外miR-145可参与肾小管EMT的调控。miR-145可能通过抑制TGF-β依赖的Smad信号通路活性,从而抑制肾小管EMT。本研究为今后进一步行体内实验及肾脏纤维化的治疗提供了新的理论依据。然而,本研究存在一些局限性。例如,miR-145调控TGF-β/Smad信号通路的具体机制尚待阐述。miR-145是否直接作用于TGF-β/Smad信号通路的下游信号蛋白抑或作用于该信号通路的靶基因,从而发挥抑制纤维化效应,有待今后研究进一步证明。
| [1] | Eddy AA, Neilson EG. Chronic kidney disease progression[J]. J Am Soc Nephrol, 2006, 17 (11): 2964–2966. DOI:10.1681/ASN.2006070704 |
| [2] | Wang Y, Wang B, Du F, et al. Epigallocatechin-3-gallate attenuates unilateral ureteral obstruction-induced renal interstitial fibrosis in mice[J]. J Histochem Cytochem, 2015, 63 (4): 270–279. DOI:10.1369/0022155414568019 |
| [3] | Sugiyama F, Kobayashi N, Ishikawa M, et al. Renoprotective mechanisms of telmisartan on renal injury and inflammation in SHRSP.Z-Leprfa/IzmDmcr rats[J]. Clin Exp Nephrol, 2013, 17 (4): 515–524. DOI:10.1007/s10157-012-0759-3 |
| [4] | Iwano M, Plieth D, Danoff TM, et al. Evidence that fibroblasts derive from epithelium during tissue fibrosis[J]. J Clin Invest, 2002, 110 (3): 341–350. DOI:10.1172/JCI0215518 |
| [5] | Huang Y, Tong J, He F, et al. miR-141 regulates TGF-β1-induced epithelial-mesenchymal transition through repression of HIPK2 expression in renal tubular epithelial cells[J]. Int J Mol Med, 2015, 35 (2): 311–318. |
| [6] | Tang O, Chen XM, Shen S, et al. MiRNA-200b represses transforming growth factor-β1-induced EMT and fibronectin expression in kidney proximal tubular cells[J]. Am J Physiol Renal Physiol, 2013, 304 (10): F1266–F1273. DOI:10.1152/ajprenal.00302.2012 |
| [7] | Wang JY, Gao YB, Zhang N, et al. miR-21 overexpression enhances TGF-β1-induced epithelial-to-mesenchymal transition by target smad7 and aggravates renal damage in diabetic nephropathy[J]. Mol Cell Endocrinol, 2014, 392 (1-2): 163–172. DOI:10.1016/j.mce.2014.05.018 |
| [8] | Kojima S, Enokida H, Yoshino H, et al. The tumor-suppressive microRNA-143/145 cluster inhibits cell migration and invasion by targeting GOLM1 in prostate cancer[J]. J Hum Genet, 2014, 59 (2): 78–87. DOI:10.1038/jhg.2013.121 |
| [9] | Rangrez AY, Massy ZA, Metzinger-Le Meuth V, et al. miR-143 and miR-145:molecular keys to switch the phenotype of vascular smooth muscle cells[J]. Circ Cardiovasc Genet, 2011, 4 (2): 197–205. DOI:10.1161/CIRCGENETICS.110.958702 |
| [10] | Zhang C. MicroRNA-145 in vascular smooth muscle cell biology:a new therapeutic target for vascular disease[J]. Cell Cycle, 2009, 8 (21): 3469–3473. DOI:10.4161/cc.8.21.9837 |
| [11] | Yang S, Cui H, Xie N, et al. miR-145 regulates myofibroblast differentiation and lung fibrosis[J]. FASEB J, 2013, 27 (6): 2382–2391. DOI:10.1096/fj.12-219493 |
| [12] | Megiorni F, Cialfi S, Cimino G, et al. Elevated levels of miR-145 correlate with SMAD3 down-regulation in cystic fibrosis patients[J]. J Cyst Fibros, 2013, 12 (6): 797–802. DOI:10.1016/j.jcf.2013.03.007 |
| [13] | Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T) method[J]. Nat Protoc, 2008, 3 (6): 1101–1108. DOI:10.1038/nprot.2008.73 |
| [14] | Lan HY. Diverse roles of TGF β/Smads in renal fibrosis and inflammation[J]. Int J Biol Sci, 2011, 7 (7): 1056–1067. DOI:10.7150/ijbs.7.1056 |
| [15] | Meng XM, Chung AC, Lan HY. Role of the TGF β/BMP 7/Smad pathways in renal diseases[J]. Clin Sci (Lond), 2013, 124 (4): 243–254. DOI:10.1042/CS20120252 |
| [16] | Nawshad A, Hay ED. TGFβ3 signaling activates transcription of the LEF1 gene to induce epithelial mesenchymal transformation during mouse palate development[J]. J Cell Biol, 2003, 163 (6): 1291–1301. DOI:10.1083/jcb.200306024 |
| [17] | Bartel DP. MicroRNAs:genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116 (2): 281–297. DOI:10.1016/S0092-8674(04)00045-5 |
| [18] | Yi R, O'Carroll D, Pasolli HA, et al. Morphogenesis in skin is governed by discrete sets of differentially expressed microRNAs[J]. Nat Genet, 2006, 38 (3): 356–362. DOI:10.1038/ng1744 |
| [19] | Esquela Kerscher A, Slack FJ. Oncomirs-microRNAs with a role in cancer[J]. Nat Rev Cancer, 2006, 6 (4): 259–269. DOI:10.1038/nrc1840 |
| [20] | Gregory PA, Bert AG, Paterson EL, et al. The miR-200 family and miR-205 regulate epithelial to mesenchymal transition by targeting ZEB1 and SIP1[J]. Nat Cell Biol, 2008, 10 (5): 593–601. DOI:10.1038/ncb1722 |
| [21] | Chen CH, Cheng CY, Chen YC, et al. MicroRNA-328 inhibits renal tubular cell epithelial-to-mesenchymal transition by targeting the CD44 in pressure-induced renal fibrosis[J]. PLoS One, 2014, 9 (6): e99802. DOI:10.1371/journal.pone.0099802 |
| [22] | Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition[J]. J Clin Invest, 2009, 119 (6): 1420–1428. DOI:10.1172/JCI39104 |
| [23] | Liu Y. New insights into epithelial-mesenchymal transition in kidney fibrosis[J]. J Am Soc Nephrol, 2010, 21 (2): 212–222. DOI:10.1681/ASN.2008121226 |
 2017, Vol. 19
2017, Vol. 19