2. 重庆市涪陵中心医院儿科, 重庆 408000;
3. 重庆市涪陵区妇幼保健院儿科, 重庆 408099
先天性心脏病(congenital heart disease, CHD)在出生缺陷中居首位,且在近年有所增高[1-2]。据研究,每位新发CHD患者生命周期经济总负担约9.7万,为全国带来每年109~156亿元的经济总负担[3]。目前我国CHD的诊断及治疗已达先进水平,绝大部分CHD病种都能够治疗,大部分可根治。现阶段,由于城市与农村医疗资源分布极不平衡,广大乡镇地区医疗水平相对落后、基层医生对CHD缺乏认识、检测仪器与技术人员配备不足及留守儿童等社会问题的存在,导致欠发达地区CHD患儿的诊断及治疗相对落后。建立适合我国乡镇的具备充分可行性的CHD诊疗体系,选取基层医生易于学习掌握的的筛查指标,开展在三级甲等医院儿童心血管中心指导辐射下的培训、转诊机制,对于提高现阶段我国整体CHD治疗水平有重大意义。
重庆医科大学附属儿童医院参与并完成了卫生部卫生行业科研专项项目“农村地区儿童先天性心脏病的筛查和诊断技术应用”课题,纳入了重庆涪陵地区10 005例0~3岁儿童,本研究在该课题基础上对CHD患儿进行了6~18个月随访。在所有参与单位中,由我院主持的本地区筛查CHD检出率明显高于其他地区[4]。现将本地区CHD筛查、后期随访数据及方法、经验等报道如下。
1 资料与方法 1.1 研究对象2011年10月至2012年6月采取整群抽样法,以乡镇为基本抽样单位,抽取重庆市涪陵区10个乡镇0~3岁婴幼儿,被选中的该年龄范围的户籍人口共10 281例,实际筛查人数10 005例,应答率为97.32%。
1.2 CHD筛查医师及人员培训参与CHD筛查者包括市级、区级及乡镇级人员医师。其中市级医师为重庆医科大学附属儿童医院心血管专科医师及心脏超声医师;区级医师为涪陵中心医院儿科及涪陵区妇幼保健院心血管专科医师及超声医师;乡镇级医师为涪陵地区辖区10个乡镇医院儿科和/或儿童保健医师。
以重庆医科大学附属儿童医院作为培训中心,以乡镇医院为筛查现场单位,每个筛查单位选派2~4名儿科和/或儿童保健医师,与涪陵中心医院儿科及涪陵区妇幼保健院医师一同参加培训,重点培训包括7项临床筛查指标的相关内容、CHD分类、CHD主要临床表现及并发症、心脏听诊、CHD治疗等基础知识。由市级心脏超声专科医师对区级超声医师进行统一的标准化超声心动图诊断培训。
1.3 筛查指标、诊断及评估流程以“农村地区儿童先天性心脏病的筛查和诊断技术应用”课题确立的7项筛查指标作为临床CHD筛查标准:CHD家族史(以下简称“家族史”,指三代以内直系亲属中有CHD患者)、呼吸急促、青紫、特殊面容、心脏杂音、其他先天性畸形、经皮血氧饱和度(SpO2) < 95%。
在上述7项筛查指标中,筛查出1项及1项以上指标阳性者,由区级或市级心血管专科医师复核。复核具有阳性指标的婴幼儿,由区级或市级超声医师行超声心动图检查,心血管专科医师做出CHD诊断,并对病情进行详细评估及指导(包括目前诊断、随访时间、内容,是否介入或手术等)。
超声诊断病例纳入标准:乡镇医院在7项筛查指标中≥1项筛查指标阳性,并经市级医师复核确认的患儿。排除标准包括:(1) < 5 mm的房间隔缺损;(2)3个月内自然闭合的动脉导管;(3)压力阶差 < 20 mm Hg的轻度肺动脉瓣狭窄、主动脉口流速 < 2 m/s的轻度主动脉瓣狭窄,且在随访中狭窄无进展。
1.4 质量控制由市级心血管专科医师对区级、乡镇级儿科医师进行筛查内容的统一培训,确保其达到筛检患者的技能要求。筛查过程由区级和乡镇级医师共同进行,区级医师对乡镇级医师进行现场再培训和指导。筛查出的可疑CHD儿童,由市级医师进行复核,确保筛查质量。因区级医师超声心动图诊断技术在短期内不能达到相应诊断水平,为确保筛查结果的准确性,由市级心脏彩超专科医师到区级医院对可疑CHD患儿进行超声心动图检查。
1.5 统计学分析采用SPSS 17.0软件进行统计学分析。资料统一录入“农村地区婴幼儿先心病筛查信息填报系统”。计数资料用率(%或‰)表示。对各筛查指标进行ROC曲线评价及比较,求得相应的曲线下面积(AUC)及其95%CI。AUC差异比较采用Z检验。P < 0.05为差异有统计学意义。
2 结果 2.1 基本临床资料共筛查0~3岁儿童10 005例,1项或1项以上筛查指标阳性者175例(175/10 005,17.5‰),男98例,女77例,其中166例(166/175,94.9%)行超声心动图确诊,异常者78例(78/166,47.0%)。
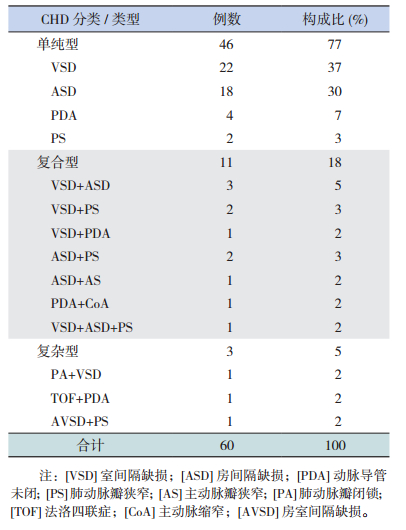
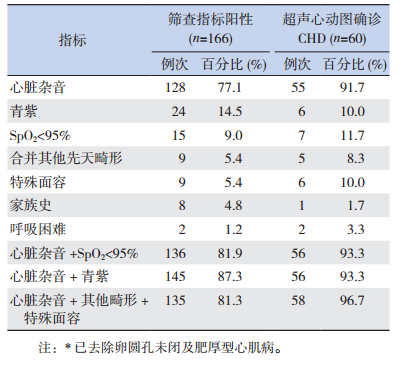
2.2 筛查指标及确诊结果175例筛查指标阳性儿童中,心脏杂音阳性比例最高,有135例(135/175,77.6%),其次为青紫(27/175,15.4%)、SpO2 < 95%(15/175,8.6%)、其他畸形(9/175,5.2%)、特殊面容(9/175,5.2%)、家族史(8/175,4.6%)、呼吸困难(2/175,1.2%)。175例指标阳性儿童中,166例行超声心动图检查,发现超声心动图阳性儿童78例,其中确诊CHD 60例(6‰,60/10 005),卵圆孔未闭17例,肥厚型心肌病1例。60例CHD的病种分布见表 1。
| 表 1 60例CHD的病种分布 |
60例CHD中,男33例,女27例; < 1岁25例,1岁~ 15例,2~3岁20例。
心脏杂音等7项筛查指标及其部分指标联合筛查阳性情况及与超声心动图检查对CHD的诊断符合情况见表 2。
| 表 2 筛查指标阳性与超声心动图的诊断符合情况* |
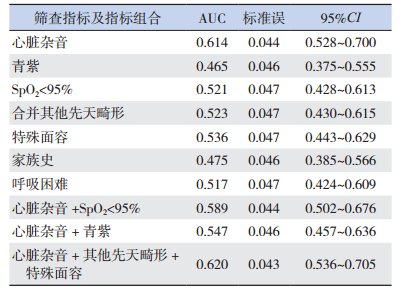
2.3 筛查指标对诊断CHD的AUC比较
在单项筛查指标对CHD诊断的AUC比较中,心脏杂音对CHD诊断的AUC最大,其次为特殊面容、合并其他先天畸形及SpO2 < 95%,见表 3。
| 表 3 筛查指标及其组合对诊断CHD的AUC |
将心脏杂音与其他指标联合筛查可提高AUC值,以心脏杂音联合其他先天畸形和特殊面容对CHD诊断的AUC最高(表 3)。Z检验显示,心脏杂音+其他先天畸形+特殊面容联合筛查及心脏杂音单项指标筛查对CHD诊断的AUC均高于心脏杂音+青紫联合筛查(分别P=0.009、0.0005)。心脏杂音单独或与其他指标联合筛查对诊断CHD的ROC曲线见图 1。
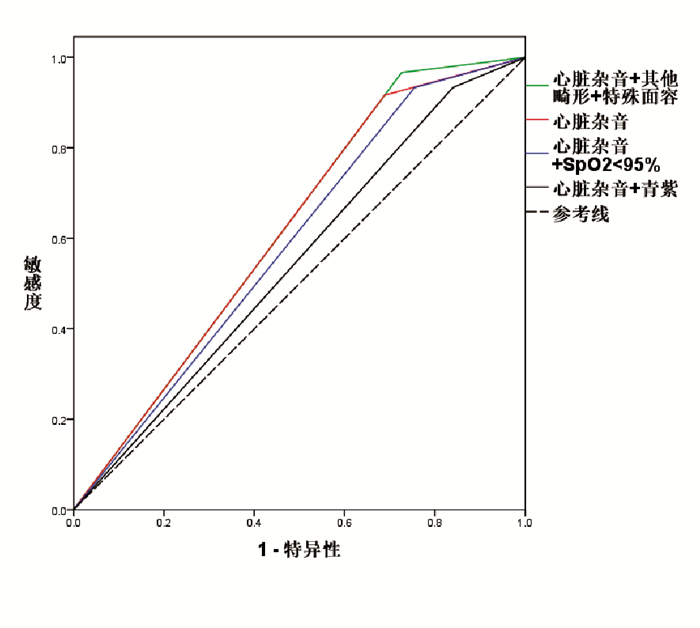
|
图 1 心脏杂音单独或与其他指标联合筛查对诊断CHD的ROC曲线 |
2.4 预后
对60例CHD随访至确诊后6~18个月。46例单纯型CHD儿童中,9例自然闭合(VSD 2例,ASD 4例,PDA 3例),8例行介入或外科手术治疗(VSD 7例,ASD 1例),1例ASD在1月龄时因坏死性小肠结肠炎死亡,28例继续随访中;11例复合型CHD儿童中,1例ASD+PS自然转归至正常,1例PDA+CoA行介入治疗,2例VSD+ASD行外科手术,1例VSD+ASD自然转归为单纯型VSD继续随访中,1例VSD+ASD+PS自然转归为ASD继续随访中,余5例也继续随访中;3例复杂型CHD儿童中,2例(TOF+PDA、AVSD+PS)成功行外科手术,1例(PA+VSD)家属不愿意手术,正随访中。17例卵圆孔未闭随访至确诊后6~12个月,期间3例自然闭合。
3 讨论早发现、早诊断、正确评估、及时治疗对降低CHD病死率,提高我国儿童健康水平至关重要。超声心动图作为CHD确诊检查的首选,易在经济发达地区尤其大城市广泛实施,可使绝大部分CHD患儿在生后甚至产前得到确诊。马晓静等[4]主导的“农村地区儿童先天性心脏病的筛查和诊断技术应用”项目为制订适宜于我国乡镇儿童的CHD筛查、诊断体系作出了有效的探索[4]。该项目分别选取了上海、江苏、山东、重庆和北京的1个区县的乡镇级医院,重庆是该项目唯一西部地区现场。该课题结束后本研究继续对CHD患儿进行预后及治疗的随访,总结分析本地区的数据及筛检经验,对于制订适宜于本地区可行、简便、易学及有效的CHD筛查、诊断体系具有重要意义。
乡镇居民多散居,不易集中,进行大规模筛查有一定困难,在西部欠发达地区更是如此,依托已覆盖乡镇的妇幼保健管理网络,使大规模儿童健康筛检成为可能。CHD筛查网络参与人员包括基层卫生保健单位医务人员、省市级儿科心血管专家、超声心动图医生,各级人员有机结合,密切沟通、指导及交流,对于在乡镇进行有效的CHD筛查和管理极为重要。
强调对基层人员进行CHD基础知识的培训,包括对筛检指标的识别与确立,仪器的规范使用,正确填报筛检评估表格,且在项目进行中亦应再培训,现场监督指导,省市级项目负责人实时跟进项目进展,对筛检数据特别是阳性指标患者反复确认,做好质控。筛查发现的可疑CHD儿童,及时转诊至区级及省市级单位,并进行确诊、治疗及后续随访。本地区筛检CHD发病率是其他现场的2倍以上[4],马晓静等[4]分析总结可能的原因是本地区筛查对象≤1岁儿童比例显著高于其他地区,以及市级心血管专科医生在项目进行期间仍反复培训,指导筛查及超声诊断。
据流行病学调查,我国0~3岁婴幼儿CHD患病率约为3.03‰~ 6.87‰[5-7]。本研究显示重庆市涪陵区该年龄阶段儿童CHD患病率为6‰,以单纯型多见,其中VSD(单纯及复合CHD)占50%,ASD(单纯及复合CHD)占42%,与全国其他地区报道结果一致[7-8]。
由于单项筛查指标不能检出所有的CHD,本研究选取心脏杂音、青紫、SpO2 < 95%、特殊面容、其他先天畸形、家族史、呼吸困难7项涵盖病史、体格检查及SpO2作为筛查指标,评估筛查对象,阳性患儿经超声心动图检查确诊,目的在于探索早期发现CHD的简单易行、基层医师容易掌握、较为经济的筛查指标。现场培训及观察中发现,基层医务工作者对7项指标判别的正确性有明显差异。判定心脏杂音、特殊面容、合并其他先天畸形及家族史较易,上级医院对具有上述阳性指标的患儿进行复核,结果基本准确,但青紫、SpO2及呼吸困难的筛检结果则有较大出入。
心脏杂音在CHD诊断中具有最重要的作用。本研究中,心脏杂音的诊断AUC值明显高于其他指标。本项目检出心脏杂音者135例,检出率为13.5‰(135/10 005),在7项筛查指标中所占比例最高。完成超声心动图的126例心脏杂音儿童确诊CHD 55例,占43.7%,筛查出91.7%的CHD患者(55/60)。当然仅凭心脏杂音进行筛查可能导致漏诊,但心脏杂音仍是发现CHD最重要且有效的筛查指标,在基层医院运用中,医务人员易于掌握,简单可靠。
CHD是心脏胚胎发育异常所致,患儿可伴特殊面容或其他先天畸形,以此作为筛查指标,对早期发现CHD具有一定意义。有研究显示,CHD患儿染色体异常多为三体型[9],约占各种CHD的8%~10%[1],以21-三体综合征较常见,约40%~50%的21-三体综合征合并CHD[10]。据报道,391例诊断CHD的患儿中,185例(47.3%)有染色体异常,21-三体综合征者157例(157/185,84.9%)[11]。特殊面容及其他先天畸形在筛检中易于识别,本研究中特殊面容者9例(4例21-三体综合征,44%),其他先天畸形者9例(包括多指、泌尿道畸形、无耳、耳廓发育畸形等),特殊面容及其他先天畸形18例儿童中,诊断CHD 11例。在本研究确诊的60例CHD患儿中,通过特殊面容及其他先天畸形对CHD的检出率为18%(11/60)。结合此两项筛查指标,可提高心脏杂音单项指标对CHD诊断的AUC值,也是本项目中提高心脏杂音对CHD诊断的AUC值的唯一组合。因此在筛检中,要强调对特殊面容及其他先天畸形的识别,对该类患儿应进一步完善CHD确诊检查。
青紫对紫绀型CHD诊断有重要提示作用,非紫绀型CHD婴幼儿,在肺炎、剧烈哭吵时,肺动脉压短暂增高,产生右向左分流,也可出现暂时性青紫。在现场筛检中,对于青紫较易误判,部分唇周欠红润、唇色偏深甚至肤色较深儿童被误认为青紫,经复核确认的24例青紫儿童仅有6例诊断为CHD,其中2例为青紫型CHD,4例非青紫型CHD,18例超声心动图正常者均为哭吵后口周青紫。该年龄阶段儿童由于对医务人员存有恐惧心理,在筛检现场易出现剧烈哭吵,被判为青紫阳性。根据本研究数据,青紫结合心脏杂音诊断CHD的AUC反而低于心脏杂音单独诊断的AUC值。筛查中对青紫的界定若为安静时青紫可能会减少误判,有助于提高青紫这一指标的诊断价值。总之,在基层筛查CHD现场,青紫这一指标的采用应慎重考虑。
SpO2检测较青紫更为客观,亦具有方便易行的特点。本研究中SpO2 < 95%较青紫诊断CHD的AUC高,SpO2 < 95%联合心脏杂音也较青紫联合心脏杂音的AUC高。运用SpO2筛检CHD新生儿被认为是“先心病历史上的里程碑”[12]。近年国外多项研究显示,诊断患有严重CHD的无症状新生儿,SpO2检测灵敏度、特异度分别为76.5%~78.9%、99.9% [13-14],可用于大范围筛查新生儿CHD [13, 15]。多个国家已建议将SpO2列入新生儿常规筛查项目[16-17]。国内一项大样本研究发现,SpO2联合心脏杂音与SpO2联合4项临床评估(家族史、特殊面容、心脏杂音、心外畸形)识别新生儿CHD相比较,两者灵敏度相似[18]。SpO2对于筛检新生儿CHD的价值已毋庸置疑,5个筛检现场总数据说明心脏杂音、紫绀和SpO2这3项筛查指标具备与7项指标相同的敏感度水平[4],但未做统计分析比较。本研究统计分析提示,SpO2 < 95%、青紫联合心脏杂音并不能提高0~3岁儿童CHD诊断的AUC。比较本项目与新生儿CHD筛查研究,医务人员在院内对于新生儿SpO2的反复测定与确认可能较在乡镇现场对非安静状态的婴幼儿更为准确,且新生儿CHD血流动力学较其他年龄阶段的CHD患儿亦有不同,可能为本项目结论与其他新生儿CHD研究结论有差异的部分原因。
多数学者认为,CHD有明显的家族倾向,具有一定的遗传背景。据重庆地区4 387个CHD的家系调查,各种CHD先证者的各级亲属患病率为8.62%,其中一级亲属患病率(16.49%)明显高于二级亲属(1.89%)[19];广西地区49例CHD高发家系中,一级亲属的患病率为20.60%,二级亲属为5.00%[20]。本研究中有CHD家族史者8例(8/10 005,0.8‰),诊断为CHD 1例,但该指标诊断CHD的AUC值低于参考线,提示家族史作为CHD筛检指标的意义值得商榷。
当呼吸困难不能用其他心外原因(如肺源性、中毒等)解释时,应警惕CHD,本筛查中未发现单一呼吸困难者,2例呼吸困难者均与心脏杂音、青紫、SpO2 < 95%等合并出现,均诊断为CHD。
综上所述,经过培训的区级及乡镇儿科医师对CHD临床症状、体征等基础知识有较好的掌握,并能熟练使用7项筛查指标进行CHD筛查,心脏超声医师采用超声心动图检查对可疑者进行诊断,儿科心血管医师对确诊CHD患儿病情作出评估、随访和治疗,初步建立“乡镇-区县-省市”分级的筛查、诊断、评估体系。筛查中,应强调对心脏杂音、特殊面容及其他先天畸形的识别,对该类婴幼儿应高度重视及密切随访,常规行超声心动图检查,如有条件应将SpO2列入临床常规检查项目。安静时皮肤、黏膜青紫多提示紫绀型CHD,但哭吵后青紫需结合其他指标综合判断。
| [1] | van der Bom T, Zomer AC, Zwinderman AH, et al. The changing epidemiology of congenital heart disease[J]. Nat Rev Cardiol, 2011, 8(1): 50–60. DOI:10.1038/nrcardio.2010.166 |
| [2] | 陈雪辉, 袁雪, 闫淑娟, 等. 北京地区新生儿先天性心脏病检出率5年分析[J]. 中国优生与遗传杂志, 2011, 19(9): 101–102. |
| [3] | 陈英耀. 我国主要出生缺陷的疾病负担和预防措施的经济学评价研究[D]. 上海: 复旦大学, 2006. |
| [4] | 马晓静, 赵趣鸣, 肖丽萍, 等. 社区/乡镇0至3岁儿童先天性心脏病筛查-诊断-评估适宜技术的建立与应用[J]. 中国循证儿科杂志, 2013, 8(5): 321–325. |
| [5] | 王惠珊, 袁雪, 奚一生, 等. 19432名幼儿先天性心脏病患病率的调查研究[J]. 中国儿童保健杂志, 2001, 9(4): 236–238. |
| [6] | 文红, 白晶, 宋亚非, 等. 婴幼儿先天性心脏病患病率调查[J]. 中国妇幼保健, 2005, 20(3): 368–369. |
| [7] | 刘薇迁, 宁寿葆, 华邦杰, 等. 上海杨浦、徐汇区小儿先天性心脏患病率及其特点[J]. 中华儿科杂志, 1995, 33(6): 347–349. |
| [8] | 严惠琴, 陈亚红, 应春浓. 17933名0~2岁儿童先天性心脏病患病率调查[J]. 中国妇幼保健, 2006, 21(1): 82–83. |
| [9] | 张璘, 任梅宏, 宋桂宁, 等. 胎儿先天性心脏病与染色体异常的关系[J]. 中国优生与遗传杂志, 2009, 17(10): 45–46. |
| [10] | Fahed AC, Gelb BD, Seidman JG, et al. Genetics of congenital heart disease:the glass half empty[J]. Curr Cardiol Rev, 2011, 6(2): 91–97. |
| [11] | 张璟, 黄国英, 倪祖德, 等. 4046例染色体检查结果与先天性心脏病关系的回顾性分析[J]. 中国循证儿科杂志, 2009, 14(2): 128–134. |
| [12] | The Lancet. A new milestone in the history of congenital heart disease[J]. Lancet, 2012, 379(9835): 2401. DOI:10.1016/S0140-6736(12)61045-9 |
| [13] | Thangaratinam S, Brown K, Zamora J, et al. Pulse oximetry screening for critical congenital heart defects in asymptomatic newborn babies:a systematic review and meta-analysis[J]. Lancet, 2012, 379(9835): 2459–2464. DOI:10.1016/S0140-6736(12)60107-X |
| [14] | Turska Kmieć A, Borszewska Kornacka MK, Błaż W, et al. Early screening for critical congenital heart defects in asymptomatic newborns in Mazovia province:experience of the POLKARD pulse oximetry programme 2006-2008 in Poland[J]. Kardiol Pol, 2012, 70(4): 370–376. |
| [15] | 樊启红, 刘丹, 刘梅. 经皮血氧饱和度监测对新生儿先天性心脏病的早期诊断价值[J]. 中国优生与遗传杂志, 2012, 20(3): 97. |
| [16] | Kemper AR, Mahle WT, Martin GR, et al. Strategies for implementing screening for critical congenital heart disease[J]. Pediatrics, 2011, 128(5): e1259–e1267. DOI:10.1542/peds.2011-1317 |
| [17] | Mahle WT, Martin GR, Beekman RH 3rd, et al. Endorsement of Health and Human Services recommendation for pulse oximetry screening for critical congenital heart disease[J]. Pediatrics, 2012, 129(1): 190–192. DOI:10.1542/peds.2011-3211 |
| [18] | Zhao QM, Ma XJ, Ge XL. Pulse oximetry with clinical assessment to screen for congenital heart disease in neonates in China:a prospective study[J]. Lancet, 2014, 384(9945): 747–754. DOI:10.1016/S0140-6736(14)60198-7 |
| [19] | 余更生, 陈沅, 田杰, 等. 先天性心脏病家族聚集的初步分析[J]. 临床心血管病杂志, 2004, 20(11): 672–674. DOI:10.3969/j.issn.1001-1439.2004.11.013 |
| [20] | 张朴. 广西地区先天性心脏病高发家系遗传学分析[D]. 南宁: 广西医科大学, 2012. |
 2017, Vol. 19
2017, Vol. 19