先天性心脏病(简称先心病)是儿童最常见的心脏病,其发病率约占出生婴儿的0.4%~5%[1]。随着医疗技术的发展,越来越多的先心病患儿通过外科手术得到治愈,手术治疗先心病常需建立体外循环(cardiopulmonary bypass, CPB)以替代心肺功能[2]。而急性肾损伤(acute kidney injury, AKI)是儿童先心病CPB术后常见而严重的并发症,其发生率约为5%~33%之间[3],其中约5%需要透析治疗,而透析患者的病死率可高达80%[4]。因此,早期诊断并治疗AKI对先心病CPB术后患者具有重要的临床意义。
尽管目前临床上仍采用血肌酐(Scr)、内生肌酐清除率、尿量等指标对CPB术后AKI进行诊断,但其并不能及时反映AKI的发生发展。近年来,一些新的生物学标志物的发现使更早预测CPB术后AKI成为可能,如中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase associated lipocalin, NGAL)、肾损伤分子1(kidney injury molecule-1, KIM-1)、肝型脂肪酸结合蛋白(liver-type fatty acid binding protein, L-FABP)、半胱氨酸蛋白酶抑制剂C(cystatin C, Cys C)等[5-7]。研究表明,标志物的联合应用可以提高AKI预测的准确性[8]。本研究通过比较发生AKI与未发生AKI两组CPB术前及术后不同时间点尿L-FABP及NGAL水平的变化,探讨尿L-FABP及NGAL联合应用在儿童先心病CPB术后AKI早期诊断中的临床价值。
1 资料与方法 1.1 研究对象前瞻性选取2015年1月至2016年1月在我院心脏外科行先心病CPB手术的患儿97例。纳入标准:在我院心脏外科住院,并接受先心病CPB手术的患儿。排除标准:(1)术前存在肾功能不全;(2)合并急、慢性感染;(3)合并糖尿病;(4)合并先天性泌尿系畸形;(5)术前或研究过程中使用肾毒性药物。
AKI的诊断标准为术后48~72 h内Scr较基线值升高≥50%[9-11],按此标准将患儿分为AKI组和非AKI组。其中AKI组18例,非AKI组79例。
患儿Scr的基线值在术前72 h内检测。应用改良的儿童RIFLE标准(pRIFLE)评估AKI的严重程度,采用Schwartz公式计算由肌酐、身高估算的肌酐清除率(estimated creatinine clearance, eCrCl):风险期为eCrCl下降25%~50%;损伤期为eCrCl下降50%~75%;衰竭期eCrCl下降 < 75%,或绝对值 < 35 mL/(min · 1.73 m2)[12]。
1.2 一般资料的收集收集患儿的原始病例资料,包括年龄、性别、体重、原发疾病、术前并发基础疾病、住院时间、入住ICU时间、手术类型、CPB时间、尿量、术前术后的血尿生化指标、行肾脏替代治疗(renal replacement therapy)情况及转归等。
1.3 标本收集每个患儿留取5次尿液标本:0 h(术前),以及CPB术后2 h、6 h、12 h及24 h。同时在0 h(术前),以及CPB开始后第24 h、48 h、72 h、96 h及120 h分别采集血标本,留取血清检测Scr。上清尿和血清在检测前置入-80℃冰箱冷冻保存。
1.4 Scr、尿L-FABP及尿NGAL水平检测Scr在全自动生化分析仪上测定;采用酶联免疫吸附法(ELISA)测定尿L-FABP(美国R & D公司)及尿NGAL(美国R & D公司)水平,按试剂盒的要求进行测定。根据标准曲线计算待测样本所对应的尿L-FABP和NGAL的浓度,并且用同步尿肌酐(Ucr)校正后以μg/(g·Cr)表示。
1.5 统计学分析采用SPSS 17.0统计软件进行数据处理。正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用成组t检验;计数资料以频数和率(%)表示,组间比较用χ2检验。多个时间点两组之间数值的比较运用重复测量的方差分析。运用受试者工作特征(ROC)曲线及曲线下面积(AUC)对尿L-FABP、尿NGAL预测AKI的敏感性和特异性进行评价。AUC在0.8~0.9为预测准确性佳,> 0.7为有临床应用价值,< 0.7为预测能力差。根据其ROC曲线确定截断值,并根据截断值确定其敏感性和特异性。运用ROC曲线分析术后两个标志物联合预测AKI的AUC的价值。P < 0.05为差异有统计学意义。
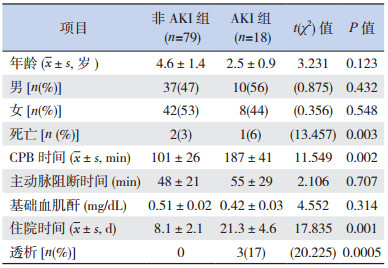
2 结果 2.1 一般资料、手术情况及转归入选的97例患儿中,18例(19%)在术后72 h内发生了AKI。其中,10例Scr在CPB术后24~48 h升高,8例Scr升高于术后48~72 h。79例未发生AKI的患儿Scr在CBP术后5 d内无明显改变(从术前的0.51±0.02 mg/dL到术后第5天的0.47±0.03 mg/dL)。而AKI组患儿Scr术前为0.42±0.03 mg/dL,术后24 h即开始升高,术后48 h为0.79±0.07 mg/dL,术后5 d Scr仍保持在较高水平(图 1)。重复测量的方差分析结果显示,不同时间点的Scr差异有统计学意义(F=201.76,P=0.00007),AKI组与非AKI组组间Scr均值差异有统计学意义(F=789.42,P=0.0005),时间与分组间存在交互作用(F=232.66,P=0.0003)。

|
图 1 术后Scr水平的变化 |
AKI组和非AKI组间年龄、性别、基础Scr、主动脉阻断时间等方面的比较差异无统计学意义(P > 0.05)。AKI组患儿CPB时间以及住院时间均较非AKI组延长(均P < 0.01)。在AKI组中,有3例(17%)患儿进行了肾脏替代治疗,均为腹膜透析治疗。AKI组较非AKI组的病死率增加(P < 0.01)。见表 1。按照pRIFLE分期,AKI组有6例(33%)为风险期,7例(39%)为损伤期,5例(28%)为衰竭期。
| 表 1 两组患儿一般资料的比较 |
2.2 CPB术后尿L-FABP与NGAL的动态变化
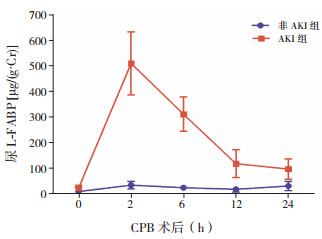
18例患儿依据术后Scr较基线值升高≥50%这一标准诊断为AKI,但是对AKI的诊断延迟到了术后48~72 h。对各组患儿的尿L-FABP水平进行检测,发现AKI组与非AKI组术前尿L-FABP水平差异无统计学意义(P > 0.05)。AKI组尿L-FABP水平从术前23±11 μg/(g·Cr)升高至术后2 h的510±115 μg/(g·Cr)、6 h的312±67 μg/(g·Cr)及12 h的119±54 μg/(g·Cr),其中术后2 h即达峰值(图 2)。重复测量的方差分析结果显示,不同时间点的尿L-FABP浓度差异有统计学意义(F=695.76,P=0.0001),AKI组与非AKI组之间尿L-FABP水平差异有统计学意义(F=3777.95,P=0.0008),时间与分组间存在交互作用(F=608.07,P=0.0006)。
|
图 2 术后尿L-FABP浓度的变化 |
如图 3所示,尿NGAL水平的动态变化趋势与尿L-FABP相似。不同时间点的尿NGAL水平差异有统计学意义(F=247.36,P=0.0009),AKI组与非AKI组之间尿NGAL浓度差异有统计学意义(F=2292.98,P=0.00011),时间与分组间存在交互作用(F=153.63,P=0.0003)。

|
图 3 术后尿NGAL浓度的变化 |
2.3 尿L-FABP及NGAL对术后AKI的预测作用
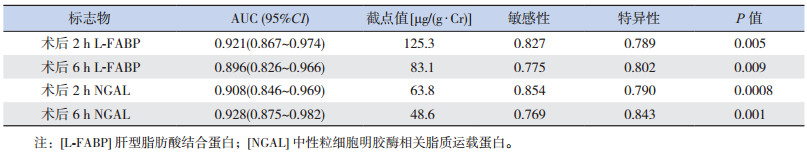
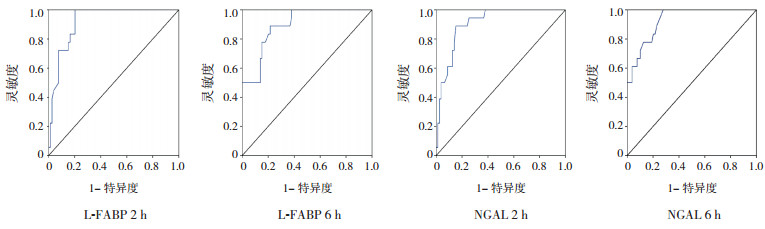
术后2 h及6 h尿L-FABP浓度预测AKI发生的AUC分别为0.921和0.896。当2 h和6 h尿L-FABP水平的截点分别为125.3 μg/(g·Cr)和83.1 μg/(g·Cr)时,其预测AKI的敏感性分别为0.827和0.775,特异性分别为0.789和0.802。同时发现,术后2 h及6 h尿NGAL水平预测AKI发生的AUC分别为0.908和0.928。当2 h和6 h尿NGAL水平的截点为63.8 μg/(g·Cr)和48.6 μg/(g·Cr)时,其预测AKI的敏感性分别为0.854和0.769,特异性分别为0.790和0.843。见表 3及图 4。
| 表 3 术后2 h及6 h尿L-FABP及NGAL预测AKI的AUC |
|
图 4 术后2 h及6 h尿L-FABP及NGAL预测AKI的ROC曲线 |
2.4 尿L-FABP及NGAL联合检测预测术后AKI的价值
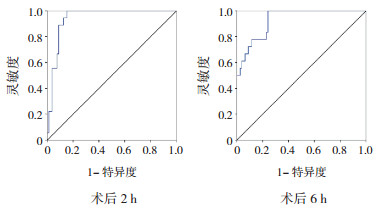
术后2 h尿L-FABP及NGAL联合应用预测术后AKI发生的AUC为0.942(95%CI:0.897~0.986);术后6 h尿L-FABP及NGAL联合应用预测术后AKI发生的AUC为0.929(95%CI:0.875~0.983),见图 5。
|
图 5 尿L-FABP及NGAL联合检测预测术后AKI的ROC曲线 |
3 讨论
AKI是儿童心脏术后常见的并发症,尽管目前AKI的诊断及治疗技术均明显提高,但AKI相关并发症及病死率仍然较高。早期诊断并尽早干预治疗,有助于肾脏损伤的逆转。而用于AKI诊断的Scr或尿量标准在时间上往往滞后,因此,寻找能够早期诊断CPB术后AKI的生物标记物,有利于AKI的早期干预及治疗。
脂肪酸结合蛋白(fatty acid binding protein, FABP)属于脂结合蛋白家族,与细胞膜和细胞内的蛋白质有关[13]。L-FABP最早发现于肝细胞,在肾脏近端小管、胰腺及小肠等也有表达,参与游离脂肪酸(free fatty acid, FFA)在细胞内的摄取、转化及氧化等多种代谢途径,是维持FFA在体内稳定的关键调节因子之一[14]。在应激状态下,肾脏近端小管内FFA过度聚集,其氧化和过氧化产物导致肾小管损伤加重,肾小管上皮细胞内L-FABP大量表达[15]。研究显示,L-FABP在某些类型的AKI如肾移植、脓毒症、造影剂肾病及心脏术后的AKI中具有重要作用[16-18]。Portilla等[9]发现,尿L-FABP浓度可用于小儿心脏术后并发AKI的早期敏感预测指标。本研究也表明,尿L-FABP在AKI早期(术后2 h)即明显升高;运用Scr诊断AKI,需等到术后48~72 h方可诊断,而应用术后2 h尿L-FABP进行预测,可使AKI的诊断时间明显提前。术后2 h及6 h尿L-FABP在预测AKI时的AUC分别为0.921和0.896。同时,尿液标本容易收集,且检测方便,提示术后早期尿L-FABP水平的升高能较好地预测AKI的发生。然而,L-FABP可受其他因素的影响,如慢性肾脏疾病包括糖尿病肾病、原发性局灶性肾小球硬化症、多囊性肾病等[19];同时,由于L-FABP在肝脏中大量表达,因此尿L-FABP水平易受到其血浓度的影响,在伴有肝肾疾病或肝移植合并肾损伤时,尿L-FABP的检测特异度和敏感度均可能受到影响。
NGAL属于载脂蛋白超家族,最初发现并主要表达在活化的中性粒细胞,在人的多个组织器官(如肾脏、肺、前列腺及子宫等)中为低表达,当上皮细胞受到刺激时,NGAL表达明显升高。各种原因导致肾脏损伤时,肾小管上皮细胞受到损害,分泌并释放NGAL,NGAL可作为早期诊断AKI的敏感且特异的标志物,为AKI最有价值的生物标志物之一[20]。Mishra等[21]研究发现,CPB术后AKI患者尿NGAL水平在术后2 h即明显升高,其预测AKI的准确性达0.998。尿NGAL预测AKI行肾脏替代治疗的AUC为0.73~0.89[22]。但也有研究表明尿NGAL预测心脏术后AKI发生具有局限性[23]。其原因可能为标本储存条件、留尿的时间点、术后AKI诊断标准不同等。本研究检测了术后2 h及6 h尿NGAL水平,发现其预测AKI的AUC分别达到0.908和0.928。
研究表明,术后0~12 h的不同时间点的2~5个标志物联合检测可提高AKI诊断准确性[24]。联合检测对于临床上AKI的诊断、治疗和预后更有指导价值。本研究显示,联合应用术后2 h及6 h尿L-FABP及NGAL预测AKI发生的AUC分别达0.942和0.929,提示联合检测可更准确地预测AKI的发生。并且,术后2 h和6 h均可很好地预测AKI,提示可选择这两个时间点进行标本采集。这为临床标本的合理采集提供了时间窗,有利于临床实际应用。
本研究尚存在一些不足之处:(1)监测时间点不足,检测各生物标志物的浓度时,无法准确确定达峰时间及浓度;(2)为单中心研究,有一定的局限性;样本量有限,有待扩大样本量;(3)某些指标的作用机制尚不清楚。
综上所述,本研究探讨了尿L-FABP和尿NGAL在儿童心脏术后AKI患者中的早期诊断价值,并发现术后二者联合应用可进一步提高AKI诊断的准确性,提示二者可作为儿童心脏术后AKI的早期诊断指标,且二者联合检测在先心病术后所致AKI的早期诊断中具有更大的临床价值。
| [1] | Hoffman JI, Kaplan S. The incidence of congenital heart disease[J]. J Am Coll Cardiol, 2002, 39(12): 1890–1900. DOI:10.1016/S0735-1097(02)01886-7 |
| [2] | Miliaresis C, Beker S, Gewitz M. Cardiopulmonary stress testing in children and adults with congenital heart disease[J]. Cardiol Rev, 2014, 22(6): 275–278. DOI:10.1097/CRD.0000000000000039 |
| [3] | Li S, Krawczeski CD, Zappitelli M, et al. TRIBE-AKI Consortium. Incidence, risk factors, and outcomes of acute kidney injury after pediatric cardiac surgery: a prospective multicenter study[J]. Crit Care Med, 2011, 39(6): 1493–1499. DOI:10.1097/CCM.0b013e31821201d3 |
| [4] | Sethi SK, Goyal D, Yadav DK, et al. Predictors of acute kidney injury post-cardiopulmonary bypass in children[J]. Clin Exp Nephrol, 2011, 15(4): 529–534. DOI:10.1007/s10157-011-0440-2 |
| [5] | Ronco C. Biomarkers for acute kidney injury: is NGAL ready for clinical use?[J]. Crit Care, 2014, 18(6): 680. DOI:10.1186/s13054-014-0680-0 |
| [6] | Paikh CR, Thiessen-Philbrook H, Garg AX, et al. TRIBE-AKI Consortium. Performance of kidney injury molecule-1 and liver fatty acid-binding protein and combined biomarkers of AKI after cardiac surgery[J]. Clin J Am Soc Nephrol, 2013, 8(7): 1079–1088. DOI:10.2215/CJN.10971012 |
| [7] | Zappitelli M, Greenberg JH, Coca SG, et al. Association of definition of acute kidney injury by cystatin C rise with biomarkers and clinical outcomes in children undergoing cardiac surgery[J]. JAMA Pediatr, 2015, 169(6): 583–591. DOI:10.1001/jamapediatrics.2015.54 |
| [8] | Prowle JR, Calzavacca P, Licari E, et al. Combination of biomarkers for diagnosis of acute kidney injury after cardiopulmonary bypass[J]. Ren Fail, 2015, 37(3): 408–416. DOI:10.3109/0886022X.2014.1001303 |
| [9] | Portilla D, Dent C, Sugaya T, et al. Liver fatty acid-binding protein as a biomarker of acute kidney injury after cardiac surgery[J]. Kidney Int, 2008, 73(4): 465–472. DOI:10.1038/sj.ki.5002721 |
| [10] | Han WK, Wagener G, Zhu Y, et al. Urinary biomarkers in the early detection of acute kidney injury after cardiac surgery[J]. Clin J Am Soc Nephrol, 2009, 4(5): 873–882. DOI:10.2215/CJN.04810908 |
| [11] | Beger RD, Holland RD, Sun J, et al. Metabonomics of acute kidney injury in children after cardiac surgery[J]. Pediatr Nephrol, 2008, 23(6): 977–984. DOI:10.1007/s00467-008-0756-7 |
| [12] | Thomas ME, Blaine C, Dawnay A, et al. The definition of acute kidney injury and its use in practice[J]. Kidney Int, 2015, 87(1): 62–73. DOI:10.1038/ki.2014.328 |
| [13] | Thumser AE, Moore JB, Plant NJ. Fatty acid binding proteins: tissue-specific functions in health and disease[J]. Curr Opin Clin Nutr Metab Care, 2014, 17(2): 124–129. DOI:10.1097/MCO.0000000000000031 |
| [14] | Martin GG, Atshaves BP, McIntosh AL, et al. Liver fatty-acid-binding protein (L-FABP) gene ablation alters liver bile acid metabolism in male mice[J]. Biochem J, 2005, 391(Pt 3): 549–560. |
| [15] | McMahon BA, Murray PT. Urinary liver fatty acid-binding protein: another novel biomarker of acute kidney injury[J]. Kidney Int, 2010, 77(8): 657–659. DOI:10.1038/ki.2010.5 |
| [16] | Przybylowski P, Koc-Zorawska E, Malyszko JS, et al. Liver fatty-acid-binding protein in heart and kidney allograft recipients in relation to kidney function[J]. Transplant Proc, 2011, 43(8): 3064–3067. DOI:10.1016/j.transproceed.2011.08.038 |
| [17] | Doi K, Noiri E, Sugaya T. Urinary L-type fatty acid-binding protein as a new renal biomarker in critical care[J]. Curr Opin Crit Care, 2010, 16(6): 545–549. DOI:10.1097/MCC.0b013e32833e2fa4 |
| [18] | Manabe K, Kamihata H, Motohiro M, et al. Urinary liver-type fatty acid-binding protein level as a predictive biomarker of contrast-induced acute kidney injury[J]. Eur J Clin Invest, 2012, 42(5): 557–563. DOI:10.1111/eci.2012.42.issue-5 |
| [19] | Xu Y, Xie Y, Shao X, et al. L-FABP: A novel biomarker of kidney disease[J]. Clin Chim Act, 2015, 445: 85–90. DOI:10.1016/j.cca.2015.03.017 |
| [20] | Devarajan P. Neutrophil gelatinase-associated lipocalin: a promising biomarker for human acute kidney injury[J]. Biomark Med, 2010, 4(2): 265–280. DOI:10.2217/bmm.10.12 |
| [21] | Mishra J, Dent C, Tarabishi R, et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery[J]. Lancet, 2005, 365(9466): 1231–1238. DOI:10.1016/S0140-6736(05)74811-X |
| [22] | Hjortrup PB, Haase N, Wetterslev M, et al. Clinical review: Predictive value of neutrophil gelatinase-associated lipocalin for acute kidney injury in intensive care patients[J]. Crit Care, 2013, 17(2): 211. DOI:10.1186/cc11855 |
| [23] | Liangos O, Tighiouart H, Perianayagam MC, et al. Comparative analysis of urinary biomarkers for early detection of acute kidney injury following cardiopulmonary bypass[J]. Biomarkers, 2009, 14(6): 423–431. DOI:10.1080/13547500903067744 |
| [24] | de Geus HR, Betjes MG, Bakker J. Biomarkers for the prediction of acute kidney injury: a narrative review on current status and future challenges[J]. Clin Kidney J, 2012, 5(2): 102–108. DOI:10.1093/ckj/sfs008 |
 2017, Vol. 19
2017, Vol. 19