视网膜母细胞瘤(retinoblastoma, RB)是一种起源于视网膜胚胎性核层细胞的恶性肿瘤,是婴幼儿最常见、危害性最大的原发性眼内恶性肿瘤,由于缺乏特异性的检测手段,致使其难以早期诊断[1]。在发展中国家对RB的延迟诊断达6个月以上,导致死亡率增加70%[2]。提高我国RB患儿的早期诊断水平是挽救患儿生命、提高存活率的关键。microRNA(miRNA或miR)是一类广泛存在于生物体的18~24个核苷酸的内源性非编码小RNA,通过与目标mRNA特定区域不同程度的互补结合而引起后者的降解或者翻译抑制,在多种恶性肿瘤中表达,并调控细胞增殖、侵袭转移。miR-17-92基因簇是一种有效的microRNA编码癌基因,定位于人染色体13q31-q32上,可产生miR-17-3p、miR-17-5p、miR-18a、miR-19a、miR-19b-1、miR-20a和miR-92a-1等7个成熟的miRNA[3]。miR 17-92基因簇可能与RB发生发展有关。Lillington等[4]、Kandalam等[5]研究发现,miR 17-92基因簇在原发性RB中过度表达,而上皮细胞粘附分子的抑制剂可导致miR 17-92基因簇表达减少,进而细胞增殖、侵袭能力降低。但国内未见miR-17-92基因与视网膜母细胞瘤发生发展关系的研究报道。本研究通过实时定量PCR(real-time quantitative reverse transcription-polymerase chain reaction, qRT-PCR)检测miR-17-92基因簇在RB患儿和健康对照者的表达,分析不同分期RB和其综合治疗前后的miR-17-92基因表达水平的差异,初步探讨其对RB的诊断价值,为提高RB诊断率及改善预后提供理论依据。
1 资料与方法 1.1 研究对象选择2013年1月至2017年1月于深圳市眼科医院确诊及深圳市人民医院接受化疗,且临床资料完整的20例RB患儿为研究对象。RB患儿根据眼部表现,尤其是典型眼底改变,再结合眼部CT、双眼彩色超声多普勒、眼底照相和/或眼球摘除后的病理检查确诊。患儿年龄3~57个月,平均20±17个月;男11例(55 %),女9例(45%);单眼受累14例(70%),双眼6例(30%)。局限于眼球内的肿瘤采用国际RB分期(intraocular international retinoblastoma classify, IIRC)分为A~E期[6]。双眼RB患儿按病情较重侧患眼的分期参与研究。20例患儿中A~C期(早中期)5例、D~E期(晚期)15例(D期9例+E期6例)。对照组选取同期我院健康体检儿童20例,其中男性10例、女性10例,年龄4~56个月、平均23±18个月。病例组和对照组在年龄、男女比例方面的差异无统计学意义。本研究获得医院伦理委员会批准,及研究对象监护人知情同意。
1.2 治疗方案RB患儿采用以化疗为主结合激光光凝、冷凝及眼球摘除手术等综合治疗原则[6]。20例患儿均以化疗为基础,结合激光治疗者4例,冷凝处理者2例,手术眼球摘除者11例。化疗采用卡铂、依托泊苷和长春新碱三联方案[7-8],由儿科医生负责;而激光光凝、冷凝及眼球摘除手术等则由眼科医师负责。对于早期发现的体积较小且较为局限的RB,采用激光光凝或冷凝等治疗,具体方案根据肿瘤的位置和大小制定。部分早期保眼患儿经过化疗后病情仍进展,需行眼球摘除手术。所有病例均定期于眼科医院随诊、评估。
1.3 qRT-PCR检测miR-17-92基因簇表达采集病例组综合治疗前、化疗后1周内以及健康对照组的空腹静脉血3 mL,1 500 r/min离心10 min,收集血清,保存备检。
取100 μL样品加入300 μL焦碳酸二乙酯水,提取总RNA,-80℃保存备用。采用所提取的RNA与AMV(avian myeloblastosis virus)逆转录酶(Takara公司)、逆转录引物(ABI公司)等制备逆转录体系,合成cDNA。
参照Taqman miRNA(ABI公司)qRT-PCR说明书制备反应体系,于ABI Prism 7300荧光定量PCR仪中行扩增和荧光信号检测,反应条件:95℃预变性15 min;95℃变性15秒,60℃退火60秒,共40个循环。采用2-△△CT法计算各目标miRNA相对表达量,结果用倍数表示[9]。所有样本均重复验证,每个样本独立重复试验3次。
1.4 统计学分析采用SPSS 17.0统计软件进行数据处理。计量资料以均数±标准差(x±s)表示,两个独立样本组间比较采用t检验;计数资料以百分率表示,采用χ2检验。采用ROC曲线下面积(area under the curve, AUC)反映血清miRNA诊断的准确性。AUC=0.5表示无诊断价值;0.5 < AUC≤0.7,表示诊断准确性较低;0.7 < AUC≤0.9,表示准确性中等;0.9 < AUC < 1,表示诊断准确性较高;AUC=1表示理想的诊断价值。取ROC曲线中最靠近左上角的一点做为预测诊断临界值,其灵敏度和特异度之和最大。P < 0.05为差异有统计学意义。
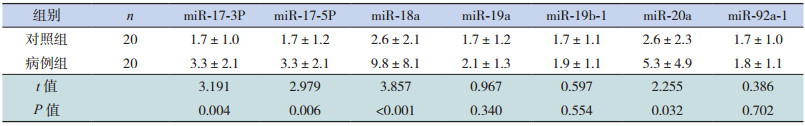
2 结果 2.1 两组miR-17-92基因簇的相对表达量RB患儿血清中miR-17-92基因簇成员miR-17-3P、miR-17-5P、miR-18a和miR-20a的相对表达量均高于对照组,以miR-18a升高更为显著,差异均有统计学意义(P < 0.05);而两组间miR-19a、miR-19b-1和miR-92a-1相对表达量的差异无统计学意义(P > 0.05)。见表 1。
| 表 1 两组miR-17-92基因簇的相对表达量的比较(x±s) |
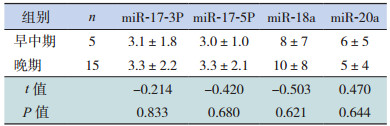
2.2 不同分期RB患儿的miR-17-5P、miR-17-3P、miR-18a和miR-20a表达比较
miR-17-5P、miR-17-3P、miR-18a和miR-20a表达量在早中期(IIRC分期A~C期)和晚期(IIRC分期D~E期)RB患儿之间的差异无统计学意义(P > 0.05),见表 2。
| 表 2 同分期RB患儿的miR-17-5P、miR-17-3P、miR-18a和miR-20a表达比较(x±s) |
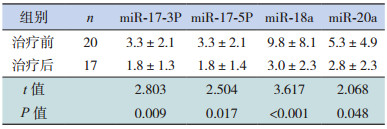
2.3 miR-17-5P、miR-17-3P、miR-18a和miR-20a在RB患儿综合治疗前后的表达比较
研究过程中脱落3例,共计17例RB患儿完成综合治疗,与治疗前相比,治疗后miR-17-5P、miR-17-3P、miR-18a和miR-20a相对表达量减少(P < 0.05),见表 3。
| 表 3 miR-17-5P、miR-17-3P、miR-18a和miR-20a在RB患儿治疗前后的表达(x±s) |
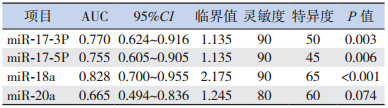
2.4 miR-17-3P、miR-17-5P、miR-18a和miR-20a对RB诊断价值的ROC曲线分析
miR-17-3P、miR-17-5P、miR-18a和miR-20a对RB诊断价值的ROC曲线分析显示,miR-18a的AUC最大,对诊断RB具有较好的灵敏度(90%)和特异度(65%),见表 4和图 1。
| 表 4 miR-17-3P、miR-17-5P、miR-18a和miR-20a对RB诊断价值的ROC曲线分析 |
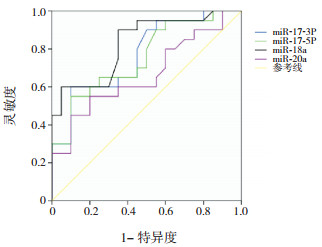
|
图 1 miR-17-3P、miR-17-5P、miR-18a和miR-20a对RB诊断价值的ROC曲线分析 |
3 讨论
我国每年报告新发视网膜母细胞瘤(RB)病例约1 300例,约85%的RB患儿发病年龄 < 5岁,占儿童致盲原因的5%[10]。RB在美欧国家存活率可高达95%~100%,因早期诊断保存了一部分视力[11];而欠发达国家包括我国在内的RB患儿诊断时多为高风险的晚期,常伴有复发转移,眼球摘除率较高。神经元特异性稀醇化酶(neuron-specific enolase, NSE)是目前临床广泛采用的RB肿瘤标志物,但神经母细胞瘤等其它恶性肿瘤也可使其增高,存在较高的假阳性率[12]。因此,寻找新的敏感的RB肿瘤标记物具有十分重要的意义。
miR-17-92基因簇在部分肿瘤高表达已被证实[13-16]。Conkrite等[17]发现,在成年小鼠和人类的RB中,miR-17-92基因簇均呈高表达,miR-17-92过表达可抑制细胞周期蛋白依赖性激酶抑制剂上调,促进增殖,驱动视网膜母细胞瘤形成。Nittner等[18]研究表明,miR-17-92失活可抑制小鼠成视网膜细胞瘤形成,并且miR-17/20a和p53的共沉默协同降低了人视网膜细胞瘤细胞的存活。说明miR-17-92基因簇表达与RB关系密切,有可能作为候选肿瘤标记物诊断RB。本研究发现,RB患儿血清miR-17-3P、miR-17-5P、miR-18a和miR-20a相对表达量较对照组升高,与Kandalam等[5]研究基本一致。结果还显示,miR-17-92基因簇表达量升高最多的是miR-18a,与Yang等[19]报道一致,提示miR-18a可能可作为RB的诊断标志物。本研究RB患儿血清miR-17-3P、miR-17-5P、miR-18a和miR-20a在RB早中期和晚期患儿之间的表达差异并无统计学意义,说明miR-17-3P、miR-17-5P、miR-18a和miR-20a可能在RB早期即已参与RB的发生发展,显示出作为RB肿瘤标志物的优势。综合治疗后RB患儿miR-17-3P、miR-17-5P、miR-18a和miR-20a相对表达量明显降低,提示这4种miRNA有可能可作为RB随访监测的指标。miR-17-3P、miR-17-5P、miR-18a和miR-20a的ROC曲线分析显示,miR-18a的AUC最大、并具有较好的灵敏度(90%)和特异度(65%)。提示miR-18a对于RB诊断可能具有较高的价值,扩大样本量、并进行治疗后的随访监测以进一步验证其诊断价值。随着人们对miRNAs在RB发生、发展和转移作用的研究不断深入,miR-17-92基因簇不仅有望作为RB肿瘤标志物,在RB的早期诊断中起到重要作用,还可能作为肿瘤生物治疗的靶点,为RB的预防、临床诊断、预后和靶向治疗提供新的契机。研究显示,SD-208[转化生长因子(TGF)-β RI激酶抑制剂]可以通过调节包括miR-17-92簇在内的一些miRNA表达而发挥抗癌作用,表明SD-208可能是视网膜母细胞瘤治疗的替代药物[20]。Jo等[21]研究显示,细胞信号激活和转录因子3(signal transducer and activator of transcription 3, STAT3)的激活与视网膜母细胞瘤细胞中miR-17-92基因簇上调相关,STAT3抑制剂可能可作为是视网膜母细胞瘤新的治疗方法。
综上所述,miR-17-92基因簇中miR-17-3P、miR-17-5P、miR-18a和miR-20a在RB患儿表达增加,可能参与了RB的发生发展过程,其中以miR-18a相对表达量最大和曲线下面积最大,有可能做为RB诊断的筛查指标。
| [1] | Ortiz MV, Dunkel IJ. Retinoblastoma[J]. J Child Neurol, 2016, 31(2): 227–236. DOI:10.1177/0883073815587943 |
| [2] | Chang CY, Chiou TJ, Hwang B, et al. Retinoblastoma in Taiwan: survival rate and prognostic factors[J]. Jpn J Ophthalmol, 2006, 50(3): 242–249. DOI:10.1007/s10384-005-0320-y |
| [3] | Attar M, Arefian E, Nabiuni M, et al. MicroRNA 17-92 expressed by a transposone-based vector changes expression level of cell-cycle-related genes[J]. Cell Biol Int, 2012, 36(11): 1005–1012. DOI:10.1042/CBI20110089 |
| [4] | Lillington DM, Kingston JE, Coen PG, et al. Comparative genomic hybridization of 49 primary retinoblastoma tumors identifies chromosomal regions associated with histopathology, progression, and patient outcome[J]. Genes Chromosomes Cancer, 2003, 36(2): 121–128. DOI:10.1002/(ISSN)1098-2264 |
| [5] | Kandalam MM, Beta M, Maheswari UK, et al. Oncogenic microRNA 17-92 cluster is regulated by epithelial cell adhesion molecule and could be a potential therapeutic target in retinoblastoma[J]. Mol Vis, 2012, 18: 2279–2287. |
| [6] | Dimaras H, Kimani K, Gallic BL, et al. Retinoblastoma[J]. Lancet, 2012, 379(9824): 1436–1446. DOI:10.1016/S0140-6736(11)61137-9 |
| [7] | 路璐, 唐松, 郭慧, 等. 全身化学药物治疗对晚期视网膜母细胞瘤患儿肿瘤浸润和眼外转移及特定疾病生存率的影响[J]. 中华眼底病杂志, 2016, 32(4): 404–407. |
| [8] | 刘智屏, 陈俐丽, 李博, 等. 鞘内化疗防治视网膜母细胞瘤颅内转移疗效观察[J]. 海南医学, 2016, 27(19): 3211–3213. DOI:10.3969/j.issn.1003-6350.2016.19.039 |
| [9] | 国芳, 姚玮艳, 戴欣, 等. 血清miRNA作为胃癌早期诊断标记物的初步研究[J]. 胃肠病学, 2014, 19(4): 198–202. |
| [10] | 王建仓, 赵敬聪, 赵军阳, 等. 早期视网膜母细胞瘤激光光凝治疗效果[J]. 中华眼视光学与视觉科学杂志, 2014, 16(6): 376–378. |
| [11] | MacCarthy A, Birch JM, Draper GJ, et al. Retinoblastoma: treatment and survival in Great Britain 1963 t02002[J]. Br J Ophthalmol, 2009, 93: 38–39. DOI:10.1136/bjo.2008.139626 |
| [12] | 胡慧敏, 王一卓, 黄东生, 等. 视网膜母细胞瘤患儿化疗前后血清及脑脊液实验室指标的变化[J]. 中华实用儿科临床杂志, 2015, 30(15): 1157–1160. DOI:10.3760/cma.j.issn.2095-428X.2015.15.010 |
| [13] | Andreas E, Hoelker M, Neuhoff C, et al. MicroRNA 17-92 cluster regulates proliferation and differentiation of bovine granulosa cells by targeting PTEN and BMPR2 genes[J]. Cell Tissue Res, 2016, 366(1): 219–230. DOI:10.1007/s00441-016-2425-7 |
| [14] | Dellago H, Bobbili MR, Grillari J. MicroRNA-17-5p: At the crossroads of cancer and aging -A mini-review[J]. Gerontology, 2017, 63(1): 20–28. DOI:10.1159/000447773 |
| [15] | Brockway S, Zeleznik-Le NJ. WEE1 is a validated target of the microRNA miR-17-92 cluster in leukemia[J]. Cancer Genet, 2015, 208(5): 279–287. DOI:10.1016/j.cancergen.2015.01.001 |
| [16] | 于宇, 张淑兰. miR-17-92基因簇研究进展[J]. 国际妇产科学杂志, 2014, 41(2): 124–127. |
| [17] | Conkrite K, Sundby M, Mukai S, et al. miR-17~92 cooperates with RB pathway mutations to promote retinoblastoma[J]. Genes Dev, 2011, 25(16): 1734–1745. DOI:10.1101/gad.17027411 |
| [18] | Nittner D, Lambertz I, Clermont F, et al. Synthetic lethality between Rb, p53 and Dicer or miR-17-92 in retinal progenitors suppresses retinoblastoma formation[J]. Nat Cell Biol, 2012, 14(9): 958–965. DOI:10.1038/ncb2556 |
| [19] | Yang Y, Mei Q. miRNA signature identification of retinoblastoma and the correlations between differentially expressed miRNAs during retinoblastoma progression[J]. Mol Vis, 2015, 21: 1307–1317. |
| [20] | Fadakar P, Akbari A, Ghassemi F, et al. Evaluation of SD-208, a TGF-β-RI kinase inhibitor, as an anticancer agent in retinoblastoma[J]. Acta Med Iran, 2016, 54(6): 352–358. |
| [21] | Jo DH, Kim JH, Cho CS, et al. STAT3 inhibition suppresses proliferation of retinoblastoma through down-regulation of positive feedback loop of STAT3/miR-17-92 clusters[J]. Oncotarget, 2014, 5(22): 11513–11525. DOI:10.18632/oncotarget |
 2017, Vol. 19
2017, Vol. 19