甲氨蝶呤(methotrexate, MTX)可单独或者与其它药物联合应用于多种肿瘤性疾病、免疫性疾病的治疗[1],其抗瘤谱较广,免疫抑制作用强,但与之相伴随的细胞毒性也可出现在多个系统。由于MTX在不同疾病治疗中的给药方式不同,其毒副作用有很大差异。其中,24小时持续静脉输注大剂量甲氨蝶呤(high-dose methotrexate, HDMTX)的毒副作用与其它给药方式相比更加明显。既往有关HDMTX毒副作用的报道多没有对毒副作用进行详细分类及分级。本研究收集接受HDMTX治疗的急性淋巴细胞白血病和非霍奇金淋巴瘤患儿的临床资料,将所出现的毒副作用进行分级整理、分析,并比较不同剂量HDMTX治疗下各种毒副作用发生率的差异,以进一步指导HDMTX的临床用药。
1 资料与方法 1.1 研究对象收集2005年1月至2015年4月期间北京大学第一医院儿科血液肿瘤病房接受HDMTX化疗的120例急性淋巴细胞白血病(acute lymphocytic leukemia, ALL)或非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)患儿的临床资料。其中男性75名、女性45名,平均7±4岁。ALL诊断参照儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[2],NHL诊断参照儿童非霍奇金淋巴瘤诊疗建议[3]。120例患儿行HDMTX化疗601例次,其中HDMTX剂量为3 g/m2的336例次,剂量为5 g/m2的265例次。参照文献[2-3],HDMTX剂量为3 g/m2者合用6-巯基嘌呤,而剂量为5 g/m2的合用长春新碱、环磷酰胺、阿糖胞苷、门冬酰胺酶、柔红霉素等化疗。
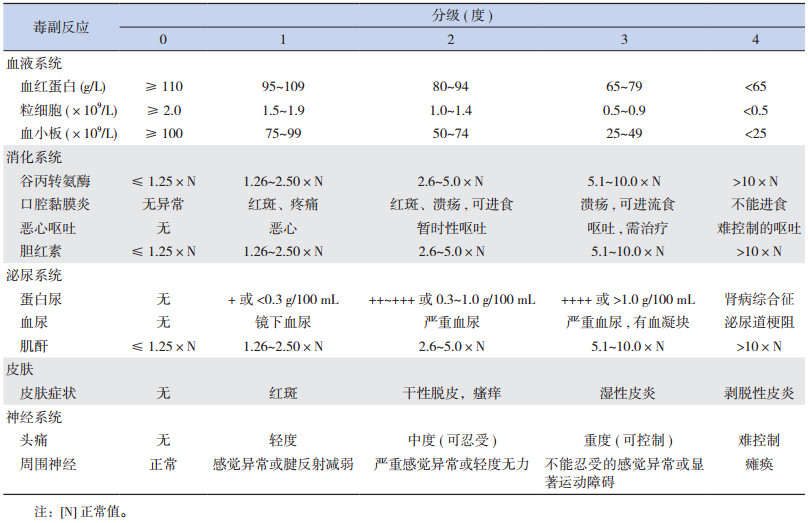
1.2 临床资料收集参照WHO抗癌药物毒副作用分级标准(表 1)[4],对HDMTX毒副作用进行分级:定量资料包括血常规、谷丙转氨酶、胆红素、血肌酐;半定量资料包括蛋白尿、血尿;定性资料包括口腔黏膜炎、恶心呕吐、皮肤症状(红斑、干性皮炎、瘙痒、湿性皮炎、剥脱性皮炎)、神经系统症状(头痛、感觉异常、运动障碍)等。定量及半定量资料记录与正常值差异最大的,定性资料记录程度最严重的表现。毒副作用根据严重程度分为5个等级,0级为无或者轻微,4级最严重,3级、4级毒副作用定义为严重毒副作用。
| 表 1 WHO抗癌药物常见毒副反应分级标准 |
1.3 MTX稳态药物浓度检测
所有入组病例均检测开始滴注MTX后的24 h稳态药物浓度(concentration at steady state, Css),应用荧光偏振免疫法检测,试剂盒为美国雅培公司生产。
1.4 HDMTX毒副作用的预防采用水化、碱化尿液以及四氢叶酸解救预防HDMTX毒副作用。(1)HDMTX输注前0.5 h予5%碳酸氢钠20 mL/m2静脉输注;(2)水化量为每天3 000 mL/m2,自HDMTX用药当日至MTX血药浓度降至0.1 μmol/L以下;(3)化疗第42 h开始予四氢叶酸解救,直至MTX血药浓度降至0.25 μmol/L以下。所有患儿均给予硼酸坐浴及口腔护理等。
1.5 统计学分析采用SPSS 17.0统计学软件对数据进行处理。计数资料用百分比(%)表示,组间比较采用χ2检验。P < 0.05为差异有统计学意义。
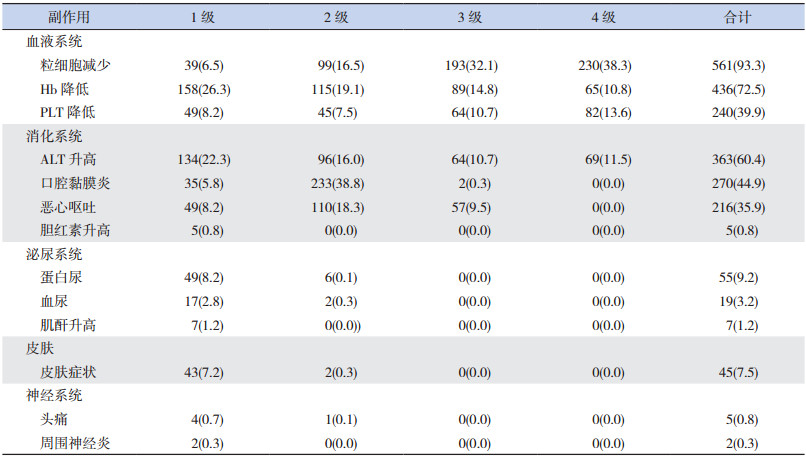
2 结果 2.1 HDMTX治疗后毒副作用分析120例患儿601例次HDMTX治疗后,血液系统最常见的毒副作用是粒细胞减少(93.3%,561/601),血红蛋白降低与血小板降低的发生率分别为72.6%(436/601)和39.9%(240/601);消化系统最常见的毒副作用是ALT升高(60.4%,363/601),胆红素升高的仅5例次,且均为1级;口腔黏膜炎和恶心呕吐的发生率分别为44.9%(270/601)和35.9%(216/601);泌尿系统最常见的毒副作用是蛋白尿(9.2%,55/601),血尿和血肌酐升高的发生率分别为3.2%(19/601)和1.2%(7/601);皮肤症状主要表现为皮肤红斑、干性脱皮、瘙痒等,发生率最高的为皮肤红斑(7.2%,43/601);神经系统毒副作用仅观察到7例次,其中1例次表现为痛觉过敏,1例次表现为肢体麻木,5例次表现为轻度头痛。见表 2。严重毒副作用见于血液系统和消化系统,以粒细胞减少(70.4%,423/601)和ALT升高(22.1%,133/601)较常见;泌尿系统、皮肤、神经系统均未观察到严重毒副作用事件。
| 表 2 601例次患儿接受HDMTX治疗后的毒副作用[例(%)] |
2.2 不同剂量HDMTX毒副作用发生率比较
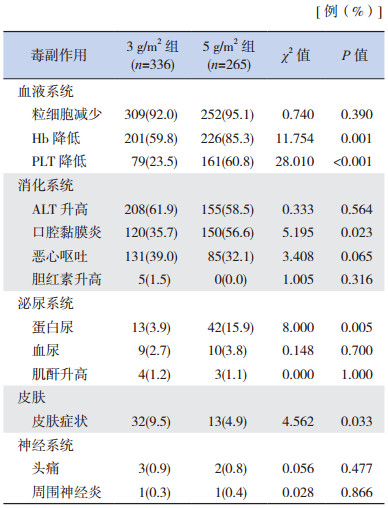
5 g/m2 HDMTX组的24 h Css明显高于3 g/m2组(73±15 μmol/L vs 39±9 μmol/L);Hb降低、PLT降低、口腔黏膜炎、蛋白尿和皮肤症状等毒副作用的发生率高于3 g/m2组(P < 0.05);两组粒细胞减少、胆红素升高、ALT升高、恶心呕吐、肌酐升高、血尿、周围神经炎、头痛等各项毒副作用的发生率差异均无统计学意义(P > 0.05)。见表 3。
| 表 3 不同剂量HDMTX治疗后毒副作用发生率比较 |
3 讨论
HDMTX可以明显提高血液及脑脊液中的药物浓度,为儿童白血病及其他肿瘤治愈率的改善做出了巨大贡献,然而随之而来的是其更加明显的毒副作用。文献报道,儿童HDMTX相关的毒副作用以感染/粒细胞缺乏伴发热及粘膜损害最为常见[5-6]。也有研究报道,HDMTX引起的肝功能损害、恶心呕吐、感染的发生分别可达60%、45%~50%及40%~55%[7]。本研究120例患儿共接受601例次HDMTX治疗,毒副作用包括粒细胞减少(93.3%)、ALT升高(60.4%)、口腔黏膜炎(44.9%)和胃肠道反应(35.9%),与文献报道相符。另外,本研究还观察到,HDMTX治疗后ALT升高的发生率虽高达60.4%,但仅5例次发生胆红素升高,且均为1级,未观察到肝衰竭的病例,说明HDMTX治疗后肝功能损害程度并不严重。
本研究结果显示,HDMTX治疗后毒副作用还可见于泌尿系统,表现为蛋白尿、血尿、肌酐升高,其中发生肌酐升高的仅7例次,均为1级,尚未达到急性肾功能损伤的程度。然而有文献报道,HDMTX治疗后大约10.1%的患者可以发生急性肾功能损伤,主要与MTX排泄延迟、合并用药有肾毒性或影响MTX排泄等因素有关[8]。本研究肌酐升高的7例次均有MTX排泄延迟,其中4例次在HDMTX治疗前或治疗过程中因合并感染加用抗生素治疗。另有研究表明,MTX的肾脏毒性与亚甲基四氢叶酸还原酶的基因多态性有关。但本研究患儿是否存在亚甲基四氢叶酸还原酶基因缺陷及其与HDMTX毒副作用的关系有待进一步研究。
除此之外,HDMTX还可导致神经系统毒性,从轻度的可逆性症状到慢性进展性脑病[10],表现为嗜睡、抽搐、感觉异常甚至偏瘫等[11-12]。本研究HDMTX神经系统毒副作用观察到1例次痛觉过敏,1例次肢体麻木,5例次头痛,均为可逆性症状,未观察到嗜睡、抽搐、偏瘫及不可逆性神经系统症状等。文献报道,少数患儿在HDMTX应用过程中还可观察到过敏反应,轻症仅表现为皮肤红斑,重症甚至出现致命性过敏反应,机制与免疫介导有关[13-14]。本研究45例次发生过敏反应,主要表现为皮肤红斑,少数表现为皮肤瘙痒,干性脱皮,未观察到重症过敏反应。
本研究每一例次均进行了24 h MTX稳态药物浓度检测,与3 g/m2 HDMTX组相比较,5 g/m2组的24 h稳态药物浓度较高,其血象受抑、口腔黏膜炎、蛋白尿和皮肤症状等毒副作用的发生率也较高,但两组肝功能损害、消化道反应、血尿、周围神经症状及头痛等副作用的发生率差异均无统计学意义。提示HDMTX的骨髓抑制、口腔黏膜炎、蛋白尿以及皮疹等毒副作用具有剂量依赖性,应该做好充分的水化、碱化尿液及解救等防治工作。
儿童肿瘤的治疗为多药联合的综合治疗,毒副作用不能完全除外其它化疗药物的协同作用所致,而且5 g/m2 HDMTX组与3 g/m2组的联合用药不尽相同,这是本研究的局限所在。
综上,HDMTX治疗后严重毒副作用主要发生在血液系统和消化系统,血液系统骨髓抑制、口腔黏膜炎、蛋白尿、皮肤症状等毒副作用的发生均有一定的剂量依赖性。
| [1] | Treon SP, Chabner BA. Concepts in use of high-dose methotrexate therapy[J]. Clin Chem, 1996, 42(8 Pt 2): 1322–1329. |
| [2] | 中华医学会儿科学分会血液学组, 中华儿科杂志编辑委员会. 儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[J]. 中华儿科杂志, 2006, 44(5): 392–395. |
| [3] | 中华医学会儿科学分会血液学组, 中国抗癌协会儿科专业委员会, 《中华儿科杂志》编辑委员会. 儿童非霍奇金淋巴瘤诊疗建议[J]. 中华儿科杂志, 2011, 49(3): 186–192. |
| [4] | 抗癌药急性及亚急性毒性反应分度标准(WHO标准)[J]. 癌症, 1992, 11(3): 253. |
| [5] | Tsurusawa M, Gosho M, Mori T, et al. Statistical analysis of relation between plasma methotrexate concentration and toxicity in high-dose methotrexate therapy of childhood nonHodgkin lymphoma[J]. Pediatr Blood Cancer, 2015, 62(2): 279–284. DOI:10.1002/pbc.25305 |
| [6] | Pauley JL, Panetta JC, Crews KR, et al. Between-course targeting of methotrexate exposure using pharmacokinetically guided dosage adjustments[J]. Cancer Chemother Pharmacol, 2013, 72(2): 369–378. DOI:10.1007/s00280-013-2206-x |
| [7] | Cwiklinska M, Balwierz W, Stanuch H. Clinical tolerance of high-dose methotrexate used in consolidation therapy in children with acute lymphoblastic leukemia[J]. Przegl Lek, 2010, 67(6): 355–360. |
| [8] | 程道海, 陆华, 刘滔滔, 等. 大剂量甲氨蝶呤治疗儿童急性淋巴细胞白血病致急性肾损伤分析[J]. 中国新药杂志, 2015, 24(3): 357–360. |
| [9] | 孟琳懿, 田怀平, 王小洁, 等. 亚甲基四氢叶酸还原酶基因多态性对儿童甲氨蝶呤化疗后毒副反应[J]. 儿科药学杂志, 2013, 19(2): 1–4. |
| [10] | Garcia-Puig M, Fons-Estupina MC, Rives-Sola S, et al. Neurotoxicity due to methotrexate in paediatric patients. Description of the clinical symptoms and neuroimaging findings[J]. Rev Neurol, 2012, 54(12): 712–718. |
| [11] | Bhojwani D, Sabin ND, Pei D, et al. Methotrexate-induced neurotoxicity and leukoencephalopathy in childhood acute lymphoblastic leukemia[J]. J Clin Oncol, 2014, 32(9): 949–959. DOI:10.1200/JCO.2013.53.0808 |
| [12] | Shah N, Zambidis ET. False-photosensitivity and transient hemiparesis following high-dose intravenous and intrathecal methotrexate for treatment of acute lymphoblastic leukemia[J]. Pediatr Blood Cancer, 2009, 53(1): 103–105. DOI:10.1002/pbc.v53:1 |
| [13] | Millot F, Auriol F, Brecheteau P, et al. Acral erythema in children receiving high-dose methotrexate[J]. Pediatr Dermatol, 1999, 16(5): 398–400. |
| [14] | Pugi A, Benemei S, Vietri M, et al. Anaphylaxis during the first course of high-dose methotrexate: a case report and literature review[J]. J Clin Pharm Ther, 2012, 37(2): 245–248. DOI:10.1111/j.1365-2710.2011.01275.x |
 2017, Vol. 19
2017, Vol. 19