过敏性紫癜(HSP)是儿科常见的系统性血管炎,是免疫复合物介导的以坏死性小血管炎为主要病理改变的全身性疾病[1]。本病常反复发作,严重影响患儿身体健康。维生素D除了众所周知的调节钙磷代谢、维持骨骼健康的功能外,还对免疫系统具有广泛调节作用,不仅能促进适应性免疫、增强天然免疫和刺激免疫细胞分化,还具有抗炎、增强糖皮质激素(GC)、克服GC抵制等作用[2]。目前研究证实,低水平维生素D与支气管哮喘、反复呼吸道感染以及结缔组织疾病如系统性红斑狼疮、类风湿性关节炎等疾病的活动性及临床表现有一定关系,但HSP患者体内是否存在维生素D水平下降以及维生素D水平与疾病严重程度之间是否存在关联尚不明确。本研究比较HSP患儿与正常儿童血清维生素D水平的差异,以及不同维生素D水平下,HSP临床表现的不同,探讨维生素D水平与HSP疾病发生及严重程度的相关性,为寻找新的治疗靶点提供理论依据。
1 资料与方法 1.1 一般资料选取2015年1~12月于我院儿科第一次诊断为HSP的住院患儿50例为HSP组,其中男34例,女16例,平均年龄7.9±3.0岁。诊断标准参照2006年欧洲风湿病联盟(EULAR)和欧洲儿科风湿病学会(PRES)新标准[3]:可触性皮疹(必要条件)伴以下任何1条:(1)弥散性腹痛;(2)任何部位活检示IgA沉积;(3)关节炎/关节痛;(4)肾脏受损(血尿和/或蛋白尿)。另选取同期于我院健康体检儿童49例为对照组,纳入标准:(1)未患HSP,(2)年龄3~10岁,(3)营养发育正常,(4)未合并急慢性疾病,(5)抽血前6个月未使用维生素D制剂。其中男26例,女23例,平均年龄8.1±2.7岁。两组儿童性别、年龄方面比较差异无统计学意义(P > 0.05)。所有入组儿童家长均签署知情同意书。
1.2 方法分别采集HSP组(未治疗前)和健康对照组儿童空腹静脉血2 mL,分离血清,由专人采用ELISA法检测两组血清25羟基维生素D3[25-(OH)D3]水平。依据检测结果将HSP组分为维生素D正常、不足、缺乏和严重缺乏组,观察并记录两组患儿临床表现、入院前病程、肾脏受累、激素使用情况及住院天数等。血清25-(OH)D3 > 20 ng/mL为维生素D正常;15 ng/mL < 25-(OH)D3≤20 ng/mL为维生素D不足;25-(OH)D3≤15 ng/mL为维生素D缺乏;25-(OH)D3≤5 ng/mL为维生素D严重缺乏[4-5]。
1.3 统计学分析采用SPSS 20.0统计软件对数据进行统计学分析,符合正态分布的计量资料以均数±标准差(x±s)表示,非正态分布计量资料以中位数(四分位间距)[P50(P25,P75)]表示,两组间比较采用独立样本t检验或秩和检验;计数资料以百分率(%)表示,两组间比较采用χ2检验。P < 0.05为差异有统计学意义。为满足检验要求,在做χ2检验及秩和检验时将维生素D缺乏组与严重缺乏组合并[25-(OH)D3≤15 ng/mL],将维生素D正常组与不足组合并[25-(OH)D3 > 15 ng/mL]。
2 结果 2.1 HSP组与健康对照组血清25-(OH)D3水平HSP组患儿血清25-(OH)D3水平为16±6 ng/mL,健康对照组为29±5 ng/mL,两组比较差异有统计学意义(t=12.42,P < 0.01)。
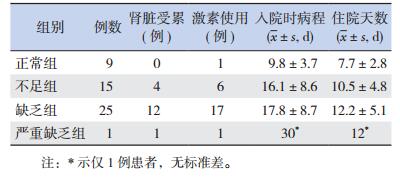
2.2 不同维生素D水平HSP患儿的临床特点50例HSP患儿根据血清25-(OH)D3水平分为正常、不足、缺乏、严重缺乏4组。各组患儿肾脏受累例数、激素使用例数、入院时病程及住院天数见表 1。
| 表 1 不同维生素D水平HSP患儿的临床特点 |
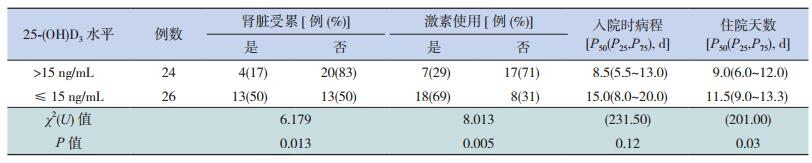
将维生素D缺乏组与严重缺乏组合并[25-(OH)D3≤15 ng/mL],将维生素D正常组与不足组合并[25-(OH)D3 > 15 ng/mL],进行统计学比较分析。血清25-(OH)D3≤15 ng/mL HSP患儿肾脏受累发生率、激素使用率均高于25-(OH)D3 > 15 ng/mL患儿(P < 0.05)。血清25-(OH)D3≤15 ng/mL HSP患儿住院天数长于25-(OH)D3 > 15 ng/mL患儿(P < 0.05);入院时病程在两组不同维生素D水平患儿中比较差异无统计学意义(P > 0.05)。见表 2。
| 表 2 不同维生素D水平HSP患儿的临床特点比较 |
3 讨论
HSP是一种全身小血管变态反应所导致的系统性血管炎性疾病,以血小板不减少性紫癜为主要表现,常伴消化道、关节、肾脏及其他脏器受累[6]。本病发病机制尚未完全清楚,主要以体液免疫异常为主。而调节性T淋巴细胞的减少引起免疫抑制效应不足,可能是HSP急性期免疫失衡的重要原因[7]。
维生素D作为一种重要的营养素在钙磷代谢中起着重要的作用,但事实上,维生素D并非一种单纯的维生素,它属于人体内分泌代谢系统的一员,并有其自身的核激素受体—维生素D受体(VDR)。无活性的维生素D进入血液循环后,首先在肝脏25-羟化酶作用下转化为25-(OH)D3,然后25-(OH)D3经肾脏内1α-羟化酶催化生成其活性形式1, 25-二羟维生素D3 [1, 25-(OH)D3],最后与靶组织内的VDR结合发挥生物学作用。一般临床检验时测得血液中的维生素D为25-(OH)D3,常被用来评估人体维生素D的营养状况。
郭桂梅等[8]报道HSP患儿血浆1, 25-(OH)D3低于健康对照组,并推测机体通过VDR过表达与24羟化酶(CYP24A1)低表达代偿1, 25-(OH)D3的不足,当代偿机制不足以维持1, 25-(OH)D3的有效浓度时,1, 25-(OH)D3对淋巴细胞抑制作用减低,引起疾病发生。本研究应用ELISA法检测外周血25-(OH)D3水平,发现HSP患儿与健康儿童相比,血清25-(OH)D3水平明显降低,说明HSP患儿维生素D的缺乏不仅表现为其活性形式的缺乏,中间状态的维生素D亦缺乏,由此推测,HSP患儿维生素D的缺乏可能与饮食及光照因素所致来源不足或肝脏25-(OH)D3合成减少有关,有待进一步研究证实。
HSP患儿免疫调节异常包括Th1/Th2细胞失衡,Th2细胞过度活化[7],调节性T细胞减少,适应性免疫缺陷,免疫球蛋白异常分泌、炎性因子和趋化因子产生过多[8]。而维生素D通过直接作用于T淋巴细胞及间接作用于抗原提呈细胞促进适应性免疫反应[9],能调控Th1/Th2细胞免疫偏移[10]。在对多种免疫细胞调控的同时,维生素D对多种细胞因子也有调节作用,如对IL-12、IFN-γ、TNF-α等有下调作用,对IL-4、IL-10具有上调作用[11]。故推测维生素D缺乏时不能有效促进适应性免疫反应,不能有效抑制炎性因子、趋化因子的表达,导致炎性介质的释放,引起血管壁炎症性病变,可能对HSP发病起着辅助作用。
肾脏受累是本病预后的关键,肾脏受累诊断标准为紫癜病程中2次以上尿常规红细胞计数 > 5/高倍镜视野和(或)尿蛋白定性阳性。本研究检测25-(OH)D3而非1, 25-(OH)D3的原因在于肾脏是1, 25-(OH)D3合成的器官,故1, 25-(OH)D3水平低下可能是HSP患者肾脏受累的结果而非其肾脏受累的危险因素,本组资料显示血清25-(OH)D3水平≤15 ng/mL时肾脏受累发生率达50%,明显高于25-(OH)D3水平 > 15 ng/mL者(17%)。因维生素D的缺乏发生在肾脏损害之前,可以认为维生素D缺乏增加肾脏受累风险。
糖皮质激素是HSP急性期常用药物,用于伴有腹痛、消化道出血及关节肿痛等症状及严重肾脏损害的患者。本研究显示维生素D缺乏时激素使用率增加,可能与维生素D缺乏加重免疫功能紊乱,炎性因子及趋化因子产生过多,血管炎症重,常累及其他器官包括关节、消化道、肾脏等有关。
有学者发现67%HSP患儿有反复发作的倾向[12],频繁复发或反复使HSP病情呈慢性化进展[13],且会使肾脏受累的危险性增加[14],本研究发现25-(OH)D3≤15 ng/mL的HSP患儿住院时间较25-(OH)D3 > 15 ng/mL患儿延长,提示维生素D缺乏者病情更易迁延。
维生素D能促进VDR表达,激活免疫细胞VDR信号通路,VDR活化可导致下游基因产物变化,增强免疫调节反应[15]。体外研究表明维生素D3可以通过VDR下调NF-κB表达,抑制肾小管近端小管上皮炎症,动物研究显示维生素D3通过抑制肾素-血管紧张素-醛固酮系统保护足细胞,减少蛋白尿,临床研究也显示,补充维生素D及其类似物可降低慢性肾脏疾病患者的蛋白尿水平[16]。
本研究初步证实维生素D缺乏在HSP患者中较为常见,推测补充维生素D可能对HSP尤其是伴有肾脏损害的患儿病情控制及恢复有意义。然而维生素D在HSP发病中的确切机制尚有待进一步研究,其对HSP有无治疗作用,能否缩短HSP患儿病程,改善远期预后,亦有待设计严谨的临床随机对照试验进行验证。
| [1] | 丁云峰, 李志辉, 吴天慧, 等. 儿童过敏性紫癜伴胰腺损害的临床特征[J]. 中华实用儿科临床杂志, 2013, 28(7): 525–527. |
| [2] | Iqbal SF, Freishtat RJ. Mechanism of action of vitamin D in the asthmatic lung[J]. J Investig Med, 2011, 59(8): 1200–1202. DOI:10.2310/JIM.0b013e31823279f0 |
| [3] | Ozen S, Ruperto N, Dillon MJ, et al. EULAR/PReS endorsed consensus criteria for the classification of childhood vasculitides[J]. Ann Rheum Dis, 2006, 65(7): 936–941. |
| [4] | 中华医学会儿科学分会儿童保健学组, 《中华儿科杂志》编辑委员会. 儿童微量营养素缺乏防治建议[J]. 中华儿科杂志, 2010, 48(7): 502–509. |
| [5] | Misra M, Pacaud D, Petryk A, et al. Vitamin D deficiency in children and its management:review of current knowledge and recommendations[J]. Pediatrics, 2008, 122(2): 398–417. DOI:10.1542/peds.2007-1894 |
| [6] | 胡亚美, 江载芳. 诸福棠实用儿科学(上册)[M]. 第7版.北京: 人民卫生出版社, 2005: 688-690. |
| [7] | 唐雪梅. 过敏性紫癜病因及免疫发病机制[J]. 实用儿科临床杂志, 2012, 27(21): 1634–1636. DOI:10.3969/j.issn.1003-515X.2012.21.005 |
| [8] | 郭桂梅, 王娟, 夏敏, 等. 过敏性紫癜患儿血浆1, 25(OH)2D3、维生素D受体和24-羟化酶表达的意义[J]. 中华实用儿科临床杂志, 2013, 28(21): 1640–1642. |
| [9] | Dimeloe S, Nanzer A, Ryanna K, et al. Regulatory T cells, inflammation and the allergic response-The role of glucocorticoids and vitamin D[J]. J Steroid Biochem Mol Biol, 2010, 120(2-3): 86–95. DOI:10.1016/j.jsbmb.2010.02.029 |
| [10] | Mahon BD, Wittke A, Weaver V, et al. The targets of vitamin D depend on the differentiation and activation status of CD4 positive T cells[J]. J Cell Biochem, 2003, 89(5): 922–932. DOI:10.1002/(ISSN)1097-4644 |
| [11] | 程雷, 吴海燕, 田慧琴. 维生素D在变应性鼻炎发病中的作用[J]. 临床耳鼻咽喉头颈外科杂志, 2016, 30(9): 675–677. |
| [12] | 吴秀萍. 小儿36例复发及慢性过敏性紫癜临床分析[J]. 中国全科医学, 2010, 13(9): 999–1000. |
| [13] | Donnithorne KJ, Atkinson TP, Hinze CH, et al. Rituximab therapy for severe refractory chronic Henoch-Schönlein purpura[J]. J Pediatr, 2009, 155(1): 136–139. DOI:10.1016/j.jpeds.2008.12.049 |
| [14] | Jauhola O, Ronkainen J, Koskimies O, et al. Renal manifestations of Henoch-Schönlein purpura in a 6-month prospective study of 223 children[J]. Arch Dis Child, 2010, 95(11): 877–882. DOI:10.1136/adc.2009.182394 |
| [15] | 徐祝菲, 刘恩梅, 邓昱. 血清维生素D水平与儿童支气管哮喘的相关性及其可能机制[J]. 实用儿科临床杂志, 2012, 27(9): 715–717. |
| [16] | Li YC. Vitamin D receptor signaling in renal and cardiovascular protection[J]. Semin Nephrol, 2013, 33(5): 433–447. DOI:10.1016/j.semnephrol.2013.07.005 |
 2017, Vol. 19
2017, Vol. 19