2. 南京医科大学附属无锡妇幼保健院 妇产科, 江苏 无锡 214002;
3. 南京医科大学附属无锡妇幼保健院 检验科, 江苏 无锡 214002
近年来,维生素D营养状态与人体健康是国内外学者广泛关注的热点问题之一。维生素D缺乏不仅易导致儿童佝偻病及老年骨质疏松症,而且会增加自身免疫性疾病、糖尿病、心血管疾病、结肠癌、多发性硬化、精神分裂症等的发病风险[1]。新生儿维生素D缺乏不仅增加代谢性骨病、佝偻病的发病率,而且与支气管肺发育不良[2]、呼吸道感染[3]、过敏性鼻炎[4]、支气管哮喘[5]、肥胖[6]、1型糖尿病[7]、孤独症[8]发病率增加密切相关,甚至影响生长及神经认知发育[9-11]。国外文献报道早产儿维生素D缺乏的发生率为12.6%~92.0%[12-13],但纳入研究对象多为胎龄小于32周的早产儿。目前国内鲜有关于早产儿维生素D营养状态研究的报道。血清25(OH)D是反映人体维生素D营养状态的最佳指标[14]。本研究通过检测早产儿血清25(OH)D水平,并分析其可能影响因素,为防治早产儿代谢性骨病及佝偻病提供理论依据。
1 资料与方法 1.1 研究对象选取2014年1月至2016年12月入住南京医科大学附属无锡妇幼保健院新生儿重症监护室,胎龄 < 37周、生后24 h内入院的早产儿为研究对象。排除标准:(1)严重先天畸形;(2)母亲疾病或药物治疗可能影响维生素D或者钙代谢,如慢性肾衰竭、慢性肝脏疾病、甲状旁腺疾病、骨代谢疾病、孕期服用抗癫癎药物等。外院转入患儿因母亲资料不完整排除。本研究通过南京医科大学附属无锡妇幼保健院伦理委员会的批准。所有纳入病例均获得监护人或授权委托人的知情同意。
1.2 数据收集早产儿的性别、出生体重、出生季节、胎龄在入NICU时记录。早产儿的胎龄由母亲的末次月经时间计算,同时通过胎龄评估进行确认。母亲的年龄、职业、早孕期体重指数(BMI)、受孕方式、妊娠胎数、分娩方式、产前激素使用情况及妊娠期并发症等通过查阅产科电子病历获得。妊娠期并发症主要包括妊娠期糖尿病、子癎前期、妊娠期肝内淤积、绒毛膜羊膜炎、胎儿宫内生长受限。绒毛膜羊膜炎由胎盘病理诊断。
1.3 标本收集与检测所有纳入病例均于入院后首次静脉采血时留取血标本,在4℃下,以3 500 r/min,离心10 min,分离血清进行25(OH)D水平检测。检测采用化学发光免疫分析法,所用仪器为LIAISON化学发光分析仪,血清25(OH)D试剂盒由美国DiaSorin公司提供。
1.4 数据定义及计算公式维生素D营养状态的定义:维生素D缺乏指25(OH)D < 30 nmol/L;维生素D不足指25(OH)D水平为30 nmol/L ~;维生素D充足指25(OH)D ≥50 nmol/L[15]。季节划分:春季指3~5月;夏季指6~8月;秋季指9~11月;冬季指12月至次年2月。肥胖:BMI≥28 kg/m2;超重:BMI为24 kg/m2~;体重正常:BMI < 24 kg/m2。BMI=体重(kg)/身高2(m2)。
1.5 统计学分析应用SPSS 19.0统计软件对数据进行统计学分析。正态分布的计量资料以均数±标准差(x±s)表示,两组间均数比较采用独立样本t检验;多组间均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。计数资料采用百分比(%)表示,多组间比较采用卡方检验;组间两两比较采用Bonferroni法:先对需要比较的行×列表资料进行χ2分割,变成多个四格表,再对每个四格表进行χ2检验,调整检验水准=0.05/比较的次数。早产儿维生素D水平影响因素采用二元logistic回归模型进行分析。除多组样本率组间两两比较外,P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况本研究共纳入早产儿600例,胎龄24+1~36+6周,平均胎龄32.9±2.6周,其中男341例,女259例,男女之比为1.3:1。
2.2 早产儿维生素D水平血清25(OH)D水平范围为10.4~122.3 nmol/L,平均37±17 nmol/L。维生素D缺乏、不足、充足的比例分别为42.0%(252/600)、38.7%(232/600)和19.3%(116/600)。
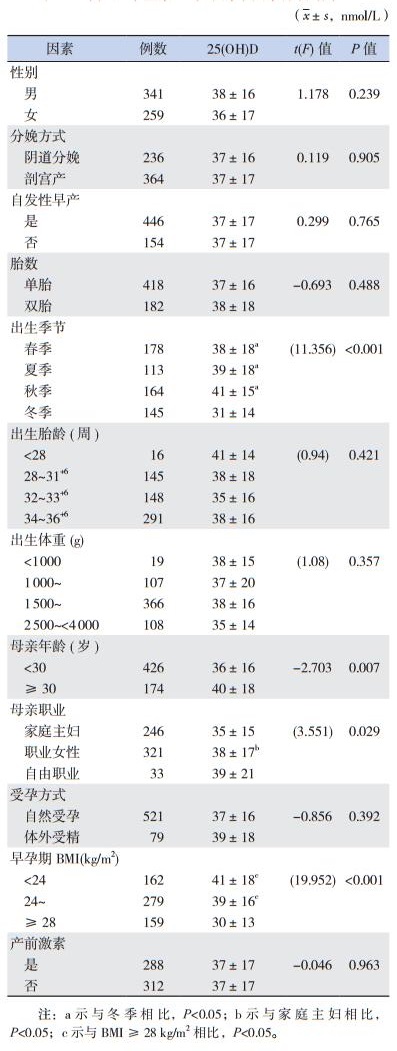
2.3 影响早产儿维生素D水平的单因素分析春季、夏季、秋季出生的早产儿血清25(OH)D水平显著高于冬季出生的早产儿(P < 0.05);母亲年龄≥30岁者分娩早产儿血清25(OH)D水平显著高于母亲年龄 < 30岁者(P < 0.05);母亲为职业女性者分娩早产儿血清25(OH)D水平显著高于母亲为家庭主妇者(P < 0.05);母亲肥胖者分娩早产儿血清25(OH)D水平显著低于母亲超重或体重正常者(P < 0.05)。不同性别、出生胎龄、胎数、出生体重、受孕方式、分娩方式以及是否自发性早产、应用产前激素的早产儿组间血清25(OH)D水平比较差异无统计学意义(P > 0.05)。见表 1。
| 表 1 早产儿维生素D水平的单因素分析结果 |
2.4 影响早产儿维生素D营养状态的单因素分析
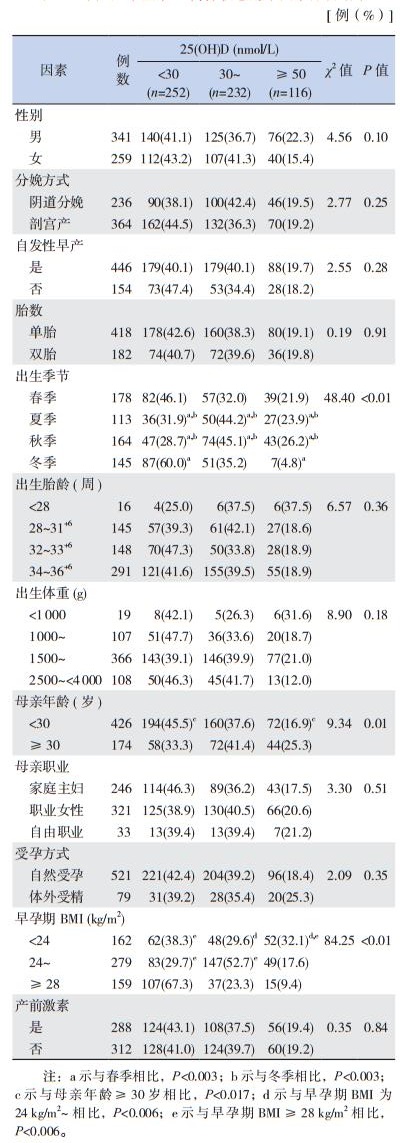
夏季、秋季出生早产儿维生素D缺乏的发生率显著低于春季、冬季出生早产儿(P < 0.003);母亲年龄≥30岁者,其早产儿维生素D缺乏的发生率显著低于母亲年龄 < 30岁者(P < 0.017);母亲肥胖者,其早产儿维生素D缺乏的发生率显著高于母亲超重或体重正常者(P < 0.006)。不同性别、出生胎龄、胎数、出生体重、受孕方式、分娩方式以及是否自发性早产、应用产前激素的早产儿间维生素D缺乏的发生率比较差异均无统计学意义(P > 0.05)。见表 2。
| 表 2 早产儿维生素D营养状态的单因素分析结果 |
2.5 妊娠期并发症对早产儿维生素D水平的影响
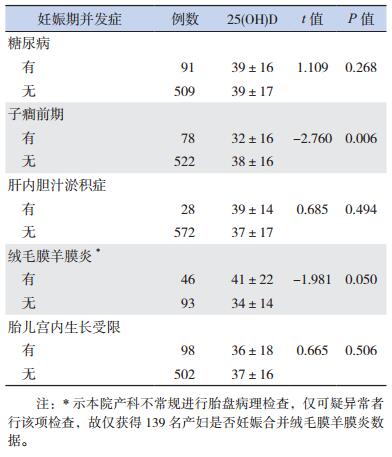
母亲妊娠合并子癎前期者,其早产儿血清25(OH)D水平显著低于非子癎前期者(P < 0.05)。母亲妊娠合并糖尿病、肝内胆汁淤积症、绒毛膜羊膜炎以及胎儿宫内生长受限均不影响早产儿血清25(OH)D水平(P > 0.05)。见表 3。
| 表 3 不同妊娠期并发症对早产儿维生素D水平影响的分析结果(x±s,nmol/L) |
2.6 妊娠期并发症对早产儿维生素D营养状态的影响
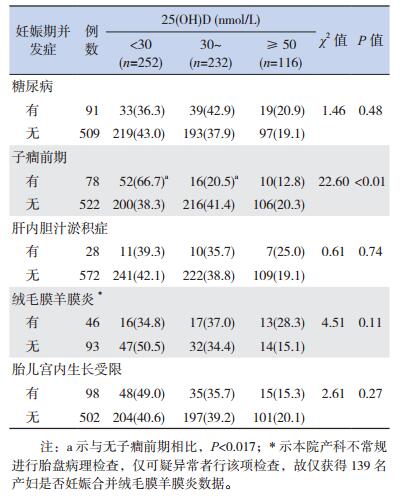
母亲妊娠合并子癎前期者,其早产儿维生素D缺乏的发生率显著高于无子癎前期者(P < 0.017);维生素D不足的发生率显著低于无子癎前期者(P < 0.017)。其余不同妊娠合并症不影响早产儿维生素D缺乏的发生率(P > 0.05)。见表 4。
| 表 4 不同妊娠期并发症对早产儿维生素D营养状态影响的分析结果[例(%)] |
2.7 早产儿维生素D缺乏影响因素的多因素分析
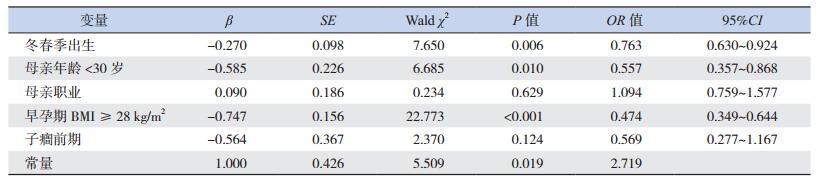
经二元logistic回归分析显示,冬春季出生、母亲年龄 < 30岁以及早孕期BMI≥28 kg/m2为早产儿维生素D缺乏的危险因素(P < 0.05),母亲职业及妊娠合并子癎前期为混杂因素(P > 0.05)。见表 5。
| 表 5 早产儿维生素D缺乏影响因素的多因素分析结果 |
3 讨论
维生素D缺乏已经成为一个全球性的公共卫生问题。欧洲维生素D缺乏者占人口总数的40.4%[16]。本研究结果显示,江苏无锡地区早产儿维生素D缺乏的发生率为42.0%,显著低于河北沧州地区(97.4%)[17],考虑与诊断标准不同有关。中国上海报道新生儿维生素D缺乏的发生率为36.3%[18],低于本研究,考虑与无锡地区妇女妊娠期维生素D缺乏率高于上海地区以及研究对象为早产儿有关[19-20]。因为既往研究显示新生儿早期维生素D水平主要取决于母体维生素D水平,以及早产儿维生素D缺乏的发生率高于足月儿[21]。
本研究发现冬季出生早产儿维生素D水平低于夏秋季节,维生素D缺乏的发生率高于夏秋季节,与Burris等[22]的研究结果一致,考虑与冬季天气寒冷导致孕妇户外活动减少以及日照时间短有关。人体维生素D主要由皮肤中7-脱氢胆固醇经紫外线照射合成,冬季户外活动减少以及日照时间短导致母体维生素D水平下降,而新生儿早期维生素D水平主要取决于母体维生素D水平,因此,冬季出生的新生儿更易发生维生素D缺乏。既往研究中,一些研究认为母亲年龄与早产儿维生素D水平无相关性[18],一些研究认为母亲年龄与早产儿维生素D水平呈负相关性[22]。本研究显示母亲年龄≥30岁者,其早产儿维生素D缺乏的发生率低于母亲年龄 < 30岁者,考虑与社会因素有关,如对孕期补充维生素D的重视程度等。本研究中,母亲肥胖的早产儿其维生素D水平降低,维生素D缺乏的发生率增高,与Josefson等[23]的研究结果一致,考虑与维生素D为脂溶性维生素,肥胖患者体脂含量增加,维生素D溶于脂肪组织增多有关。
近年来的研究显示母体维生素D缺乏是多种围产期并发症,如:妊娠期糖尿病[24]、子癎前期[25]、妊娠期肝内胆汁淤积症[26]、胎儿宫内生长受限[27]等的高危因素。这些因素也是导致选择早产分娩的主要原因。本研究分析妊娠合并糖尿病、子癎前期、肝内胆汁淤积症、绒毛膜羊膜炎和胎儿宫内生长受限对早产儿维生素D影响的结果显示:母亲妊娠合并子癎前期,其早产儿血清维生素D水平降低,维生素D缺乏的发生率增高,考虑与母体维生素D缺乏是子癎前期的强危险因素有关,与Pena等[28]和Mohaghegh等[29]的研究结果一致。
进一步,为了排除混杂因素对早产儿维生素D水平的影响,我们通过二元logistic回归模型分析发现,早产儿冬春季出生、母亲年龄 < 30岁以及母亲早孕期BMI≥28 kg/m2为早产儿维生素D缺乏的危险因素,母亲职业及子癎前期为混杂因素,提示冬春季节分娩、母亲年龄 < 30岁及肥胖更应注意围产期维生素D的及时补充。既往研究显示胎儿或早产儿维生素D水平主要取决于母体妊娠期维生素D水平,母体妊娠期维生素D水平与妊娠期维生素D补充、阳光照射及母亲生活方式等有关[18, 21]。本研究因为研究经费等问题未能提供相关信息,在未来的研究中需进一步完善。
总之,早产儿维生素D缺乏的发生率较高,冬春季出生、母亲年龄 < 30岁以及母亲早孕期BMI≥28 kg/m2为早产儿维生素D缺乏的危险因素,早产儿生后宜尽早开始维生素D补充,妊娠期妇女应提高补充维生素D的意识,以预防早产儿代谢性骨病、佝偻病的发生及改善远期预后。
| [1] | Theodoratou E, Tzoulaki I, Zgaga L, et al. Vitamin D and multiple health outcomes:umbrella review of systematic reviews and meta-analyses of observational studies and randomised trials[J]. BMJ, 2014, 348: g2035. DOI:10.1136/bmj.g2035 |
| [2] | Çetinkaya M, Çekmez F, Erener-Ercan T, et al. Maternal/neonatalvitamin Ddeficiency:a risk factor for bronchopulmonary dysplasia in preterms?[J]. J Perinatol, 2015, 35(10): 813–817. DOI:10.1038/jp.2015.88 |
| [3] | Dinlen N, Zenciroglu A, Beken S, et al. Association of vitamin D deficiency with acute lower respiratory tract infections in newborns[J]. J Matern Fetal Neonatal Med, 2016, 29(6): 928–932. DOI:10.3109/14767058.2015.1023710 |
| [4] | Bunyavanich S, Rifas-Shiman SL, Platts-Mills TA, et al. Prenatal, perinatal, and childhood vitamin D exposure and their association with childhood allergic rhinitis and allergic sensitization[J]. J Allergy Clin Immunol, 2016, 137(4): 1063–1070. DOI:10.1016/j.jaci.2015.11.031 |
| [5] | Chawes BL, Bønnelykke K, Jensen PF, et al. Cord blood 25(OH)-vitamin D defciency and childhood asthma, allergy and eczema:the COPSAC2000 birth cohort study[J]. PLoS One, 2014, 9(6): e99856. DOI:10.1371/journal.pone.0099856 |
| [6] | Crozier SR, Harvey NC, Inskip HM, et al. Maternal vitamin D status in pregnancy is associated with adiposity in the offspring:fndings from the Southampton Women's Survey[J]. Am J Clin Nutr, 2012, 96(1): 57–63. DOI:10.3945/ajcn.112.037473 |
| [7] | Mäkinen M, Mykkänen J, Koskinen M, et al. Serum 25-hydroxyvitamin D concentrations in children progressing to autoimmunity and clinical type 1 diabetes[J]. J Clin Endocrinol Metab, 2016, 101(2): 723–729. DOI:10.1210/jc.2015-3504 |
| [8] | Chen J, Xin K, Wei J, et al. Lower maternal serum 25(OH)D in frst trimester associated with higher autism risk in Chinese offspring[J]. J Psychosom Res, 2016, 89: 98–101. DOI:10.1016/j.jpsychores.2016.08.013 |
| [9] | Dalgård C, Petersen MS, Steuerwald U, et al. Umbilical cord serum 25-hydroxyvitamin D concentrations and relation to birthweight, head circumference and infant length at age 14 days[J]. Paediatr Perinat Epidemiol, 2016, 30(3): 238–245. DOI:10.1111/ppe.12288 |
| [10] | Filteau S, Rehman AM, Yousafzai A, et al. Associations of vitamin D status, bone health and anthropometry, with gross motor development and performance of school-aged Indian children who were born at term with low birth weight[J]. BMJ Open, 2016, 6(1): e009268. DOI:10.1136/bmjopen-2015-009268 |
| [11] | Strøm M, Halldorsson TI, Hansen S, et al. Vitamin D measured in maternal serum and offspring neurodevelopmental outcomes:a prospective study with long-term follow-up[J]. Ann Nutr Metab, 2014, 64(3-4): 254–261. DOI:10.1159/000365030 |
| [12] | Tergestina M, Jose A, Sridhar S, et al. Vitamin D status and adequacy of standard supplementation in preterm neonates from South India[J]. J Pediatr Gastroenterol Nutr, 2014, 58(5): 661–665. DOI:10.1097/MPG.0000000000000296 |
| [13] | Onwuneme C, Martin F, McCarthy R, et al. The association of vitamin D status with acute respiratory morbidity in preterm infants[J]. J Pediatr, 2015, 166(5): 1175–1180. DOI:10.1016/j.jpeds.2015.01.055 |
| [14] | Gallo S, Comeau K, Agellon S, et al. Methodological issues in assessing plasma 25-hydroxyvitamin D concentration in newborn infants[J]. Bone, 2014, 61: 186–190. DOI:10.1016/j.bone.2014.01.012 |
| [15] | Institute of Medicine (US) Committee, Ross AC, Taylor CL, et al. Dietary reference intakes for calcium and vitamin D[M]. Washington (DC): National Academies Press (US), 2011: 13-14. |
| [16] | Cashman KD, Dowling KG, Škrabáková Z, et al. Vitamin D deficiency in Europe:pandemic?[J]. Am J Clin Nutr, 2016, 103(4): 1033–1044. DOI:10.3945/ajcn.115.120873 |
| [17] | 张丽萍, 闫瑞霞, 孙玉敏, 等. 沧州市早产儿血清维生素D水平及其母亲认知情况调查分析[J]. 中国儿童保健杂志, 2013, 21(8): 870–872. |
| [18] | Yu X, Wang W, Wei Z, et al. Vitamin D status and related factors in newborns in Shanghai, China[J]. Nutrients, 2014, 6(12): 5600–5610. DOI:10.3390/nu6125600 |
| [19] | Xiao JP, Zang J, Pei JJ, et al. Low maternal vitamin D status during the second trimester of pregnancy:a cross-sectional study in Wuxi, China[J]. PLoS One, 2015, 10(2): e0117748. DOI:10.1371/journal.pone.0117748 |
| [20] | Tao M, Shao H, Gu J, et al. Vitamin D status of pregnant women in Shanghai, China[J]. J Matern Fetal Neonatal Med, 2012, 25(3): 237–239. DOI:10.3109/14767058.2011.569613 |
| [21] | El Koumi MA, Ali YF, Abd El Rahman RN. Impact of maternal vitamin D status during pregnancy on neonatal vitamin D status[J]. Turk J Pediatr, 2013, 55(4): 371–377. |
| [22] | Burris HH, Van Marter LJ, McElrath TF, et al. Vitamin D status among preterm and full-term infants at birth[J]. Pediatr Res, 2014, 75(1-1): 75–80. DOI:10.1038/pr.2013.174 |
| [23] | Josefson JL, Reisetter A, Scholtens DM, et al. Maternal BMI associations with maternal and cord blood vitamin D levels in a North American subset of hyperglycemia and adverse pregnancy outcome (HAPO) study participants[J]. PLoS One, 2016, 11(3): e0150221. DOI:10.1371/journal.pone.0150221 |
| [24] | Zhang MX, Pan GT, Guo JF, et al. Vitamin D deficiency increases the risk of gestational diabetes mellitus:a metaanalysis of observational studies[J]. Nutrients, 2015, 7(10): 8366–8375. DOI:10.3390/nu7105398 |
| [25] | Zhao X, Fang R, Yu R, et al. Maternal vitamin D status in the late second trimester and the risk of severe preeclampsia in Southeastern China[J]. Nutrients, 2017, 9(2): 138. DOI:10.3390/nu9020138 |
| [26] | 任惠琼, 黄小霞, 贾金平. 妊娠期肝内胆汁淤积症患者脐血中维生素D水平及维生素D受体的表达相关性研究[J]. 中国优生与遗传杂志, 2015, 23(6): 70–71. |
| [27] | Chen Y H, Yu Z, Fu L, et al. Vitamin D3 inhibits lipopolysaccharide-induced placental inflammation through reinforcing interaction between vitamin D receptor and nuclear factor kappa B p65 subunit[J]. Sci Rep, 2015, 5: 10871. DOI:10.1038/srep10871 |
| [28] | Pena HR, de Lima MC, Brandt KG, et al. Influence of preeclampsia and gestational obesity in maternal and newborn levels of vitamin D[J]. BMC Pregnancy Childbirth, 2015, 15: 112. DOI:10.1186/s12884-015-0547-7 |
| [29] | Mohaghegh Z, Abedi P, Dilgouni T, et al. The relation of preeclampsia and serum level of 25-hydroxyvitamin D in mothers and their neonates:a case control study in Iran[J]. Horm Metab Res, 2015, 47(4): 284–288. DOI:10.1055/s-00000025 |
 2017, Vol. 19
2017, Vol. 19