2. 出生缺陷防控关键技术国家工程实验室, 北京 100700;
3. 儿童器官功能衰竭北京市重点实验室, 北京 100700;
4. 军事医学科学院微生物和流行病学研究所病原微生物生物安全重点实验室, 北京 100071
早产是指妊娠不满37周的分娩,早产的病因和发病机制至今仍不明确,基于大量人和早产动物模型的研究结果,主要有以下4种途径可导致早产[1]:(1)婴儿或母亲的下丘脑-垂体-肾上腺轴的激活;(2)感染和炎症;(3)蜕膜出血;(4)子宫膨胀。其中,涉及母亲/婴儿的感染和炎症反应,如绒毛膜羊膜炎,则可导致50%以上的自发性早产(spontaneous preterm birth, SPTB)[2]。
炎症发生时在母体、婴儿以及胎盘组织中出现炎症性级联反应的活化,表现为巨噬细胞活化,产生大量的炎性细胞因子,主要是白细胞介素(interleukin, IL)和肿瘤坏死因子(tumor necrosis factor, TNF),这些细胞因子一方面可刺激羊膜、绒毛膜、底蜕膜和子宫肌层产生前列腺素类物质(prostaglandin, PG)、内皮素(endothelin, ET)和肾上腺皮质激素(adrenal cortical hormone, ACH),诱发宫缩,从而发动生产;另一方面还可以促进羊膜和宫颈细胞释放金属蛋白酶类(matrix metalloproteinases, MMP),使胎膜和子宫下段细胞外基质(extracellular matrix, ECM)发生降解,导致胎膜破裂、子宫组织结构松弛和宫颈成熟,从而诱发SPTB[3]。由此可见,调节炎症和免疫反应的炎症细胞因子、趋化因子、金属蛋白酶等炎症介质的变化与SPTB的发生密切相关,这些炎症介质基因的单核苷酸多态性(single nucleotide polymorphisms, SNP)均可以影响SPTB的发生风险。
IL-6是由免疫细胞和许多非免疫细胞产生的多效性细胞因子,可上调C-反应蛋白等急性时相反应蛋白的表达,促进巨噬细胞、B细胞和T细胞的活化和分化,在急性时相反应和炎症级联反应中发挥重要作用,还具有调节内分泌和代谢的作用[4]。有研究显示,无论是否有感染发生,在SPTB孕妇的宫颈、羊水和阴道分泌物中,IL-6的表达水平均显著增加,因而,IL-6被认为是发生SPTB的高危生物学标记物。而且,IL-6和IL-6R基因的SNP和羊水中IL-6的表达水平具有对应关系,并与SPTB的发生率有关[5]。我们认为IL-6基因启动子区域的C-572G多态性可能与SPTB的患病风险存在遗传学关联。本研究拟通过病例-对照研究,探讨IL-6 C-572G多态性位点与SPTB遗传易感性的关联性,为SPTB的早期预防和治疗提供有应用价值的遗传学标记。
1 资料与方法 1.1 研究对象2009年1月到2011年5月期间,从收治于陆军总医院附属八一儿童医院早产儿病房的新生儿中收集EDTA抗凝血样本。
(1)研究对象均为来自北京及其周边地区在遗传学上无关联的汉族人;排除胎儿畸形、宫内生长受限、胎儿窘迫、先兆子癎、结缔组织病、外伤、出血及任何可能需要进行引产的围产期并发症。其中病例组纳入标准为:单胎妊娠;胎龄 < 37周。病例组按照SPTB新生儿出生时胎龄的大小,分为3个亚组[6-7]:超早产组(胎龄 < 28周)、极早产组(胎龄28~31+6周)和中晚期早产组(胎龄32~36+6周)。对照组纳入标准为:孕妇无SPTB或早产胎膜早破(preterm rupture of membranes, PROM)病史;单胎妊娠;胎龄≥37周。
(2)PROM的诊断标准[8]:临床检查孕妇阴道有液体流出;阴道液酸碱度测定pH > 6.5;显微镜检查阴道液涂于玻片上观察到羊齿状结晶。
1.2 方法采用最新的Sequenom MassARRAY®SNP检测技术(博奥生物集团有限公司暨生物芯片北京国家工程研究中心)对IL-6基因的C-572G多态性位点进行SNP分型。
1.3 统计学分析采用SPSS 16.0软件包进行统计学处理与分析。采用Arlequin软件检验哈-温遗传平衡(Hardy-Weinberg equilibrium, HWE),确定研究对象的群体代表性。检验病例组和对照组基线资料的同质性时,计数资料采用χ2检验或Fisher精确检验;非正态分布的计量资料用中位数(四分位数间距)[P50(P25,P75)]表示,采用Mann-Whitney U检验。
在病例-对照人群中,候选基因每个SNP位点的等位基因和基因型频率通过记数确定,用频数和百分率[n(%)]表示。并在共显性、显性、隐性、超显性和加性5种遗传模式中进行分析。设A为SNP的高频率等位基因,B为低频率等位基因,则共显性模式以AA基因型为参考,分别进行AB vs AA和BB vs AA的比较;显性模式以AA基因型为参考,进行AB+BB vs AA的比较;隐性模式以AA+AB联合基因型为参考,进行BB vs AA+AB的比较;超显性模式以AA+BB联合基因型为参考,进行AB vs AA+BB的比较;加性模式将AA、AB和BB作为B等位递增的有序变量进行B等位剂量分析。采用χ2检验分析病例组和对照组在单个等位基因、基因型及遗传模式中的分布频率,通过logistic回归分析矫正母亲年龄和婴儿性别后,对每个基因的SNP位点与SPTB发生的关联性进行风险评估,用所得的比值比(OR)及其95%的置信区间(CI)表示风险强度。所有的统计检验均为双侧概率,P < 0.05被认为有统计学意义。
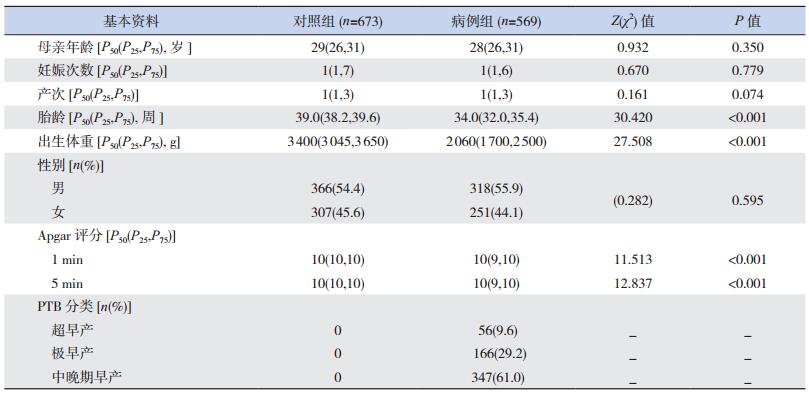
2 结果 2.1 流行病学资料病例组共纳入SPTB新生儿569例,其中超早产儿56例、极早产儿166例、中晚期早产儿347例;对照组共纳入673例足月儿。以病历和问卷等方法收集全部研究对象的流行病学资料,见表 1。
| 表 1 研究对象的流行病学资料 |
在母亲年龄、妊娠次数、产次和新生儿性别方面,病例组和对照组之间的差异无统计学意义,但在胎龄、出生体重、1 min及5 min Apgar评分方面,两组之间差异有统计学意义。
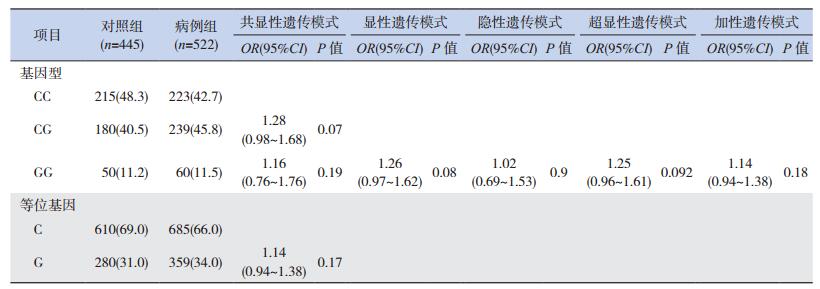
2.2 病例组与对照组IL-6 C-572G位点等位基因和基因型频率分布的比较除基因分型失败的样本外,对照组和病例组的实际样本量分别为445例和522例。病例组和对照组基因型分布均符合HWE遗传平衡定律(P > 0.05),具有良好的群体代表性。两组的IL-6 C-572G位点等位基因和基因型分布频率见表 2。在所有样本中,病例组与对照组的等位基因C、G的分布频率之间的差异无统计学意义(χ21.86,P=0.17),CC、CG、GG基因型构成比之间的差异也无统计学意义(χ23.25,P=0.20)。通过logistic回归分析校正母亲年龄和新生儿性别后,分析共显性(CG vs CC,GG vs CC)、显性(CG+GG vs CC)、隐性(GG vs CC+CG)、超显性(CG vs CC+GG)和加性(G等位基因递增)5种遗传模式,发现IL-6 C-572G位点与SPTB的遗传易感性不相关(P > 0.05)。
| 表 2 病例组和对照组IL-6 C-572G等位基因和基因型频率[n(%)] |
2.3 3个SPTB亚组与对照组IL-6 C-572G位点等位基因和基因型频率分布的比较
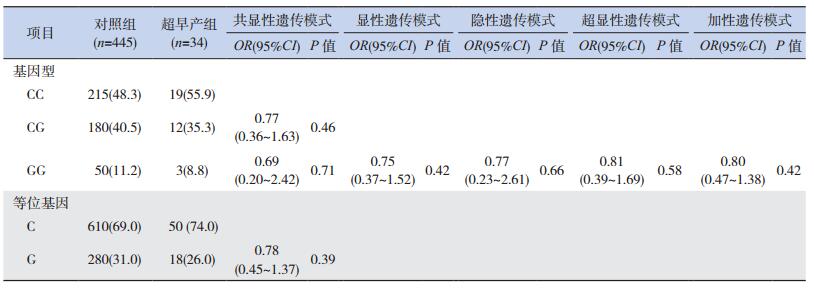
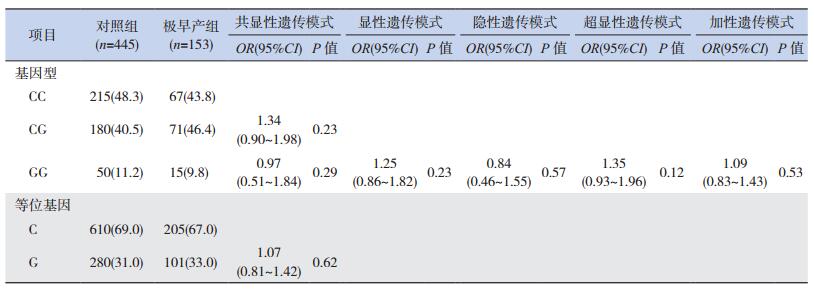
不同胎龄的3个亚组(超早产组、极早产组、中晚期早产组)分别与对照组比较,超早产组和极早产组与对照组的等位基因C、G分布频率和CC、CG、GG基因型构成比之间的差异均无统计学意义(P > 0.05)。通过logistic回归分析校正母亲年龄和新生儿性别后,分析共显性(CG vs CC,GG vs CC)、显性(CG+GG vs CC)、隐性(GG vs CC+CG)、超显性(CG vs CC+GG)和加性(G等位基因递增)5种遗传模式,发现IL-6 C-572G位点与超早产和极早产的遗传易感性均不相关(P > 0.05),见表 3~4。
| 表 3 超早产组和对照组IL-6 C-572G等位基因和基因型频率[n(%)] |
| 表 4 极早产组和对照组IL-6 C-572G等位基因和基因型频率[n(%)] |
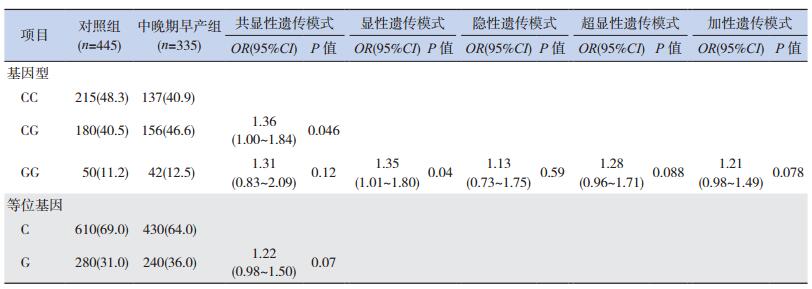
中晚期早产组与对照组比较,等位基因C、G分布频率和CC、CG、GG基因型构成比之间的差异均无统计学意义(P > 0.05)。通过logistic回归分析校正母亲年龄和新生儿性别后,分析共显性(CG vs CC,GG vs CC)遗传模式,相对于CC基因型,CG基因型与中晚期早产的遗传易感性有相关性(OR=1.36,95%CI:1.00~1.84,P=0.046);分析显性(CG+GG vs CC)遗传模式,发现相对于CC基因型,G等位基因型(CG+GG基因型)与发生中晚期早产的风险升高相关(OR=1.35,95%CI:1.01~1.80,P=0.04);分析隐性(GG vs CC+CG)遗传模式,发现相对于C等位基因型(CC+CG基因型),GG基因型与中晚期早产的遗传易感性不相关(OR=1.13,95%CI:0.73~1.75,P=0.59);分析超显性(CG vs CC+GG)遗传模式,相对于CC+GG基因型,CG基因型与中晚期早产的遗传易感性不相关(OR=1.28,95%CI:0.96~1.71,P = 0.088);用加性模式进行G等位剂量分析,发现G等位基因递增与中晚期早产的遗传易感性不相关(OR=1.21,95%CI:0.98~1.49,P=0.078),见表 5。
| 表 5 中晚期早产组和对照组IL-6 C-572G等位基因和基因型频率[n(%)] |
3 讨论
本研究探讨了IL-6基因C-572G(rs1800796)多态性位点与SPTB遗传易感性之间的关联性。在所有样本中,病例组和对照组之间IL-6 C-572G位点的等位基因C、G分布频率和CC、CG、GG基因型的构成比均相似,说明此多态性位点与SPTB的患病风险无显著的遗传学关联。进一步根据出生胎龄的不同将病例组分成3个SPTB亚组,分别与对照组比较,发现携带-572G等位型(CG+GG)个体发生中晚期早产的风险升高。
IL-6是在炎症反应中起关键性作用的多效性炎症细胞因子,通过与其跨膜受体IL-6R结合后,使信号转换糖蛋白gp130发生同源二聚化,触发细胞内复杂的级联反应,导致在炎症反应中起重要作用的基因转录增加[9]。当炎症、感染、创伤和精神紧张时,由于IL-1、TNF、脂多糖和Toll样受体(toll-like receptors, TLR)配体的刺激,可诱导IL-6的表达[10]。IL-6表达水平的升高与类风湿性关节炎、慢性炎症增殖性疾病、系统性红斑狼疮等多种炎症和免疫性疾病的发生有关[11]。
感染和炎症是导致SPTB发生最重要的风险因素[12]。当发生绒毛膜羊膜炎或宫内感染时,细菌及其内毒素在最初的免疫应答中,诱导子宫肌层、蜕膜、羊膜以及巨噬细胞产生IL、TNF,IL和TNF再刺激蜕膜和绒毛膜释放IL-6,而IL-6进一步通过正反馈机制,使胎盘分泌的前列腺素和内皮素大量增加,进而引起子宫收缩,导致SPTB的发生[2]。正常妊娠时,IL-6的表达水平很低,IL-6表达水平的增加与多种病理性妊娠相关,如不明原因的不孕、习惯性流产、子癎和SPTB,特别是与SPTB的发生密切相关[13]。
IL-6基因位于7P21,IL-6 C-572G多态性位点位于启动子5' 侧翼区,研究显示,相对于-572CC基因型,-572G等位基因型(CG+GG)与血清中更高水平IL-6的表达有关[14]。在本组研究人群中,携带-572G等位基因型(CG+GG)者发生中晚期早产的风险升高,鉴于IL-6具有终止妊娠的作用,携带-572G等位基因型的个体由于表达更多的IL-6,因此导致中晚期早产的发生风险增加。最近,在检测与早产相关的多种生物学标记物时发现,IL-6表达水平的增高与 < 35周的SPTB以及绒毛膜羊膜炎引起的SPTB密切相关,说明IL-6的表达水平与早产儿的胎龄相关[15]。本研究发现IL-6 C-572G多态性与中晚期SPTB的风险升高显著相关,而与超早产和极早产的发生风险无显著的遗传学关联,提示IL-6基因的SNP与SPTB遗传易感性之间的关联性也受早产儿出生胎龄的影响。
SPTB属于多基因调控的具有复杂性状的疾病,易感基因之间、易感基因的SNP位点之间甚至环境因素和易感基因的SNP位点之间的相互作用均可以影响SPTB的发生风险。本研究仅单独探讨IL-6 C-572G多态性位点与SPTB遗传易感性的关系虽然具有一定的局限性,但是,-572G等位基因型(CG+GG基因型)的携带者发生中晚期早产的风险是CC基因型携带者的1.35倍,这一点可以帮助筛选发生中晚期早产的高危人群。在下一步的研究中,可以探讨IL-6基因的多个SNP位点与血清中IL-6的表达水平以及SPTB的遗传易感性之间的对应关系,这样对于进一步阐明IL-6的生物学功能、SPTB的发生机制以及IL-6 C-572G这一多态性位点作为预防SPTB发生候选位点的价值具有重要意义。
| [1] | Ryckman KK, Morken NH, White MJ, et al. Maternal and fetal genetic associations of PTGER3 and PON1 with preterm birth[J]. PLoS One, 2010, 5(2): e9040. DOI:10.1371/journal.pone.0009040 |
| [2] | Hollegaard MV, Grove J, Thorsen P, et al. Polymorphisms in the tumor necrosis factor alpha and interleukin 1-beta promoters with possible gene regulatory functions increase the risk of preterm birth[J]. Acta Obstet Gynecol Scand, 2008, 87(12): 1285–1290. DOI:10.1080/00016340802468340 |
| [3] | Gomez-Lopez N, Laresgoiti-Servitje E, Olson DM, et al. The role of chemokines in term and premature rupture of the fetal membranes:a review[J]. Biol Reprod, 2010, 82(5): 809–814. DOI:10.1095/biolreprod.109.080432 |
| [4] | Sun GQ, Wu GD, Meng Y, et al. IL-6 gene promoter polymorphisms and risk of coronary artery disease in a Chinese population[J]. Genet Mol Res, 2014, 13(3): 7718–7724. DOI:10.4238/2014.September.26.9 |
| [5] | Velez DR, Fortunato SJ, Williams SM, et al. Interleukin-6(IL-6) and receptor (IL6-R) gene haplotypes associate with amniotic fluid protein concentrations in preterm birth[J]. Hum Mol Genet, 2008, 17(11): 1619–1630. DOI:10.1093/hmg/ddn049 |
| [6] | World Health Orgnization. Preterm birth[EB/OL]. (November 2016). http://www.who.int/mediacentre/factsheets/fs363/en/. |
| [7] | 尹晓娟, 封志纯. 中晚期早产儿新生儿期风险[J]. 中国新生儿科杂志, 2016, 31(5): 395–397. |
| [8] | 中华医学会妇产科学分会产科学组. 胎膜早破的诊断与处理指南(2015)[J]. 中华妇产科杂志, 2015, 50(1): 3–8. |
| [9] | Lee SY, Buhimschi IA, Dulay AT, et al. IL-6 trans-signaling system in intra-amniotic inflammation, preterm birth, and preterm premature rupture of the membranes[J]. J Immunol, 2011, 186(5): 3226–3236. DOI:10.4049/jimmunol.1003587 |
| [10] | Naugler WE, Karin M. The wolf in sheep's clothing:the role of interleukin-6 in immunity, inflammation and cancer[J]. Trends Mol Med, 2008, 14(3): 109–119. DOI:10.1016/j.molmed.2007.12.007 |
| [11] | Yao J, Feng XW, Yu XB, et al. Recipient IL-6-572C/G genotype is associated with reduced incidence of acute rejection following liver transplantation[J]. J Int Med Res, 2013, 41(2): 356–364. DOI:10.1177/0300060513477264 |
| [12] | Goldenberg RL, Culhane JF, Iams JD, et al. Epidemiology and causes of preterm birth[J]. Lancet, 2008, 371(9606): 75–84. DOI:10.1016/S0140-6736(08)60074-4 |
| [13] | Prins JR, Gomez-Lopez N, Robertson SA. Interleukin-6 in pregnancy and gestational disorders[J]. J Reprod Immunol, 2012, 95(1-2): 1–14. DOI:10.1016/j.jri.2012.05.004 |
| [14] | Zhao N, Liu HJ, Sun YY, et al. Role of interleukin-6 polymorphisms in the development of allergic rhinitis[J]. Genet Mol Res, 2016, 15(1): 14–17. |
| [15] | Taylor BD, Holzman CB, Fichorova RN, et al. Inflammation biomarkers in vaginal fluid and preterm delivery[J]. Hum Reprod, 2013, 28(4): 942–952. DOI:10.1093/humrep/det019 |
 2017, Vol. 19
2017, Vol. 19