患儿,女,10岁,因发现高血压伴间断抽搐1个月入院。入院前1个月患者突发头痛,伴呕吐及视物模糊,以后出现抽搐:表现为双目凝视、口角抽动、面色青紫、肢体强直、抽动,持续3~4 min,缓解后思睡,醒后精神好,当地医院发现血压增高:收缩压大于200 mm Hg(具体欠详),予降压治疗后血压正常,出院后未再继续服药及监测血压。入院前半天再发抽搐,表现同前,测血压仍高。病程中无尿色改变,无浮肿及尿少,无反复盗汗,近来体重无明显下降。
患儿半年前发现颈部包块(具体不详),有触痛,局部无红、热,予中草药外敷,包块无进行性增大。否认结核接触史。出生史无特殊,智力、运动发育正常。家族中无遗传病史及类似病史。
入院体查:血压140/100 mm Hg,体重27 kg,神志清楚,右侧锁骨上扪及约2 cm×3 cm大小包块、质硬、局部无红热、活动差,伴触痛。心、肺、腹部、神经系统体查无异常(-)。
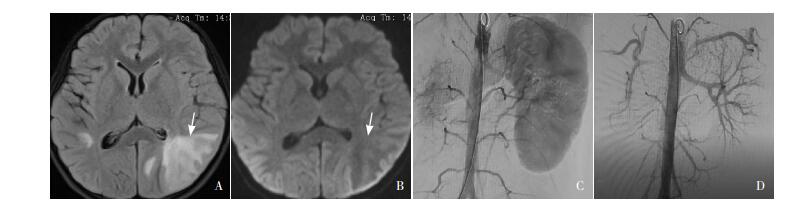
实验室检查:血常规及大便常规正常;尿常规(2次):尿蛋白+++,镜检阴性。肝肾功能、电解质正常,C-反应蛋白(CRP)23 mg/L(参考值:< 8.2 mg/L)。免疫球蛋白及血补体C3、抗链球菌溶血素(ASO)正常。血沉91 mm/h(参考值0~15 mm/h)。乙肝五项阴性。结核菌素试验(PPD)++;结核菌素斑点试验(T-SPOT)阳性。抗中性粒细胞胞浆抗体(ANCA)阴性;抗核抗体及抗核抗体谱阴性;抗环瓜氨酸肽抗体阴性;类风湿因子阴性。血乳酸3.6 mmol/L(参考值:< 2.01 mmol/L),复查正常;同型半胱氨酸及血氨正常;甲状腺功能正常;醛固酮立卧位试验阴性。双肾上腺B超无异常;肾脏彩超:左肾大小正常,右肾相对缩小(左肾111 mm×42 mm,右肾72 mm×30 mm),左肾皮质回声增强。头部MRI(图 1A、1B):左侧后头部为主(顶枕叶为著)及皮层、皮层下白质长T1、长T2信号,液体衰减反转恢复序列(fluid-attenuated inversion recovery, FLAIR)高信号, 弥散加权相(diffusion-weighted image, DWI)等信号。胸部CT:右肺下叶小结节,纵膈淋巴结增多;全腹平扫+增强CT:左肾较大,右肾较小。
|
图 1 患儿头部MRI及肾脏ECT特征 A:左侧枕叶皮层下白质为主的FLAIR高信号(箭头所示);B:左侧枕叶皮层下白质DWI等信号(箭头所示);C、D:肾ECT示右肾体积小,右肾血管分布少,右肾无血流灌注。 |
2 诊断思维
入院后监测收缩压和舒张压,均大于同性别、年龄和身高儿童血压的第95百分位,高血压诊断明确;患儿有2次惊厥发作,无中枢神经系统阳性体征,结合头颅影像学特征性累及后头部以及FLAIR高信号、DWI等信号,考虑可逆性后部白质脑病综合征(posterior reversible leukoencephalopathy syndrome, PRES)。高血压病因不明确,儿童高血压病因多为继发性,但患儿肾脏B超、CT未见占位性病变,醛固酮立、卧位试验均阴性,可排除常见的继发性高血压如嗜铬细胞瘤、原发性醛固醇增多症。辅助检查提示蛋白尿及一侧肾脏缩小,需考虑肾实质性或肾血管性高血压,如肾实质性病变、获得性血管病变、先天性血管畸形等。患者无浮肿、尿少病史,补体C3正常、抗核抗体及抗核抗体谱均阴性,而且一侧肾脏缩小,不支持急性肾小球肾炎、狼疮性肾炎。患者居于贵州,颈部包块半年,肺部有结节样改变,且PPD++,T-SPOT阳性,贵州地区为结核高发区,因此不能除外结核累及肾脏导致的高血压,行颈部包块活检有助诊断。患儿血压增高、尿蛋白阳性、血沉明显增快、CRP增高,还需要注意血管炎性疾病,如儿童常见的川崎病、过敏性紫癜等,但患者病程中无发热、皮疹、粘膜异常及淋巴结肿大,而且病程长、起病年龄较大,不符合川崎病特点;患儿无过敏性紫癜的典型皮疹、腹痛及关节肿痛,因此需注意其他少见的系统性血管炎累及肾脏的可能,进一步行肾发射型计算机断层扫描(ECT)以了解肾血管及灌注情况。
3 进一步检查(1)肾脏ECT:左肾血流灌注及功能正常,右肾多发血管狭窄、僵直,右肾无明显血流灌注,呈无功能肾表现,见图 1C、D。
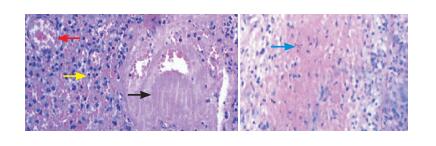
(2)颈部包块病理(图 2):组织中见血管增生、大量淋巴细胞及少量嗜酸细胞浸润,血管周围见大量炎性反应,有血栓形成及纤维素样坏死,考虑结节性多动脉炎(polyarteritis nodosa, PAN)。
|
图 2 颈部包块病理(HE染色) A(10×20):小动脉增生(红色箭头所示)、血管周围淋巴细胞浸润(黄色箭头所示)及血栓形成(黑色箭头所示);B(10×10):纤维素样坏死(蓝色箭头所示)。 |
4 诊断及确诊依据
患者血压高,伴抽搐,神经系统检查阴性,以及头颅影像学特征性累及后头部、FLAIR高信号、DWI等信号,PRES诊断成立。高血压考虑PAN所致,依据:(1)学龄期患者,高血压伴蛋白尿,右侧肾脏萎缩,无肾小球肾炎、泌尿系感染及其他特异性血管炎依据;(2)肾血管影像提示右肾多发血管狭窄,无血流灌注,符合儿童PAN的诊断标准;(3)颈部包块病理提示结节性多动脉炎。
5 临床经过患者以高血压为主要表现,伴多系统受损,结合病理结果,符合PAN诊断。患者右肾处于无功能状态,建议手术切除右肾,家属拒绝。予口服降压药同时加用醋酸泼尼松治疗(每天1.5 mg/kg),血压控制可,出院后复查头颅MRI正常。随访1年,患者血压控制好,正常生活。
6 讨论PAN在1852年由Karl Rokitansky首先报道,早期泛指大多数血管炎;1993年Chapel Hill会议将其定义为仅累及中小动脉的坏死性炎症,不伴肾小球肾炎,无微小动脉、毛细血管或微小静脉受累[1]。随着研究深入,越来越多的特异性血管炎被划分出来,2012年Chapel Hill会议重新定义PAN为累及中小动脉的坏死性血管炎(病理或影像学证实),ANCA阴性,除外川崎病、肾小球肾炎,不累及微小动脉、毛细血管或微小静脉[2]。目前PAN发病率不详,发病高峰在50~60岁,无性别差异,儿童病例罕见。PAN临床异质性强,多系统受累,皮肤及肾脏是容易受累的器官:国外研究显示,72%的患者表现为肌痛,69%的患者皮肤受累,44%的患者有高血压,周围神经病变的发生率为26%[3];北京协和医院的资料显示,PAN最常受累的是皮肤(79%)、肾脏(68%),其次是周围神经(34%)[4]。
PAN发病机制不详,原发性及继发性因素均可导致PAN,多为散发病例。也有报道发现腺苷脱氨酶2基因(adenosine deaminase 2, ADA2)突变与该病相关,呈常染色体隐性遗传[5]。继发性因素常与乙型或丙型肝炎病毒感染相关[6-7]。
PAN诊断主要依赖病理组织活检或血管成像,儿童PAN诊断参照欧洲抗风湿病协会/儿童风湿病欧洲协会标准[8-9]:影像或病理证实中小动脉的坏死性炎症(必备),并且符合下列五项之一:① 皮肤受累;② 肌痛或肌无力;③ 高血压;④ 周围神经病变:表现为肢体无力,麻木等;⑤ 肾脏受累:多累及肾血管导致肾梗死、高血压及肾衰竭,轻者仅尿检异常:尿白尿和/或血尿。该诊断标准灵敏度89.6%,特异度99.6%。本文患者病理提示小动脉纤维素样坏死,伴皮肤及肾脏受累,符合PAN的诊断。
糖皮质激素是PAN的一线治疗药物,通过早期规律治疗,一般能获得较好的预后[10-14]。吗替麦考酚酯在激素效果差时通常能获得良好效果,可作为二线药物。有个案研究显示利妥昔单抗可用于一、二线药物治疗效果差的患者,但安全性及有效均有待进一步研究证实[14-15]。
7 结语PAN是儿童少见的系统性血管炎之一,起病方式多样,临床表现复杂,临床诊治中需予以足够重视,对于存在高血压及多系统受累表现,炎性指标增高的儿童在排除儿童常见的血管炎如川崎病及过敏性紫癜后需考虑PAN可能,应尽早行组织病理活检或血管成像检查,争取早期诊断及早治疗,改善患者预后。
| [1] | Howard T, Ahmad K, Swanson J, et al. Polyarteritis nodosa[J]. Tech Vasc Interv Radiol, 2014, 17(4): 247–251. DOI:10.1053/j.tvir.2014.11.005 |
| [2] | Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides[J]. Arthritis Rheum, 2013, 65(1): 1–11. DOI:10.1002/art.37715 |
| [3] | Mao Y, Yin L, Xia H, et al. Incidence and clinical features of paediatric vasculitis in Eastern China:14-year retrospective study, 1999-2013[J]. J Int Med Res, 2016, 44(3): 710–717. DOI:10.1177/0300060515621446 |
| [4] | 中华医学会风湿病学分会. 结节性多动脉炎诊断和治疗指南[J]. 中华风湿病学杂志, 2011, 3(15): 192–194. |
| [5] | Navon EP, Pierce SB, Segel R, et al. Mutant adenosine deaminase 2 in a polyarteritis nodosa vasculopathy[J]. N Engl J Med, 2014, 370(10): 921–931. DOI:10.1056/NEJMoa1307362 |
| [6] | Matteoda MA, Stefano PC, Bocian M, et al. Cutaneous polyarteritis nodosa[J]. An Bras Dermatol, 2015, 90(3 Suppl 1): 188–190. DOI:10.1590/abd1806-4841.20153856 |
| [7] | 黄灿辉, 陶怡. 结节性多动脉炎的诊治进展[J]. 临床内科杂志, 2014, 10(31): 664–667. |
| [8] | Ruperto N, Ozen S, Pistorio A, et al. EULAR/PRINTO/PRES criteria for Henoch-Schönlein purpura, childhood polyarteritis nodosa, childhood Wegener granulomatosis and childhood Takayasu arteritis:Ankara 2008[J]. Ann Rheum Dis, 2010, 69(5): 790–797. DOI:10.1136/ard.2009.116624 |
| [9] | Ozen S, Pistorio A, Iusan SM, et al. EULAR/PRINTO/PRES criteria for Henoch-Schönlein purpura, childhood polyarteritis nodosa, childhood Wegener granulomatosis and childhood Takayasu arteritis:Ankara 2008[J]. Ann Rheum Dis, 2010, 69(5): 798–806. DOI:10.1136/ard.2009.116657 |
| [10] | Merlin E, Mouy R, Pereira B, et al. Long-term outcome of children with pediatric-onset cutaneous and visceral polyarteritis nodosa[J]. Joint Bone Spine, 2015, 82(4): 251–257. DOI:10.1016/j.jbspin.2015.01.007 |
| [11] | Bas A, Samanci C, Numan F. Percutaneous transcatheter embolization of gastrointestinal bleeding in a child with polyarteritis nodosa[J]. Pol J Radiol, 2014, 79: 465–466. DOI:10.12659/PJR.892038 |
| [12] | Hampson LV, Whitehead J, Eleftheriou D, et al. Elicitation of expert prior opinion:application to the MYPAN trial in childhood polyarteritis nodosa[J]. PLoS One, 2015, 10(3). |
| [13] | Eleftheriou D, Brogan PA. Therapeutic advances in the treatment of vasculitis[J]. Pediatr Rheumatol Online J, 2016, 14(1): 26. DOI:10.1186/s12969-016-0082-8 |
| [14] | Iudici M, Puechal X, Pagnoux C, et al. Brief report:Childhoodonset systemic necrotizing vasculitides:Long-term data from the French Vasculitis Study Group Registry[J]. Arthritis Rheumatol, 2015, 67(7): 1959–1965. DOI:10.1002/art.39122 |
 2017, Vol. 19
2017, Vol. 19


