肺炎支原体(Mycoplasma pneumoniae, MP)是一种可导致呼吸道感染的病原体,引起上呼吸道感染、气管炎、社区获得性肺炎、慢性阻塞性肺疾病(COPD)等疾病,影响支气管哮喘发作[1]。部分患儿在感染MP后甚至出现全身性临床表现,如脑炎、心包炎、Crohn's病等[2]。机体在抵御病原微生物感染过程中伴随着黏液的分泌,然而气道黏液过度分泌则可加重哮喘、COPD等疾病的病情。黏蛋白(mucin, MUC)5AC和MUC5B是黏液的重要组成部分,MP感染能够诱导气道上皮细胞MUC5AC和MUC5B的表达与分泌[3-4],然而具体作用机制有待研究阐明。表皮生长因子受体(epidermal growth factor receptor, EGFR)是一种酪氨酸激酶受体,其介导的信号转导在MP感染中具有重要作用[3]。膜联蛋白A2(annexin A2, AnxA2)是一种Ca2+依赖的磷脂结合蛋白,可调控EGFR信号转导及内吞作用,参与EGFR下游基因的活化[5]。EGFR信号在细胞内转导常常导致信号分子核因子κB(nuclear factor-κB,NF-κB)的活化,而NF-κB则介导细胞促炎因子和黏蛋白的表达[6-7]。因此本研究以MP为研究对象,探索AnxA2在MP抗原处理人气道上皮细胞后诱导MUC分泌的作用机制。
1 材料与方法 1.1 实验材料气道上皮细胞NCI-H292购自美国典型菌种保藏中心(ATCC),RPMI-1640培养基购自美国Invitrogen公司,MP购自首都儿科研究所,PPLO培养基购自青岛日水生物技术有限公司,Hanks平衡液、蛋白浓度测定试剂盒购自美国Sigma公司,十二烷基硫酸钠(SDS)、丙烯酰胺、PVDF膜购自江苏碧云天生物技术有限公司,BamⅠ、HindⅢ内切酶、LipofectamineTM 2000购自美国Thermo Fisher公司,pAVU6+27载体购自北京普如汀生物技术有限公司,MUC5AC、MUC5B试剂盒购自上海酶联生物科技有限公司,SYBR Premix Ex TaqⅡ试剂购自大连宝生物工程有限公司,AnxA2抗体、p65 NF-κB抗体、p-p65 NF-κB抗体、EGFR抗体、p-EGFR抗体、β-actin辣根过氧化物酶标记的二抗购自美国Abcam公司。
1.2 气道上皮细胞培养将人气道上皮细胞NCI-H292培养于含有10% FBS的RPMI-1640培养基中,培养基中同时加入100 U/mL青霉素和100 μg/mL链霉素,置于5%、37℃恒温培养箱中培养。
1.3 MP抗原分离将MP接种于配制好的含20%马血清的PPLO培养基中,并置于5%、37℃恒温培养箱中培养。MP生长至对数期时,收集培养物并加入Hanks平衡液,14 000 r/min离心20 min,重复操作2次。收集离心后沉淀物置于超声仪中超声6~8次,超声时间持续1 min。将超声后的产物以14 000 r/min离心5 min,离心结束后取上清并弃沉淀,蛋白浓度测定试剂盒测定MP抗原浓度。
1.4 细胞分组处理收集生长至对数期H292细胞悬液,细胞计数后接种于96孔板中,每孔细胞约5×104个。将细胞随机分为对照组、MP组、NC-siRNA+MP组和AnxA2 siRNA+MP组,每组10个复孔。对照组细胞利用PBS溶液处理,MP组细胞利用5μg/mL MP抗原刺激2 h,NC-siRNA+MP组和AnxA2 siRNA+MP组细胞分别转染NC-siRNA和AnxA2 siRNA 24 h后用MP抗原刺激2 h。
1.5 siRNA转染由AnxA2的基因序列(NC_000015.10)设计出含有BamⅠ和HindⅢ酶切位点的siRNA引物序列,上游引物:5'-GATCCGACA-GAGTTCCTAAGCTTCTTCAAGACGGAAGCTTA-GGAACTCTGTCTTTTTTGTCGACA-3',下游引物:3'-GCTGTCTCAAGGATTCGAAGAAGTTCTGCCTTC-GAATCCTTGAGACAGAAAAAACAGCTGTTCGA-5',片段长度65 bp,序列由上海生工生物工程股份有限公司合成。将扩增产物克隆到shRNA质粒pAVU6+27中,测序、鉴定重组质粒。将H292细胞接种到24孔培养板中,取5 μL LipofectamineTM 2000稀释到250 μL减血清MEM培养基中,加入细胞培养孔,轻轻混匀,室温孵育5 min;每孔再加入8 μL siRNA,室温孵育20 min。取50 μL siRNA-Lipofectamine复合物加入到细胞培养孔中,轻轻摇动混匀,37℃、5% CO2条件下培养。
1.6 细胞活性检测各组细胞分别在转染后1、2、3、4 d弃去上清液,PBS清洗,每孔加入MTT 100 μL(终浓度为0.15 mg/mL),置于37℃、5%CO2培养箱内继续孵育4~6 h,加入10%十二烷基硫酸钠与50%异丙醇(100 μL/孔)助溶。37℃、5%CO2放置过夜后于全自动酶标仪490 nm波长处测定OD值。实验独立重复3次,取平均数作为实验结果。
1.7 实时荧光定量PCR分析使用RNA提取试剂盒提取H292细胞中总RNA,将其反转录成cDNA后作为模板扩增基因片段。AnxA2上游引物:5'-CCAGAACCAACCAGGAGC-3',下游引物:5'-CTTGCGGAAGTCACCAGA-3'。PCR扩增体系(20 μL):上、下游引物各0.5 μL,SYBR Premix Ex TaqⅡ 10 μL,模板2 μL,ddH2O 7 μL。反应条件:95℃ 2 min;94℃ 20 s,60℃ 20 s,40个循环,溶解曲线温度65~95℃。扩增产物经琼脂糖凝胶电泳后染色、拍照。目的基因和β-actin基因的拷贝数分别根据产生的Ct值从各自的标准曲线获得,用目的基因的拷贝数除以β-actin的拷贝数作为靶基因的相对表达量。实验独立重复3次,取平均数作为实验结果。
1.8 MUC分泌检测H292细胞分组处理后经反复冻融、裂解细胞。将裂解物经1 000 r/min离心5 min,弃沉淀,采用双抗体夹心酶联免疫吸附试验(ELISA)法检测上清中MUC5AC和MUC5B的含量。实验严格按照试剂盒提供的操作步骤进行,实验独立重复3次。
1.9 Western blot检测蛋白表达收集各组H292细胞,利用RIPA裂解缓冲液裂解细胞并提取细胞总蛋白。在常温下用12%的SDS-聚丙烯酰胺凝胶恒压电泳分离蛋白,半干法将分离后的蛋白转移至PVDF膜上,用含5%脱脂奶粉的TBST室温下水平摇床慢摇封闭1 h。封闭结束后,用一抗AnxA2抗体(稀释度1 : 300)、p65 NF-κB抗体(稀释度1 : 500)、p-p65 NF-κB抗体(稀释度1 : 500)、EGFR抗体(稀释度1 : 500)、p-EGFR抗体(稀释度1 : 500)在4℃环境中孵育过夜。一抗孵育结束,漂洗,随后用辣根过氧化物酶标记的二抗(稀释度1 : 10 000)室温下孵育1 h。利用ECL显色试剂盒显色,暗室环境负片成像,以β-actin为内参进行定量分析,Image J软件分析各条带光密度值。结果以目的条带光密度值/β-actin光密度值计算相对表达量。实验独立重复3次。
1.10 统计学分析采用SPSS 13.0统计软件对数据进行统计学分析。计量资料采用均数±标准差(x±s)表示,多组均数的比较采用单因素方差分析,组间两两比较采用SNK-q法,P < 0.05为差异有统计学意义。
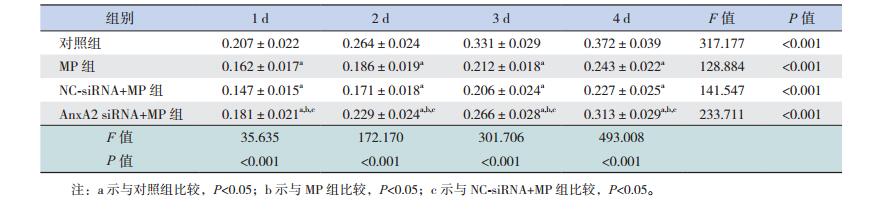
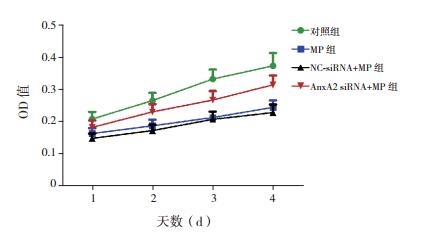
2 结果 2.1 AnxA2 siRNA转染对H292细胞存活的影响与对照组比较,MP组和NC-siRNA+MP组细胞活性明显降低(P < 0.05),AnxA2 siRNA+MP组细胞活性均高于MP组和NC-siRNA+MP组,但仍低于对照组(P < 0.05),NC-siRNA+MP组细胞活性与MP组比较差异无统计学意义(P > 0.05),见图 1,表 1。
|
图 1 MTT法检测各组H292细胞活性(n=3) |
| 表 1 各组H292细胞活性比较(x±s,n=3) |
2.2 AnxA2 siRNA转染对H292细胞中AnxA2表达的影响
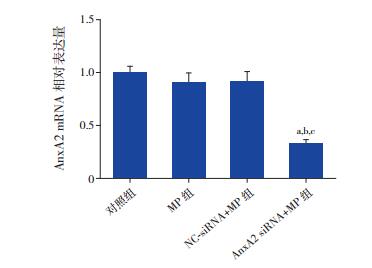
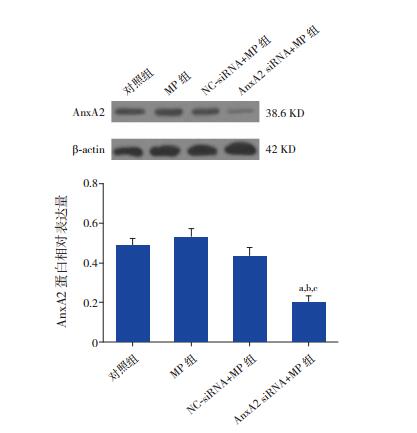
AnxA2 siRNA+MP组AnxA2 mRNA及蛋白水平明显低于对照组、MP组和NC-siRNA+MP组(P < 0.05),对照组、MP组和NC-siRNA+MP组AnxA2 mRNA及蛋白水平组间两两比较差异均无统计学意义(P > 0.05),见图 2~3。
|
图 2 实时荧光定量PCR检测各组H292细胞AnxA2 mRNA表达(n=3) a示与对照组比较,P<0.05;b示与MP组比较,P<0.05;c示与NC-siRNA+MP组比较,P<0.05。 |
|
图 3 Western blot检测各组H292细胞AnxA2蛋白表达 上图为蛋白电泳条带图,下图为统计图(n=3)。a示与对照组比较,P<0.05;b示与MP组比较,P<0.05;c示与NCsiRNA+MP组比较,P<0.05。 |
2.3 AnxA2 siRNA转染对H292细胞EGFR/NF-κB信号的影响
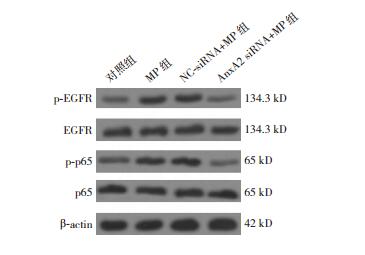
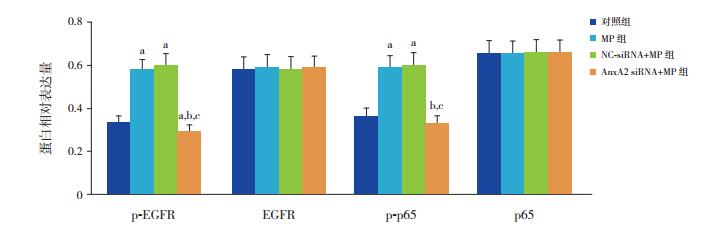
MP组与NC-siRNA+MP组细胞中p-EGFR和p-p65 NF-κB的表达水平比较差异均无统计学意义(P > 0.05),但均高于对照组(P < 0.05);AnxA2 siRNA+MP组细胞中p-EGFR和p-p65 NF-κB的表达水平低于MP组和NC-siRNA+MP组(P < 0.05);各组细胞中EGFR和p65 NF-κB表达水平比较差异均无统计学意义(P > 0.05)。见图 4~5。
|
图 4 Western blot检测各组H292细胞p-EGFR和p-p65 NF-κB蛋白表达电泳图 |
|
图 5 Western blot检测各组H292细胞p-EGFR和p-p65 NF-κB蛋白表达统计图(n=3) a示与对照组比较,P<0.05;b示与MP组比较,P<0.05;c示与NC-siRNA+MP组比较,P<0.05。 |
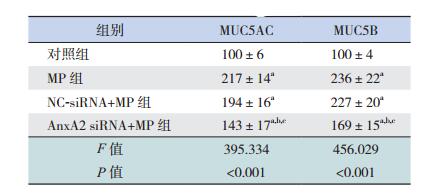
2.4 AnxA2 siRNA转染对H292细胞MUC5AC和MUC5B表达的影响
MP组和NC-siRNA+MP组细胞中MUC5AC和MUC5B蛋白表达水平均显著高于对照组(P < 0.05);AnxA2 siRNA+MP组细胞中MUC5AC和MUC5B蛋白的表达则明显低于MP组和NC-siRNA+MP组,但仍高于对照组(P < 0.05);MP组和NC-siRNA+MP组细胞中MUC5AC和MUC5B蛋白表达水平比较差异均无统计学意义(P > 0.05)。见表 2。
| 表 2 各组H292细胞MUC5AC和MUC5B蛋白表达比较(x±s,%,n=3) |
3 讨论
作为一种膜结合蛋白,AnxA2广泛参与膜转运及膜表面一系列依赖于钙调蛋白的活动,包括胞吐作用中的膜融合、囊泡运输、细胞黏附、细胞增殖、凋亡、复制、信号转导以及离子通道的形成[8]。目前,AnxA2在气道上皮细胞中作用已被越来越多的研究报道。Patchell等[9]发现气道上皮细胞受到机械损伤后,AnxA2的表达上升并发生糖基化,参与细胞损伤修复。敲除AnxA2可诱导支气管上皮细胞凋亡和去黏附并抑制胶原蛋白VI的分泌[10]。另外,研究也发现AnxA2分子参与MP感染的致病过程,MP释放的毒素可通过AnxA2感染人体细胞并内化毒素、诱导细胞空泡化[11]。本研究利用特异性siRNA沉默气道上皮细胞H292中AnxA2的表达,结果发现抑制AnxA2表达可提高MP抗原处理后的细胞活性,揭示了AnxA2可能参与MP抗原处理对上皮细胞活性的影响。然而,MP抗原处理的气道上皮细胞中AnxA2表达水平较对照组并无显著变化,显示出MP抗原处理并不直接通过影响AnxA2的表达来影响细胞存活及细胞病变。
EGFR是一种受体酪氨酸激酶,可与配体结合磷酸化,进而起始信号转导引发细胞变化,包括调控基因表达、重构细胞骨架、抑制细胞凋亡和增加细胞增殖等[12]。EGFR信号通路在MP感染后细胞病变中具有关键性作用。MP感染可促进小鼠肺脏组织中EGFR磷酸化和MUC分泌,利用EGFR活性抑制物AG1478预处理则降低MUC的表达[13]。MP抗原在体外也可上调支气管上皮细胞表皮调节素(EGFR配体之一),进而活化EGFR并诱导细胞IL-8表达[14]。本研究发现MP抗原处理上调气道上皮细胞中p-EGFR和p-p65 NF-κB的表达水平,利用AnxA2 siRNA抑制细胞膜联蛋白表达后,p-EGFR和p-p65 NF-κB的表达水平明显下降,说明AnxA2分子介导MP抗原处理后EGFR/NF-κB信号通路的活化。本研究中,MP抗原处理上调细胞中MUC5AC和MUC5B的表达,而沉默AnxA2表达后,MUC的表达量明显降低,说明AnxA2分子参与MP抗原处理诱导细胞MUC的表达。有研究发现AnxA2受中性粒细胞弹性蛋白酶调控,由细胞质向细胞膜聚集,可促进支气管上皮细胞中MUC5AC的分泌[15],与本研究结论一致。由于本研究未能调控细胞系中EGFR的活性,因而不能直接说明MP是否通过AnxA2/EGFR/NF-κB信号上调MUC5AC和MUC5B的表达。
综上所述,本研究发现沉默气道上皮细胞AnxA2表达抑制MP诱导的EGFR/NF-κB信号活化以及MUC表达,揭示了AnxA2可能是参与MP抗原处理后气道上皮细胞病变的重要分子。
| [1] | Sánchez-Vargas FM, Gómez-Duarte OG. Mycoplasma pneumoniae-an emerging extra-pulmonary pathogen[J]. Clin Microbiol Infect, 2008, 14(2): 105–117. DOI:10.1111/j.1469-0691.2007.01834.x |
| [2] | Meyer Sauteur PM, Van Rossum AM, Vink C. Mycoplasma pneumoniae in children:carriage, pathogenesis, and antibiotic resistance[J]. Curr Opin Infect Dis, 2014, 27(3): 220–227. DOI:10.1097/QCO.0000000000000063 |
| [3] | Hao Y, Kuang Z, Jing J, et al. Mycoplasma pneumoniae modulates STAT3-STAT6/EGFR-FOXA2 signaling to induce overexpression of airway mucins[J]. Infect Immun, 2014, 82(12): 5246–5255. DOI:10.1128/IAI.01989-14 |
| [4] | Wang Y, Zhu Z, Church TD, et al. SHP-1 as a critical regulator of Mycoplasma pneumoniae-induced inflammation in human asthmatic airway epithelial cells[J]. J Immunol, 2012, 188(7): 3371–3381. DOI:10.4049/jimmunol.1100573 |
| [5] | Chaudhary P, Thamake SI, Shetty P, et al. Inhibition of triplenegative and Herceptin-resistant breast cancer cell proliferation and migration by Annexin A2 antibodies[J]. Br J Cancer, 2014, 111(12): 2328–2341. DOI:10.1038/bjc.2014.542 |
| [6] | Yang T, Luo F, Shen Y, et al. Quercetin attenuates airway inflammation and mucus production induced by cigarette smoke in rats[J]. Int Immunopharmacol, 2012, 13(1): 73–81. DOI:10.1016/j.intimp.2012.03.006 |
| [7] | Yang J, Yu HM, Zhou XD, et al. Cigarette smoke induces mucin hypersecretion and inflammatory response through the p66shc adaptor protein-mediated mechanism in human bronchial epithelial cells[J]. Mol Immunol, 2016, 69: 86–98. DOI:10.1016/j.molimm.2015.11.002 |
| [8] | 林枝云, 宋英, 何巍, 等. 膜联蛋白A2的结构、功能及其在疾病中的研究进展[J]. 中国现代应用药学, 2016, 33(10): 1350–1354. |
| [9] | Patchell BJ, Wojcik KR, Yang TL, et al. Glycosylation and annexin Ⅱ cell surface translocation mediate airway epithelial wound repair[J]. Am J Physiol Lung Cell Mol Physiol, 2007, 293(2): L354–L363. DOI:10.1152/ajplung.00412.2006 |
| [10] | Dassah M, Almeida D, Hahn R, et al. Annexin A2 mediates secretion of collagen VI, pulmonary elasticity and apoptosis of bronchial epithelial cells[J]. J Cell Sci, 2014, 127(Pt 4)): 828–844. |
| [11] | Somarajan SR, Al-Asadi F, Ramasamy K, et al. Annexin A2 mediates Mycoplasma pneumoniae community-acquired respiratory distress syndrome toxin binding to eukaryotic cells[J]. MBio, 2014, 5(4): e01497–14. |
| [12] | Jutten B, Rouschop KM. EGFR signaling and autophagy dependence for growth, survival, and therapy resistance[J]. Cell Cycle, 2014, 13(1): 42–51. DOI:10.4161/cc.27518 |
| [13] | Ledford JG, Voelker DR, Addison KJ, et al. Genetic variation in SP-A2 leads to differential binding to Mycoplasma pneumoniae membranes and regulation of host responses[J]. J Immunol, 2015, 194(12): 6123–6132. DOI:10.4049/jimmunol.1500104 |
| [14] | Arae K, Hirata M, Kurata S, et al. Mycoplasma pneumoniae induces interleukin-8 production via the epidermal growth factor receptor pathway[J]. Microbiol Immunol, 2011, 55(10): 748–750. DOI:10.1111/mim.2011.55.issue-10 |
| [15] | Xu R, Li Q, Zhou X, et al. Annexin Ⅱ mediates the neutrophil elastase-stimulated exocytosis of mucin 5ac[J]. Mol Med Rep, 2014, 9(1): 299–304. |
 2017, Vol. 19
2017, Vol. 19