2. 孝感市妇幼保健院儿科, 湖北 孝感 432000
儿童肥胖和儿童支气管哮喘二者之间的关联影响已得到流行病学和临床医学研究的一致认同[1-3]。近年来有关哮喘动物模型的实验研究取得了长足的进展,人们对神经和神经因子在气道高反应形成过程中所扮演的角色有了更清楚的认识[4-7]。特别是背根神经节(dorsal root ganglion, DRG)中感受咳喘-伤害感受器在哮喘链式反应机制中的作用[8-9],揭示了瞬时感受器电位阳离子通道香草酸-1(transient receptor potential 1, TRPV1)受体不仅是对环境中各种有害致敏源的感受器,也是将被激惹的信息通过脊髓DRG上传至中枢的传感器和/或在气道局部直接兴奋平滑肌的激发器。因此,为探讨高脂饮食导致的增重对外周感觉神经元TRPV1的表达及对感觉神经元兴奋性的影响,本课题组进行了如下实验。
1 材料与方法 1.1 动物分组及饲养SPF级8周龄健康雄性C57BL/6小鼠20只,体重21~25 g,购自湖北省疾病预防控制中心。将小鼠随机分为高脂饲料组(n=10)和普通饲料组(n=10),喂饲高脂饲料组小鼠的饲料中含58.0%脂肪、25.6%碳水化合物和16.4%蛋白质;喂饲普通饲料组小鼠的饲料中含11.4%脂肪、62.8%碳水化合物和25.8%蛋白质。两组饲料量和饮水摄入无限制,定期更换垫料,保持小鼠生活环境通风和清洁卫生。当高脂饲料组小鼠个体体重全部高出普通饲料组后,即经过7周的喂养,取两组小鼠肺叶、支气管组织,以及胸3~4段DRG测量各项实验指标。
1.2 体重测定每周日添加饲料前测量两组小鼠体重并记录。
1.3 TRPV1抗体免疫组化染色小鼠经头颈椎断臼后背侧向上,剪去背部皮毛,剔除脊柱周边筋膜肌肉,暴露脊柱并游离出胸段;沿脊突左右两侧纵向剪除椎骨后,从腹侧椎骨中线剪切剖成两半,完整剔除脊髓并剪断与之相连的神经和纤维;在显微镜下用解剖镊在双侧锥孔内逐个取出T2~5共4对神经节,一部分置于4%多聚甲醛行免疫组化染色,一部分置于DMEM(4℃)培养基中备细胞培养。在清除脊柱等组织后,取支气管和肺叶置于DMEM(4℃)培养基中,在显微镜下用解剖镊剔除残留的结缔组织等,DMEM换液2次。上述所有组织经4%多聚甲醛固定约30 min后转入含4%多聚甲醛和30%蔗糖的溶液中4℃孵育过夜;于冰冻切片机内以OTC包埋行10 μm厚度冰冻切片,每个组织样本随机选取3~5张切片,以PBS洗3 min×2次,1% Triton和3% H2O2孵育约10 min,再以10%FBS和3%BSA封闭约40 min;加入兔抗鼠TRPV1抗体(1 : 200)于4℃1%PBS中孵育过夜,PBS洗10 min×3次,加入羊抗兔Texas Red荧光抗体(1 : 200)于室温孵育约1 h,后经PBS洗10 min×3次,载玻片封片。在荧光显微镜下每张切片随机选取5个视野进行图像采集,并用Image J图像软件计数比较TRPV1表达程度。抗体均购于Thermo Scientific Hyclone北京代理,试剂购于北京沃比森科技有限公司,荧光显微镜为Olympus FV1000(Tokyo,Japan)。
1.4 DRG神经细胞培养及电活动测定每组从DMEM培养基内取出小鼠DRG,分别置于含1%胶元酶和1%消化酶的2 mL混合消化液中37℃消化1 h,经过吹打成单个细胞后,用DMEM培养液稀释成0.2×105个细胞/mL密度的细胞悬液,种植于经硫酸浸泡又PBS清洗过的培养皿中,于5%CO2培养箱中培养2 h(37℃),移至膜片钳防震台显微镜下测试电活动。测试电极拉制为3~7 MΩ,膜片钳记录采用模式为全细胞电压钳(v-Clamp)记录电流,记录模式转化为电流钳(I-Clamp)经阶梯式电流注入细胞激发动作电位。脉冲信号由Pulse+Pulsefit软件(Version 8.31,HEKA,德国),经EPC-9放大器(HEKA,德国)放大,Pulse软件收集并存储。
1.5 统计学分析采用SPSS 13.0统计软件对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
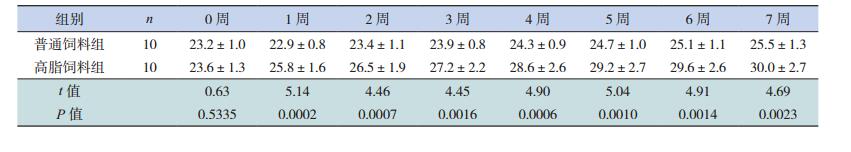
2 结果 2.1 两组小鼠体重变化情况在施加饲料前,高脂饲料组和普通饲料组平均体重分别为23.6±1.3 g和23.2±1.0 g,两组间比较差异无统计学意义(t=0.63,P > 0.05)。饲养1周后,高脂饲料组平均体重(25.8±1.6 g)明显高于普通饲料组(22.9±0.8 g)(P < 0.001)。实验至第7周,高脂饲料组平均体重30.0±2.7 g,平均增重6.4±2.6 g,而普通饲料组平均体重25.5±1.3 g,平均增重2.3±0.5 g,两组小鼠平均增重比较差异有统计学意义(t=4.34,P < 0.001)。见图 1,表 1。
|
图 1 高脂与普通饮食喂养对小鼠体重的影响(n=10) a示与普通饲料组比较,P<0.05。 |
| 表 1 两组各时间点体重比较(x±s,g) |
2.2 TRPV1在支气管、肺泡和DRG上的表达
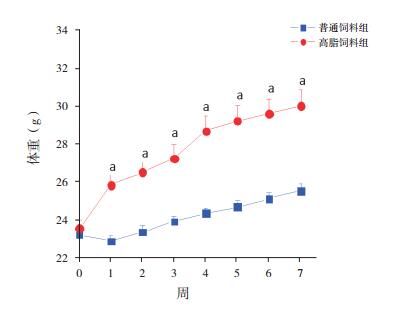
在取样中观察到,所检测组织从外观、大小、厚度、弹性和色泽等方面,两组无明显不同。免疫组化结果显示,在肺泡组织上,高脂饲料组TRPV1呈明显阳性表达,而普通饲料组则未见或仅见极弱荧光并被确认为非特异性反应。在支气管组织上,两组均见TRPV1阳性表达,普通饲料组小鼠支气管组织上平均TRPV1阳性细胞数目(28±15)低于高脂饲料组(41±16)(t=-3.23,P < 0.05)。即与普通饲料组相比,高脂饲养明显提高小鼠支气管TRPV1的表达。见图 2。
|
图 2 两组小鼠肺泡和支气管组织中TRPV1的表达情况(免疫荧光,×20) |
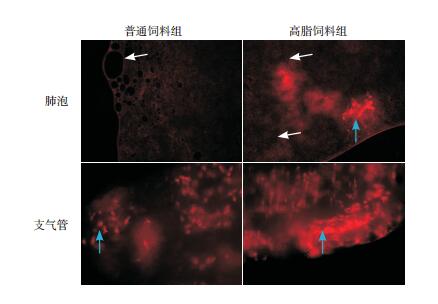
在呼吸道感觉神经即脊髓DRG胸段第3或第4对神经节上,高脂饲料组和普通饲料组皆可见大量TRPV1阳性细胞。经图像处理剔除抗体非特异性反应信号背景或噪音后,普通饲料组TRPV1抗体反应阳性细胞数平均值(50±26)低于高脂饲料组(65±33)(t=-2.08,P < 0.05)。统计表明,高脂饲料组提高了支配呼吸道DRG TRPV1的表达。见图 3。
|
图 3 两组小鼠脊髓DRG TRPV1表达情况(免疫荧光,×20) 白色箭头指示染色阴性区域即结缔纤维组织,蓝色箭头指示为TRPV1红色荧光染色阳性灶。 |
2.3 辣椒素刺激后两组小鼠DRG上TRPV1电流变化
如前所叙,高脂饮食增加了TRPV1在小鼠呼吸系统和外周感觉神经元上的表达,于是,本实验采用膜片钳技术对TRPV1功能进行测定。当设置膜片钳模式为v-Clamp,电压钳制在膜电位-60 mV时,加入辣椒素(Simga,美国)1 μmol/L(TRPV1受体激动剂)观察到,在部分高脂饲料组小鼠感觉神经元中可出现节律型内向性电流,而在普通饲料组小鼠感觉神经元中却未能发现类似电流。在辣椒素作用下,两组DRG中大部分细胞均能产生单个波峰的内向电流。由于对物理因子如感受温度(冷)和化学因子如卵白蛋白产生敏感性反应的TRPV1主要表达在小型DRG神经细胞,因此本研究只对DRG细胞中的小型细胞电活动的检测结果进行分析。结果显示高脂饲料组辣椒素激动TRPV1通道所产生的内向电流(94±64 pA/pF,n=49)明显高于普通饲料组(64±37 pA/pF,n=40)(t=2.7,P < 0.05),其中n为两组各8只小鼠DRG细胞培养皿中,每个培养皿分别随机选取10个细胞进行检测,共获得的对辣椒素产生电流反应的神经细胞个数。见图 4。
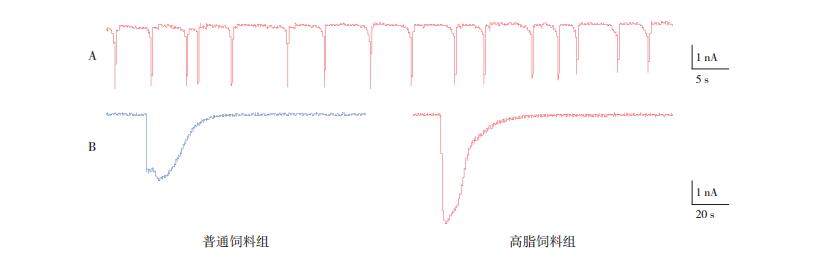
|
图 4 TRPV1电流 A:膜电位电压钳住-60 mV时,辣椒素(1 μmol/L)引起高脂饲料组小鼠感觉神经元产生节律性周期性内向电流,其频率为20±4次/min。B:膜电位电压钳住-60 mV时,辣椒素(1 μmol/L)引起代表性单个内向电流。 |
2.4 动作电位
在膜片钳模式为I-Clamp时,注入阶梯式电流以每0.03 nA递增从-0.14 nA到+0.14 nA、区间为500 ms。电流钳住膜电位由超级化到除极化,当达到细胞动作电位阈值即可激发动作电位。注入细胞引起动作电位所需的最低电流和/或同一强度的电流刺激引发动作电位的数目可评价该细胞电兴奋性高低。普通饲料组DRG神经细胞在电流强度为0.11 nA和0.14 nA时分别产生1~2个动作电位(图 5左),而高脂饲料组DRG神经细胞在电流强度为0.02 nA即产生2个动作电位,当达到0.14 nA时则增加到6个动作电位(图 5右)。在动作电位所需最低电流强度的检测中,普通饲料组DRG神经细胞的平均阈值为0.36±0.17 nA(n=11),而高脂饲料组为0.18±0.10 nA(n=11),两组比较差异有统计学意义(t=2.9,P < 0.05),即阈值越低越容易激动兴奋,故高脂饮食易于激惹神经兴奋。在同等电流刺激强度即0.14 nA时所产生的动作电位数目的比较中,普通饲料组为2.1±1.4(n=8),而高脂饲料组为3.7±1.7(n=11)。两组比较差异有统计学意义(t=-2.2,P < 0.05)。其中n为两组各10只小鼠DRG细胞培养皿中,每个培养皿分别随机选取4个细胞进行检测,共获得的产生动作电位的细胞个数。
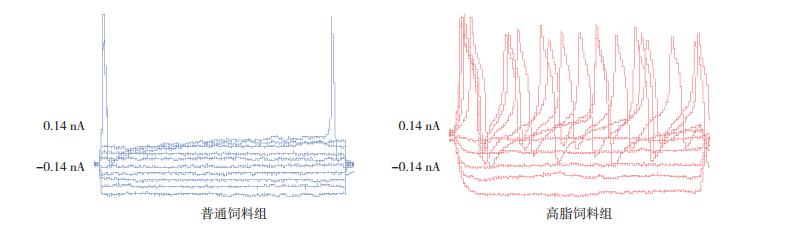
|
图 5 两组小鼠脊髓DRG兴奋性比较 动作电位激发以阶梯式电流刺激模式即从-0.14 nA起,梯度为0.03 nA,逐级提高至+0.14 nA,时程为500 ms;普通饲料组在刺激强度为0.11 nA和0.14 nA时各激发1个动作电位;高脂饲料组在刺激强度为0.05、0.08、0.11、0.14 nA时分别可激发2~6个动作电位。 |
3 讨论
肥胖和哮喘是儿童人群中的常见病,大量研究证实体重指数越大,越容易出现气道高反应[1]。过多的脂肪细胞可以直接分泌瘦素、纤溶酶原激活物抑制剂-1、脂联素等来聚集嗜酸性细胞和淋巴细胞等,从而导致炎症的形成;同时,过多的脂肪细胞也可以作用于神经细胞产生神经因子从而介入哮喘。Bonini等[6]发现哮喘患者血清神经生长因子(NGF)蛋白异常增高,NGF可以诱导嗜酸性粒细胞的形成和肥大细胞增殖分化,促进组胺等炎性介质释放。Olgart Höglund等[7]用变应原反复刺激哮喘患者后,发现肥大细胞的数量随着NGF的增加而不断增加。这印证了NGF除提高神经兴奋性外,还具有聚集炎症细胞和炎性因子浸润等作用,进一步说明肥胖或体重过重导致机体呈系统性炎症倾向。脂肪细胞还可以释放细胞因子对神经细胞致敏,还可激活和促进神经细胞分泌释放NGF、P物质、速激肽、降钙素基因相关肽,而这些物质可分别或共同作用于支气管平滑肌,形成支气管气道高反应。值得注意的是,在一项哮喘模型实验中发现肺组织TRPV1 mRNA、IL-8(神经源性炎症细胞因子)及IL-13(免疫源性炎症细胞因子)的表达比较中,哮喘组明显高于正常对照组[8],这不仅从另一个角度支持了本研究关于TRPV1增高是高脂饮食导致哮喘发病机制中的一个环节,而且强调了TRPV1在哮喘病理机制中具有激发神经源性炎症和免疫源性炎症的双重作用。
DRG伤感器学说即沉默TRPV1导致尘螨卵不能引起哮喘是近年来最有影响的研究[9-11],它在终端反应机制上揭示了TRPV1在支气管哮喘气道高反应中的关键作用,为哮喘病的临床转化医学提出了一个新的研究课题和治疗靶向路径。本课题在高脂饲养中可以有效获得体重增重效果,与大多文献相同[12-13]。在联系高脂饮食-TRPV1-气道高反应的过程中,本研究发现无论是呼吸道组织还是脊髓胸段DRG,免疫组化实验都证明TRPV1在高脂饲料组中都有极高的表达。这与McGarvey等[14]的研究结果极为相似,他们在支气管黏膜和管壁上也发现哮喘病人的TRPV1表达比对照组有明显增高;而Baker等[15]也从不同角度支持本研究结果,他们的研究发现OVA导致的哮喘具有TRPV1高表达,而TRPV1抑制剂(XEN-D0501)的干预是通过调节CD4+ T细胞,进而特异性的降低IgE水平控制哮喘。本研究旨在观察高脂饲养对体重及TRPV1表达的影响以及TRPV1高表达对神经兴奋功能方面的作用。本研究结果表明高脂饲养导致体重增加进而TRPV1在呼吸道和DRG表达增加,从而出现神经电流活动的增强。正是这种电流的高表达,使得DRG更容易激活并出现高频率、集束式、节律性放电[16]。众所周知,神经的兴奋可以直接导致平滑肌细胞兴奋性收缩并痉挛。同时,还可以引起局部炎症细胞浸润和神经化学及细胞因子释放,加重气道哮喘和炎症。综上所述,高脂饲料喂养小鼠不仅导致体重增加或肥胖,而且还提高伴有TRPV1在气道组织和支配气道组织感觉神经元的高表达,而TRPV1激活剂辣椒素对高脂饲养鼠感觉神经元可以产生电活动的高反应,提示外周感觉神经元咳喘伤感器对外来刺激敏感性增高是呼吸道超高反应中的关键,因而交感神经在哮喘中的作用应该受到更多的重视。虽然本研究尚未对两组小鼠做气道高反应性和哮喘的评估,没有直接观察高脂饲养小鼠是否更可能在尘螨卵的作用下发展为哮喘,以及干预TRPV1是否可以影响气道高反应性和哮喘,但是,如果结合本研究和其他研究团队的研究成果,我们可以逻辑上地推测TRPV1是在高脂饮食-DRG-哮喘路径中的一个中间环节或哮喘发生发展信号通路中的一个路径。无疑在今后的研究中,制作和应用肥胖模型评价气道高反应性和气道激发试验等将对肥胖与哮喘的病理关联机制评估提供实质性的直接证据,从而确立是否TRPV1将成为阻断肥胖导致哮喘和控制哮喘的新靶点。
| [1] | 仲玉强. 肥胖对支气管哮喘患儿肺功能和炎性因子的影响[J]. 中华实用儿科临床杂志, 2016, 31(21): 1668–1670. DOI:10.3760/cma.j.issn.2095-428X.2016.21.018 |
| [2] | 全国儿科哮喘协作组, 中国疾病预防控制中心环境与健康相关产品安全所. 第三次中国城市儿童哮喘流行病学调查[J]. 中华儿科杂志, 2013, 51(10): 729–735. DOI:10.3760/cma.j.issn.0578-1310.2013.10.003 |
| [3] | 刘传合, 洪建国, 尚云晓, 等. 中国16城市儿童哮喘患病率20年对比研究[J]. 中国实用儿科杂志, 2015, 30(8): 596–600. |
| [4] | 卢洪华, 李艳春, 华树成. 支气管哮喘临床蛋白质组学研究进展[J]. 中国实验诊断学, 2013, 17(7): 1352–1354. |
| [5] | Shore SA, Fredberg JJ. Obesity, smooth muscle, and airway hyperresponsiveness[J]. J Allergy Clin Immunol, 2005, 115(5): 925–927. DOI:10.1016/j.jaci.2005.01.064 |
| [6] | Bonini S, Lambiase A, Lapucci G, et al. Nerve growth factor and asthma[J]. Allergy, 2002, 57(Suppl 72): 13–15. |
| [7] | Olgart Höglund C, de Blay F, Oster JP, et al. Nerve growth factor levels and localisation in human asthmatic bronchi[J]. Eur Respir J, 2002, 20(5): 1110–1116. DOI:10.1183/09031936.02.00205402 |
| [8] | 冯爽, 张渊源, 高文娟, 等. 瞬时电位感受器香草酸受体1在哮喘小鼠气道炎症中的作用研究[J]. 中国当代儿科杂志, 2016, 18(9): 812–816. |
| [9] | Baraniuk JN. Rise of the sensors:nociception and pruritus[J]. Curr Allergy Asthma Rep, 2012, 12(2): 104–114. DOI:10.1007/s11882-012-0245-8 |
| [10] | Talbot S, Abdulnour RE, Burkett PR, et al. Silencing nociceptor neurons reduces allergic airway inflammation[J]. Neuron, 2015, 87(2): 341–354. DOI:10.1016/j.neuron.2015.06.007 |
| [11] | Binshtok AM, Bean BP, Woolf CJ. Inhibition of nociceptors by TRPV1-mediated entry of impermeant sodium channel blockers[J]. Nature, 2007, 449(7162): 607–610. DOI:10.1038/nature06191 |
| [12] | Enriori PJ, Evans AE, Sinnayah P, et al. Diet-induced obesity causes severe but reversible leptin resistance in arcuate melanocortin neurons[J]. Cell Metab, 2007, 5(3): 181–194. DOI:10.1016/j.cmet.2007.02.004 |
| [13] | Winzell MS, Ahrén B. The high-fat diet-fed mouse:a model for studying mechanisms and treatment of impaired glucose tolerance and type 2 diabetes[J]. Diabetes, 2004, 53(Suppl 3): S215–S219. |
| [14] | McGarvey LP, Butler CA, Stokesberry S, et al. Increased expression of bronchial epithelial transient receptor potential vanilloid 1 channels in patients with severe asthma[J]. J Allergy Clin Immunol, 2014, 133(3): 704–712. DOI:10.1016/j.jaci.2013.09.016 |
| [15] | Baker K, Raemdonck K, Dekkak B, et al. Role of the ion channel, transient receptor potential cation channel subfamily V member 1(TRPV1), in allergic asthma[J]. Respir Res, 2016, 17(1): 67. DOI:10.1186/s12931-016-0384-x |
| [16] | 祝炼, 徐之良, 程衍杨. 小儿肥胖与支气管哮喘关联机制的研究进展[J]. 中国当代儿科杂志, 2016, 18(7): 671–676. DOI:10.7499/j.issn.1008-8830.2016.07.020 |
 2017, Vol. 19
2017, Vol. 19