近年来,我国极早产儿的出生数量呈上升趋势。随着围产医学及新生儿监护技术的发展,极早产儿的存活率显著提高。然而,由于极早产儿的器官功能发育极不成熟,且需要接受更频繁的有创性诊疗措施、更长时间的呼吸支持及肠外营养等,使其成为新生儿监护病房中发生医院内感染的高危人群。有研究表明,医院内感染发生率在胎龄≤30周的早产儿中高达47.8%[1];在出生体重 < 1500 g早产儿中是出生体重 > 1 500 g者的3倍[2];并导致早产儿病死率及相关并发症发生率增加,住院时间延长,医疗费用增加[3-4]。本研究回顾性分析我院2016年胎龄 < 32周且出生体重 < 1 500 g的极早产儿病例,探讨我院极早产儿医院内感染病原菌的分布,药物敏感情况,分析其危险因素及相关结局,以期为临床有效防治极早产儿医院内感染提供一定参考。
1 资料与方法 1.1 研究对象及分组选取2016年1月1日至2016年12月31日首次入住我院早产儿病房,胎龄 < 32周且出生体重 < 1 500 g的极早产儿131例为研究对象,排除住院48 h内死亡(2例)、社会因素放弃治疗(14例)、合并严重先天性染色体或结构畸形(4例)患儿,最终共有111例早产儿纳入研究。将住院后≥72 h发生医院内感染患儿纳入感染组,未发生感染患儿纳入未感染组。
1.2 临床资料收集与研究结局的定义回顾收集所有患儿的围产期及住院资料。对怀疑感染的患儿,根据病情采集患儿的血液、下呼吸道分泌物、尿液、大便、导管末端或其他部位分泌物,置于无菌杯中,30 min内送检行病原菌培养及药物敏感试验;对于培养阳性者,同时结合患儿的临床症状、体征、辅助检查、病原菌的采集部位及种类进行综合判断,将考虑为定植菌或污染菌者纳入未感染组。
根据2001年卫生部颁布的《医院感染诊断标准(试行)》[5]作为早产儿病房新生儿医院内感染的诊断依据:(1)无明确潜伏期的感染,入院48 h后发生的感染为医院感染;有明确潜伏期的感染,自入院时起超过平均潜伏期后发生的感染为医院感染。(2)本次感染直接与上次住院有关。(3)在原有感染基础上出现其他部位新的感染(除外脓毒血症迁徙灶),或在原感染已知病原体基础上又分离出新的病原体(排除污染和原来的混合感染)的感染。(4)新生儿在分娩过程中和产后获得的感染。(5)由于诊疗措施激活的潜在性感染,如疱疹病毒、结核杆菌等的感染。
医院内感染率=(医院感染发生人数/同期住院病人数)×100%,医院例次感染率=(医院感染发生例次数/同期住院病人数)×100%,医院日感染率=(医院感染例次数/患者总住院日数)×100%[6]。
早产儿视网膜病变(retinopathy of prematurity, ROP)是指发生在早产儿、低体重儿的眼部视网膜血管增生性疾病,其定义参照ROP国际分类法[7];支气管肺发育不良(bronchopulmonary dysplasia, BPD)、脑室周围白质软化(periventricular leukomalacia, PVL)、脑室内出血(intraventricular hemorrhage, IVH)的诊断[8-10]及IVH的分度[10]均参照实用新生儿学第4版的相关标准。
本研究以住院期间发生死亡、BPD、需要治疗的ROP、PVL或Ⅱ度以上IVH中的至少1项作为首要结局指标,评估医院内感染对极早产儿近期预后的总体影响。其次以PVL或Ⅱ度以上IVH作为评估医院内感染对极早产儿神经系统结局影响的指标;以BPD作为评价极早产儿肺部并发症的指标,但临床上BPD确诊时间至少在生后28 d,部分严重病例在确诊前已经死亡,故除在存活病例中分析感染对极早产儿发生BPD的影响以外,同时以死亡或BPD作为联合指标矫正因死亡导致的偏倚。
1.3 统计学分析使用SPSS 19.0统计软件对数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料采用百分率(%)表示,两组间比较采用χ2检验或Fisher确切概率法。采用多因素logistic回归分析控制混杂因素并计算OR值及其95%可信区间(confidence interval, CI)。P < 0.05为差异有统计学意义。
2 结果 2.1 极早产儿医院内感染率及其分布111例早产儿中,42例发生医院内感染,其中10例曾发生过2~3次医院内感染,医院内感染率为37.8%,医院内感染发生的中位时间为20(14,28)d;感染例次为54例次,医院例次感染率为48.6%;患者总住院日为2 589 d,医院日感染率为2.09%。在54例次感染中:新生儿肺炎30例次(56%),其中呼吸机相关性肺炎2例次;新生儿败血症22例次(41%),其中导管相关血流感染10例次;肠炎及鹅口疮各1例次(2%)。
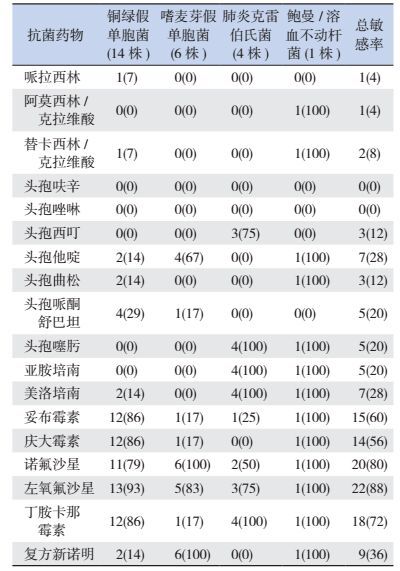
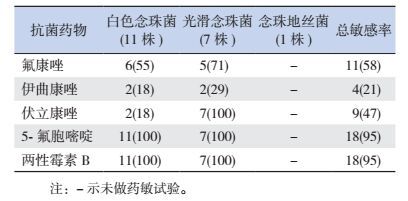
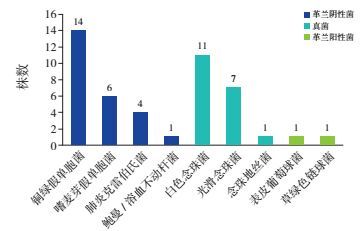
2.2 极早产儿医院内感染病原菌分布及药物敏感情况在42例医院内感染患儿中,30例共培养出致病菌46株,其中革兰阴性菌25株(54%),以铜绿假单胞菌最为常见;真菌19株(41%),以白色念珠菌最为多见;革兰阳性菌2株(4%),分别为表皮葡萄球菌、草绿色链球菌(图 1)。检出的革兰阴性菌对β-内酰胺类(哌拉西林、阿莫西林/克拉维酸、替卡西林/克拉维酸、头孢呋辛、头孢唑啉、头孢西叮、头孢他啶、头孢曲松、头孢哌酮舒巴坦、头孢噻肟)、碳青霉烯类(亚胺培南、美洛培南)及磺胺类(复方新诺明)药敏率 < 40%,对氨基糖苷类(妥布霉素、庆大霉素、丁胺卡那霉素)药敏率为40%~79%,对喹诺酮类(诺氟沙星、左氧氟沙星)药敏率≥80%;检出的真菌对伊曲康唑药敏率 < 40%,对氟康唑、伏立康唑药敏率为40%~79%,对5-氟胞嘧啶、两性霉素B药敏率≥80%。见表 1~2。
|
图 1 极早产儿医院内感染病原菌构成 |
| 表 1 25株革兰阴性菌药物敏感试验结果[例(%)] |
| 表 2 19株真菌药物敏感试验结果[例(%)] |
2.3 极早产儿医院内感染的危险因素分析
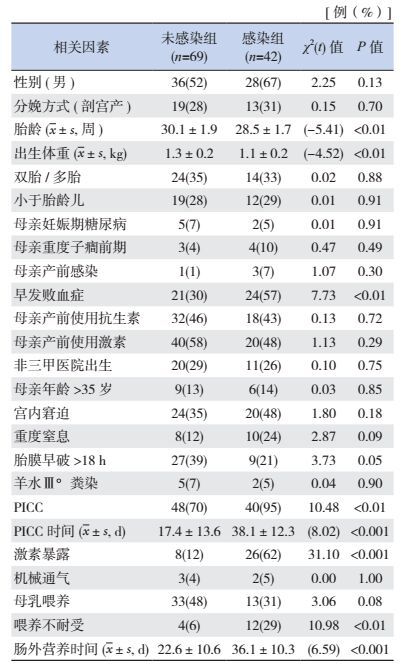
单因素分析结果显示:胎龄、出生体重、早发败血症[11]、外周静脉穿刺中心静脉置管(PICC)、PICC时间、激素暴露、喂养不耐受、肠外营养时间在感染组及未感染组间比较差异有统计学意义(P < 0.05)(表 3)。
| 表 3 极早产儿医院内感染危险因素的单因素分析 |
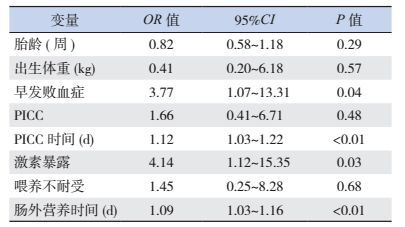
多因素logistic回归分析显示:早发败血症、PICC时间、激素暴露、肠外营养时间是发生医院内感染的危险因素(P < 0.05)。见表 4。
| 表 4 极早产儿医院内感染危险因素的多元logistic回归分析 |
2.4 医院内感染对极早产儿相关并发症、住院时间及医疗费用的影响
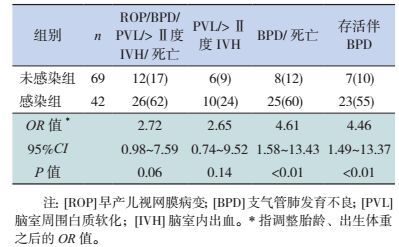
感染组患儿肺部并发症(BPD/死亡、存活伴BPD)的发生率高于未感染组(P < 0.01);总体并发症(ROP/BPD/PVL/ > Ⅱ度IVH/死亡)、神经系统并发症(PVL/ > Ⅱ度IVH)的发生率亦高于未感染组,但两组间比较差异无统计学意义(P > 0.05)(表 5)。同时,感染组患儿与未感染组比较,其医疗费用明显增高,住院时间显著延长(P < 0.001)。见表 6。
| 表 5 极早产儿相关并发症情况[例(%)] |
| 表 6 极早产儿医疗费用、住院时间比较(x±s) |
3 讨论
极早产儿的医院内感染甚为常见,胎龄越小,发生率越高,其主要原因与早产儿免疫系统不成熟,对生后病原侵袭反应迟缓,继而导致病原的定植和感染有关[12]。本研究显示我院极早产儿医院内感染发生率达37.8%,其主要医院内感染类型为新生儿肺炎、新生儿败血症,均与文献报道相一致[13-19];本组病例医院内感染发生的时间中位数为住院20 d,与文献报道的入院第3~35天为医院内感染高峰期相符合[20-21]。既往研究显示,早产儿医院内感染以革兰阴性菌感染为主[22],与本研究一致;但本研究中条件致病菌及真菌感染比例较文献报道明显升高[16, 19, 23],究其原因,除了与本组患儿胎龄较小、出生体重较低有关以外,可能与该组极早产儿较多发生早发败血症而接受广谱抗生素治疗、长时间使用PICC静脉营养及激素暴露等因素有关。
目前,临床病原菌的耐药性在全球范围内呈逐渐上升趋势[16]。本研究发现革兰阴性菌对临床常用β-内酰胺类及碳青霉烯类均有较高耐药性。此外,本组病例中,革兰阴性菌对碳青霉烯类抗生素的耐药性较文献报道明显增高[23-24],其原因考虑与我院早产儿病房较多使用碳青霉烯类抗生素有关。因此,在临床上应严格掌握抗生素应用指征,合理选择抗生素,避免耐药菌株的产生。本研究中,真菌感染病原中以白色念珠菌为主,与文献报道一致[25-26]。但该组真菌对氟康唑敏感性低于相关报道[26-27],可能与我院早产儿病房普遍预防性应用氟康唑有关。有关早产儿是否预防性应用抗真菌药物还存在一定争议[28-29],本研究提示预防性应用可能增加病原菌对药物的耐药性,值得慎重考虑。本组病例中真菌对5-氟胞嘧啶、两性霉素B均敏感,但两者的安全性限制了其在新生儿中的应用[30-31]。两性霉素B脂质体具有较好的安全性[32],氟康唑耐药时可选用。
与既往研究[1, 33-36]相一致,本研究发现胎龄、出生体重、早发败血症、PICC、PICC时间、激素暴露、喂养不耐受、肠外营养时间与极早产儿发生医院内感染相关;但受限于较小的样本量,胎龄、出生体重、PICC及喂养不耐受等因素未获得统计学意义,但其OR值提示具有临床意义。胎龄越小,出生体重越低,其发育更加不成熟,免疫功能更为低下,更易发生感染;合并早发败血症的极早产儿,可能因入院后早期经验使用广谱抗生素,引发菌群失调,增加二重感染的发生率;PICC导管作为外源性物质留置于体内,可破坏皮肤黏膜屏障;且随着置管时间延长,病原菌容易在导管表面形成生物膜[26],利于细菌定植,导致感染发生;喂养不耐受可导致肠外营养时间延长,肠外营养可能抑制淋巴细胞及中性粒细胞的免疫活性,且肠外营养液需经配置、储存、输注等多个环节来完成,发生污染的机会增多,故长期使用肠外营养增加感染风险。
随着极早产儿存活率的显著提升,其神经发育等远期预后及影响因素受到日益重视。已有较多证据表明,早产儿新生期的严重感染与其不良神经发育等远期预后密切相关[37-39],本研究亦证实极早产儿的医院内感染增加其神经系统并发症的发生风险,虽然统计学比较结果显示差异无统计学意义,但OR值较大,提示有临床意义,考虑造成统计学比较结果无意义的原因可能与本组资料病例数较少有关;同时感染组死亡、BPD等并发症发生风险增加,与文献报道相一致[3-4, 40]。Lapcharoensap等[4]对胎龄 < 30周、出生体重 < 1 500 g的早产儿进行回顾性研究发现,随着医院内感染发生率降低,BPD的发生也随之下降。因此,对极早产儿医院内感染的有效防治有助于改善其近远期预后。
综上所述,我院极早产儿医院内感染的发生受多重因素影响,其病原菌构成以革兰阴性菌为主,但真菌感染比例较高,临床应根据药物耐药情况合理选用药物并应严格掌握用药指征。医院内感染与早产儿并发症密切相关,增加了家庭和社会的负担。因此,应结合医院内感染发生的危险因素及病原药敏情况,采取合理防治措施,改善极早产儿的预后。
| [1] | 麦菁芸, 董琳, 林振浪, 等. 新生儿医院感染的调查分析[J]. 中华儿科杂志, 2011, 49 (12): 915–920. DOI:10.3760/cma.j.issn.0578-1310.2011.12.009 |
| [2] | Polin RA, Denson S, Brady MT, et al. Epidemiology and diagnosis of health care-associated infections in the NICU[J]. Pediatrics, 2012, 129 (4): e1104–e1109. DOI:10.1542/peds.2012-0147 |
| [3] | Haller S, Deindl P, Cassini A, et al. Neurological sequelae of healthcare-associated sepsis in very-low-birthweight infants: umbrella review and evidence-based outcome tree[J]. Euro Surveill, 2016, 21 (8): 30143. DOI:10.2807/1560-7917.ES.2016.21.8.30143 |
| [4] | Lapcharoensap W, Kan P, Powers RJ, et al. The relationship of nosocomial infection reduction to changes in neonatal intensive care unit rates of bronchopulmonary dysplasia[J]. J Pediatr, 2017, 180 : 105–109. DOI:10.1016/j.jpeds.2016.09.030 |
| [5] | 中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81 (5): 314–320. |
| [6] | 中华人民共和国卫生部. 中华人民共和国卫生行业标准医院感染监测规范[J]. 中华医院感染学杂志, 2009, 19 (11): 1–2. |
| [7] | International Committee for the Classification of Retinopathy of Prematurity. The international classification of retinopathy of prematurity revisited[J]. Arch Ophthalmol, 2005, 123 (7): 991–999. DOI:10.1001/archopht.123.7.991 |
| [8] | 常立文. 支气管肺发育不良[M]//邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学. 第4版. 北京: 人民卫生出版社, 2011: 416-422. |
| [9] | 周丛乐. 早产儿脑白质损伤[M]//邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学. 第4版. 北京: 人民卫生出版社, 2011: 715-723. |
| [10] | 周丛乐. 颅内出血[M]//邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学. 第4版. 北京: 人民卫生出版社, 2011: 706-715. |
| [11] | Dong Y, Speer CP. Late-onset neonatal sepsis: recent developments[J]. Arch Dis Child Fetal Neonatal Ed, 2015, 100 (3): F257–F263. DOI:10.1136/archdischild-2014-306213 |
| [12] | Zafar N, Wallace CM, Kieffer P, et al. Improving survival of vulnerable infants increases neonatal intensive care unit nosocomial infection rate[J]. Arch Pediatr Adolesc Med, 2001, 155 (10): 1098–1104. DOI:10.1001/archpedi.155.10.1098 |
| [13] | Yuan Y, Zhou W, Rong X, et al. Incidence and factors associated with nosocomial infections in a neonatal intensive care unit (NICU) of an urban children's hospital in China[J]. Clin Exp Obstet Gynecol, 2015, 42 (5): 619–628. |
| [14] | Abdel-Wahab F, Ghoneim M, Khashaba M, et al. Nosocomial infection surveillance in an Egyptian neonatal intensive care unit[J]. J Hosp Infect, 2013, 83 (3): 196–199. DOI:10.1016/j.jhin.2012.10.017 |
| [15] | Gadallah MA, Aboul Fotouh AM, Habil IS, et al. Surveillance of health care-associated infections in a tertiary hospital neonatal intensive care unit in Egypt: 1-year follow-up[J]. Am J Infect Control, 2014, 42 (11): 1207–1211. DOI:10.1016/j.ajic.2014.07.020 |
| [16] | 姜娜, 汪盈, 王琦, 等. 超早产儿医院感染及其危险因素分析[J]. 中华儿科杂志, 2014, 52 (2): 137–141. |
| [17] | Stoll B, Hansen N, Fanaroff AA, et al. Late-onset sepsis in very low birth weight neonates: the experience of the NICHD Neonatal Research Network[J]. Pediatrics, 2002, 110 (2 Pt 1): 285–291. |
| [18] | García H, Torres-Gutiérrez J, Peregrino-Bejarano L, et al. Risk factors for nosocomial infection in a level Ⅲ Neonatal Intensive Care Unit[J]. Gac Med Mex, 2015, 151 (6): 711–719. |
| [19] | 刘菊敏, 鲁芹, 亓立红, 等. 早产儿医院感染病原菌分布与耐药性分析[J]. 中华医院感染学杂志, 2015, 25 (10): 2351–2353. |
| [20] | Gill AW. Analysis of neonatal nosocomial infection rates across the Australian and New Zealand Neonatal Network[J]. J Hosp Infect, 2009, 72 (2): 155–162. DOI:10.1016/j.jhin.2009.02.018 |
| [21] | Bowen JR, Callander I, Richards R, et al. Decreasing infection in neonatal intensive care units through quality improvement[J]. Arch Dis Child Fetal Neonatal Ed, 2017, 102 (1): F51–F57. DOI:10.1136/archdischild-2015-310165 |
| [22] | Allegranzi B, Bagheri Nejad S, Combescure C, et al. Burden of endemic health-care-associated infection in developing countries: systematic review and meta-analysis[J]. Lancet, 2011, 377 (9761): 228–241. DOI:10.1016/S0140-6736(10)61458-4 |
| [23] | Brito DV, Brito CS, Resende DS, et al. Nosocomial infections in a Brazilian neonatal intensive care unit: a 4-year surveillance study[J]. Rev Soc Bras Med Trop, 2010, 43 (6): 633–637. DOI:10.1590/S0037-86822010000600006 |
| [24] | Urzedo JE, Levenhagen MM, Pedroso RS, et al. Nosocomial infections in a neonatal intensive care unit during 16 years: 1997-2012[J]. Rev Soc Bras Med Trop, 2014, 47 (3): 321–326. DOI:10.1590/0037-8682-0101-2014 |
| [25] | 花少栋, 黄捷婷, 吴志新, 等. 早产儿真菌败血症:附37例报告[J]. 中国小儿急救医学, 2013, 20 (2): 177–180. |
| [26] | 徐豆豆, 王杨, 藏建业, 等. 新生儿重症监护病房内早产儿真菌脓毒症危险因素临床分析: 2010年至2012年单中心报告[J]. 中华实用儿科临床杂志, 2013, 28 (18): 1393–1397. DOI:10.3760/cma.j.issn.2095-428X.2013.18.010 |
| [27] | Bonfietti LX, Szeszs MW, Chang MR, et al. Ten-year study of species distribution and antifungal susceptibilities of Candida bloodstream isolates at a Brazilian tertiary hospital[J]. Mycopathologia, 2012, 174 (5-6): 389–396. DOI:10.1007/s11046-012-9566-3 |
| [28] | Leibovitz E. Strategies for the prevention of neonatal candidiasis[J]. Pediatr Neonatol, 2012, 53 (2): 83–89. DOI:10.1016/j.pedneo.2012.01.004 |
| [29] | Wisplinghoff H, Ebbers J, Geurtz L, et al. Nosocomial bloodstream infections due to Candida spp. in the USA: species distribution, clinical features and antifungal susceptibilities[J]. Int J Antimicrob Agents, 2014, 43 (1): 78–81. DOI:10.1016/j.ijantimicag.2013.09.005 |
| [30] | 曹云. 新生儿重症监护病房真菌感染防治进展[J]. 中国新生儿科杂志, 2012, 27 (6): 365–368. |
| [31] | 花少栋, 吴志新, 黄捷婷, 等. 早产儿白假丝酵母菌败血症13例临床分析[J]. 中国当代儿科杂志, 2012, 14 (10): 728–732. |
| [32] | Arrieta AC, Shea K, Dhar V, et al. Once-weekly liposomal amphotericin B as Candida prophylaxis in very low birth weight premature infants: a prospective, randomized, open-label, placebo-controlled pilot study[J]. Clin Ther, 2010, 32 (2): 265–271. DOI:10.1016/j.clinthera.2010.02.016 |
| [33] | 迟春昕, 谢巧庆, 林俊. NICU早产儿医院感染危险因素分析及对策[J]. 中华医院感染学杂志, 2014, 24 (5): 1268–1272. |
| [34] | 杨玲蓉, 彭珉娟, 李桦, 等. 新生儿重症监护室患儿医院内感染病原菌分布及医院内感染的危险因素分析[J]. 中国当代儿科杂志, 2013, 15 (2): 112–116. DOI:10.7499/j.issn.1008-8830.2013.02.010 |
| [35] | Njere I, Islam S, Parish D, et al. Outcome of peripherally inserted central venous catheters in surgical and medical neonates[J]. J Pediatr Surg, 2011, 46 (5): 946–950. DOI:10.1016/j.jpedsurg.2011.02.037 |
| [36] | Anday EK, Conway D. Steroid therapy in the high-risk neonate: benefits and risks[J]. Clin Obstet Gynecol, 2003, 46 (1): 190–210. DOI:10.1097/00003081-200303000-00022 |
| [37] | Mitha A, Foix-L'Hélias L, Arnaud C, et al. Neonatal infection and 5-year neurodevelopmental outcome of very preterm infants[J]. Pediatrics, 2013, 132 (2): e372–e380. DOI:10.1542/peds.2012-3979 |
| [38] | Schlapbach LJ, Aebischer M, Adams M, et al. Impact of sepsis on neurodevelopmental outcome in a Swiss National Cohort of extremely premature infants[J]. Pediatrics, 2011, 128 (2): e348–e357. DOI:10.1542/peds.2010-3338 |
| [39] | Alshaikh B, Yusuf K, Sauve R. Neurodevelopmental outcomes of very low birth weight infants with neonatal sepsis: systematic review and meta-analysis[J]. J Perinatol, 2013, 33 (7): 558–564. DOI:10.1038/jp.2012.167 |
| [40] | Jantzen C, Lodha A, Lucia M, et al. Effects of nosocomial infection trends on neonatal outcomes in preterm infants < 33 weeks of gestational age in Canadian NICUs[J]. 中国当代儿科杂志, 2015, 17 (10): 1019–1027. |
 2017, Vol. 19
2017, Vol. 19