2. 皖南医学院第一附属医院 中心实验室, 安徽 芜湖 241001
新生儿细菌感染每年约造成680 000例新生儿死亡,约占新生儿总死亡人数的1/4[1]。新生儿细菌感染由于缺乏特异性临床表现,在临床工作中常常很难早期发现。目前国内常用的感染检测指标包括血常规、C反应蛋白(CRP)、降钙素原(PCT)、血培养等,但这些传统检测指标普遍存在敏感度和特异度低、检测周期时间长等问题。CRP在细菌感染发生后24~48 h后开始升高[2-3],属于晚发型感染指标。且大量研究表明,CRP在生后3 d会出现生理性升高[4],临床中容易误诊为合并感染,导致抗生素误用。PCT在感染早期3~4 h内开始升高[5],6~8 h达到高峰,并且至少持续24 h[4],在感染控制后开始下降[6],临床上可用于新生儿细菌感染严重程度及抗生素治疗效果的评估,属于早发型感染指标。但PCT不足之处在于,在健康新生儿生后48 h内,PCT也会生理性升高,增加了诊断的难度[4, 7]。同样,PCT和CRP相似,在一些非感染性围产期并发症如新生儿呼吸窘迫综合征、围产期窒息、颅内出血、循环衰竭、心肺复苏后,都会升高[3, 8],使得PCT、CRP在早期诊断新生儿感染时受到限制。传统的败血症诊断金标准为血培养,但检测至少需要2 d才能得到结果[9-10],对于生长缓慢的细菌,培养时间还将进一步延长,且阳性率仅略高于50%[11],甚至约有20%的败血症患儿血培养出现假阴性结果[12],这往往造成诊断延迟及漏诊。PCR联合16SrDNA二代测序技术作为新兴的细菌鉴定方法,可以弥补传统血培养关于培养时限长和假阴性高等问题[13],但仍然存在检测价格昂贵、16SrDNA样本污染以及同种细菌16SrDNA相似难以鉴别细菌种属等问题[14]。因此,寻找一种灵敏度高、特异性强的检测方法对早期识别新生儿细菌感染尤为重要。
CD64作为近年来新型的细胞因子,在诊断细菌感染及败血症方面有显著的价值[15-16]。CD64是抗体IgG表面Fc段高亲和力受体[17-18],即FcγRI,可特异性识别并与IgG结合,为免疫球蛋白超家族成员。正常情况下,CD64主要分布在巨噬细胞、树突状细胞、单核细胞,中性粒细胞表面几乎不表达[3, 17]。当机体受到细菌入侵或有炎症损伤刺激时[19],血液中的促炎因子(IFN-γ、TNF-α、G-CSF)被释放[20-21],导致中性粒细胞表面CD64分子在1~6 h内升高至正常水平的5~10倍[10, 22],并至少能在24 h保持稳定[3]。研究显示,中性粒细胞CD64可作为早期诊断细菌感染的指标,它没有生理性变化,且不受围产期并发症的影响[23]。Shi等[24]的Meta分析显示,单独检测中性粒细胞CD64存在灵敏度、特异度偏低等问题,在新生儿感染中的诊断价值有待进一步考证。因此本研究通过检测细菌感染新生儿血清中性粒细胞CD64、PCT水平的变化,以探讨两者联合检测对早期识别新生儿细菌感染的价值,为临床诊断新生儿感染提供依据。
1 资料与方法 1.1 研究对象58个病例来自2015年1~12月我院新生儿病房住院患儿,其中男42例,女16例。患儿从起病到入院,病程均少于3 d。排除患有先天性畸形、入院前接受过抗生素治疗的患儿。本研究通过我院伦理委员会批准及患儿家长知情同意。
58例新生儿中,37例为细菌感染,按出院诊断分为2组:败血症组(男11例,女4例)和一般感染组(非败血症患儿;男17例,女5例);21例为非感染新生儿,作为对照组(男14例,女7例)。一般感染组22例患儿中,包括新生儿肺炎14例,新生儿脐炎4例,新生儿脓疱病2例,上呼吸道感染2例。该组患儿血培养均为阴性。败血症组15例患儿中,临床诊断败血症13例(坏死性小肠结肠炎10例,严重误吸致感染性肺炎2例,化脓性脑膜炎1例);实验室血培养阳性败血症2例(尿肠球菌感染1例,大肠埃希菌1例)。对照组包括新生儿高胆红素血症9例,新生儿缺氧缺血性脑病8例,新生儿湿肺2例,过敏性腹泻2例。3组间胎龄(P=0.883)、出生体重(P=0.687)及性别构成(P=0.736)比较差异无统计学意义。
1.2 诊断标准及入选标准新生儿败血症包括确诊败血症和临床诊断败血症,其诊断标准参照《实用新生儿学》[25]。其中临床诊断败血症标准为至少满足下列非特异性检查中的两项:(1)WBC < 5×109/L,或增多(日龄≤3 d者,WBC≥25×109/L;> 3 d者,WBC≥20×109/L);(2)杆状核细胞/中性粒细胞≥0.16;(3)血小板计数 < 100×109/L;(4)CRP > 8 μg/mL;(5)PCT > 2 μg/L。
一般感染组入选标准为:患有脐炎、肺炎、脓疱病、上呼吸道感染等局部感染症状或体征,且同时至少伴有1项以上非特异性检查结果异常,但尚未达到临床败血症诊断标准的新生儿。对照组入选标准为:根据临床表现及辅助检查,排除感染的新生儿。
1.3 标本采集与检测各组新生儿入院后即刻抽取外周静脉血2 mL于EDTA抗凝管中,每100 μL静脉血中加入花青藻红素-5(PE-CY5)标记的鼠抗人CD45单克隆抗体、藻红朊(PE)标记的鼠抗人CD64单克隆抗体各1.5 μL(美国Becton-Dickinson公司),充分混匀后室温避光孵育,然后加入人红细胞裂解液(中国Biotopped公司),再次混匀后室温避光裂解红细胞,离心、洗涤后,再加入PBS重悬,应用Beckman Coulter FC500流式细胞仪(美国Beckman Coulter公司)检测中性粒细胞表面CD64表达,每份样本计数10 000个细胞。PCT采用化学发光法(MAGLUMI 1000全自动化学发光测定仪及配套试剂,深圳市新产品生物医学工程股份有限公司生产)检测,CRP采用免疫透射比浊法[CRP诊断试剂盒,德赛诊断系统(上海)有限公司生产;日立7600系列全自动生化分析仪,日本株式会社日立高新技术公司生产]检测。所有操作均按照试剂盒说明书严格执行。
1.4 统计学分析运用SPSS 22.0统计学软件进行数据处理与分析。定量资料采用均数±标准差(x±s)表示,多组间比较采用方差分析,多组间两两比较用SNK-q检验;定性资料用例数和百分率(%)表示,组间比较采用卡方检验;采用ROC曲线对中性粒细胞CD64、PCT、CRP单项指标及中性粒细胞CD64联合PCT检测对新生儿感染的诊断价值进行分析。P < 0.05表明差异具有统计学意义。
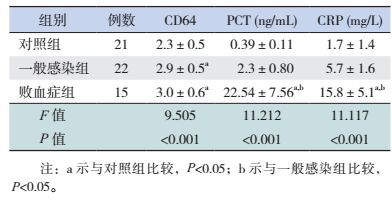
2 结果 2.1 组间血清CD64、PCT及CRP水平的比较血清中性粒细胞CD64、PCT及CRP水平在3组间的比较差异均有统计学意义(P < 0.01),其中败血症组中性粒细胞CD64、PCT及CRP水平明显高于对照组(P < 0.01);一般感染组中性粒细胞CD64水平高于对照组(P < 0.01),但血清PCT、CRP水平与对照组比较差异无统计学意义(P > 0.05);败血症组血清PCT、CRP水平显著高于一般感染组,而两组中性粒细胞CD64水平差异无统计学意义,见表 1。
| 表 1 3组组间各项指标的比较(x±s) |
2.2 各感染指标的ROC曲线分析
根据中性粒细胞CD64、PCT、CRP单项指标及中性粒细胞CD64联合PCT在感染组(包括一般感染组和败血症组)中的浓度值绘制ROC曲线。中性粒细胞CD64、PCT、CRP单项指标诊断感染的最佳截断值分别为2.58、0.61 ng/mL、4.09 mg/L,其曲线下面积分别为0.818、0.818、0.704;而中性粒细胞CD64联合PCT检测诊断感染的曲线下面积为0.926(图 1)。
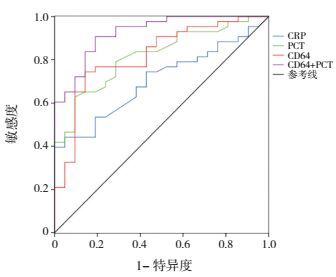
|
图 1 CD64、PCT、CRP单独及CD64联合PCT检测诊断感染的ROC曲线 |
2.3 各感染指标的诊断价值分析
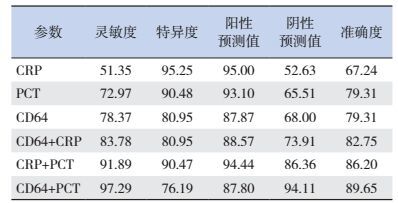
各感染指标实验室诊断阳性表示相关感染指标检查结果高于最佳截断值,即中性粒细胞CD64≥2.58、PCT≥0.61 ng/mL、CRP≥4.09 mg/L。联合检测阳性表示两感染指标至少有一种感染指标高于最佳截断值。中性粒细胞CD64与PCT联合检测对早期诊断新生儿感染的灵敏度及准确度较中性粒细胞CD64、CRP联合检测及CRP、PCT联合检测均高,且较各指标单项检测更高(表 2)。
| 表 2 各感染指标的诊断价值分析(%) |
3 讨论
新生儿全身免疫系统发育不成熟,特别是早产儿及低出生体重儿,出生后容易受到细菌侵袭,导致新生儿感染。临床上对细菌感染早期,症状和体征不明显的新生儿进行实验室检查时,不能做到精准检查,使得新生儿细菌感染不能早期诊断,易进一步发展为新生儿败血症,严重者甚至危及生命。传统检查指标由于存在灵敏度和特异度较低,早期升高不明显,且容易受围产期并发症影响等缺点,临床中易造成漏诊或误诊。国外有学者认为感染早期(2~12 h)检测生物标记选IL-6、IL-8、中性粒细胞CD64和TNF-α较好,感染中期(12~24 h)选择PCT更佳,感染后期( > 24 h)选择CRP[4],说明中性粒细胞CD64在细菌感染早期诊断中有重要作用。本研究通过两两比较也发现,中性粒细胞CD64可以显著区别一般感染组与正常对照组,提示中性粒细胞CD64在早期识别细菌感染中的价值优于PCT和CRP。另外,本研究与El Shimi等[26]得出了相似的结果,即中性粒细胞CD64不能区别一般感染与败血症。中性粒细胞CD64在细菌感染早期升高到最高水平,并且维持在相对高浓度水平[4],因此在感染后期不能有效区别一般感染与败血症。van Veen等[27]通过研究发现,在急诊科,中性粒细胞CD64不能有效识别严重细菌感染导致的儿童发热,并指出中性粒细胞CD64检测在严重感染后期的诊断价值较早期感染低。
多中心随机对照研究表明,在急诊科对疑似细菌感染患者选择PCT进行检查,可以使抗生素处方从88%减少到75%[11]。在本研究中,在一般感染组与败血症组之间比较血清CRP、PCT水平发现,差异均有统计学意义,提示在感染中后期,这两项指标的检测可以区别一般细菌感染和败血症。通过比较各种检测指标,我们发现,PCT在新生儿细菌感染诊断方面的灵敏度及诊断准确度(72.97%、79.31%)分别高于CRP(51.35%、67.24%),这与以往的研究结果相似[27],表明PCT对诊断新生儿细菌感染较CRP更精确,结果可信度更高。新型感染指标中性粒细胞CD64的灵敏度及诊断准确度达78.37%和79.31%,均显著高于PCT及CRP,但仍然低于两项感染指标联合检测的诊断价值。本研究显示,联合检测可以弥补单项检测灵敏度和诊断准确度偏低的不足。中性粒细胞CD64与PCT二者联合检测在新生儿细菌感染早期诊断的作用最大,相关灵敏度及准确度分别增至97.29%、89.65%,且阴性预测值达94.11%,可见联合检测比单一检测的诊断价值更可靠,可以显著提高对新生儿细菌感染的鉴别能力。ROC曲线分析显示,中性粒细胞CD64、PCT联合检测的曲线下面积达0.926,高于中性粒细胞CD64、PCT及CRP单项检测,具有高度诊断价值,因此中性粒细胞CD64、PCT二者联合检测在早期诊断新生儿感染方面能优势互补,提高诊断灵敏度,增强诊断效能。
本研究的不足之处:为了早期识别感染患儿,本研究选择的住院患儿病程均少于3 d,导致败血症组患儿样本量相对较少。另外,由于对出生后的健康新生儿血标本采集困难,标本收集受限,所以选择入院治疗的非感染新生儿为对照组,其临床代表价值仍需要进一步验证。
综上所述,中性粒细胞CD64可以早期识别新生儿细菌感染,在临床中联合检测中性粒细胞CD64、PCT可能为更加精准诊断新生儿早期细菌感染提供帮助,为及早抗菌治疗提供有利的临床实验室依据,对降低新生儿细菌感染严重并发症的发生及改善预后具有良好的应用价值。
| [1] | Fitchett EJ, Seale AC, Vergnano S, et al. Strengthening the Reporting of Observational Studies in Epidemiology for Newborn Infection (STROBE-NI): an extension of the STROBE statement for neonatal infection research[J]. Lancet Infect Dis, 2016, 16 (10): e202–e213. DOI:10.1016/S1473-3099(16)30082-2 |
| [2] | Kipfmueller F, Schneider J, Prusseit J, et al. Role of neutrophil CD64 index as a screening marker for late-onset sepsis in very low birth weight infants[J]. PLoS One, 2015, 10 (4): e0124634. DOI:10.1371/journal.pone.0124634 |
| [3] | Delanghe JR, Speeckaert MM. Translational research and biomarkers in neonatal sepsis[J]. Clin Chim Acta, 2015, 451 (Pt A): 46–64. |
| [4] | Bhandari V. Effective biomarkers for diagnosis of neonatal sepsis[J]. J Pediatric Infect Dis Soc, 2014, 3 (3): 234–245. DOI:10.1093/jpids/piu063 |
| [5] | Yang AP, Liu J, Yue LH, et al. Neutrophil CD64 combined with PCT, CRP and WBC improves the sensitivity for the early diagnosis of neonatal sepsis[J]. Clin Chem Lab Med, 2016, 54 (2): 345–351. |
| [6] | 王政力, 余加林. 新生儿败血症诊断新进展[J]. 中国当代儿科杂志, 2013, 15 (3): 236–241. DOI:10.7499/j.issn.1008-8830.2013.03.018 |
| [7] | 赵军育, 姜毅, 侯新琳. 降钙素原在诊断早期新生儿感染中的意义[J]. 实用儿科临床杂志, 2012, 27 (2): 122–124. |
| [8] | Simonsen KA, Anderson-Berry AL, Delair SF, et al. Early-onset neonatal sepsis[J]. Clin Microbiol Rev, 2014, 27 (1): 21–47. DOI:10.1128/CMR.00031-13 |
| [9] | Lynema S, Marmer D, Hall ES, et al. Neutrophil CD64 as a diagnostic marker of sepsis: impact on neonatal care[J]. Am J Perinatol, 2015, 32 (4): 331–336. |
| [10] | Hoffmann JJ. Neutrophil CD64 as a sepsis biomarker[J]. Biochem Med (Zagreb), 2011, 21 (3): 282–290. |
| [11] | Kayange N, Kamugisha E, Mwizamholya DL, et al. Predictors of positive blood culture and deaths among neonates with suspected neonatal sepsis in a tertiary hospital, Mwanza-Tanzania[J]. BMC Pediatr, 2010, 10 : 39. DOI:10.1186/1471-2431-10-39 |
| [12] | Wang K, Bhandari V, Chepustanova S, et al. Which biomarkers reveal neonatal sepsis?[J]. PLoS One, 2013, 8 (12): e82700. DOI:10.1371/journal.pone.0082700 |
| [13] | Matsuki T, Watanabe K, Tanaka R. Genus-and species-specific PCR primers for the detection and identification of bifidobacteria[J]. Curr Issues Intest Microbiol, 2003, 4 (2): 61–69. |
| [14] | 刘朝军, 沈定霞. 16SrDNA序列测定在细菌鉴定中的应用[J]. 军医进修学院学报, 2011, 32 (7): 774–776. |
| [15] | de Jong E, de Lange DW, Beishuizen A, et al. Neutrophil CD64 expression as a longitudinal biomarker for severe disease and acute infection in critically ill patients[J]. Int J Lab Hematol, 2016, 38 (5): 576–584. DOI:10.1111/ijlh.2016.38.issue-5 |
| [16] | Pradhan R, Jain P, Paria A, et al. Ratio of neutrophilic CD64 and monocytic HLA-DR: A novel parameter in diagnosis and prognostication of neonatal sepsis[J]. Cytometry B Clin Cytom, 2016, 90 (3): 295–302. DOI:10.1002/cyto.v90.3 |
| [17] | Ten OJ, Netea MG, Kullberg BJ. Utility of immune response-derived biomarkers in the differential diagnosis of inflammatory disorders[J]. J Infect, 2016, 72 (1): 1–18. DOI:10.1016/j.jinf.2015.09.007 |
| [18] | Naess A, Nilssen SS, Mo R, et al. Role of neutrophil to lymphocyte and monocyte to lymphocyte ratios in the diagnosis of bacterial infection in patients with fever[J]. Infection, 2017, 45 (3): 299–307. DOI:10.1007/s15010-016-0972-1 |
| [19] | 蔡群, 徐美玉. 中性粒细胞CD64在儿童社区获得性肺炎诊断中的价值[J]. 中国当代儿科杂志, 2012, 14 (11): 819–822. |
| [20] | Cortegiani A, Russotto V, Montalto F, et al. Neutrophil CD64 as a marker of infection in patients admitted to the emergency department with acute respiratory failure[J]. Open Access Emerg Med, 2014, 6 : 37–44. |
| [21] | 徐茜茜, 陈灵芝, 徐海滨, 等. CD64在新生儿感染诊断中的价值[J]. 临床儿科杂志, 2006, 24 (3): 185–187. |
| [22] | Sandquist M, Wong HR. Biomarkers of sepsis and their potential value in diagnosis, prognosis and treatment[J]. Expert Rev Clin Immunol, 2014, 10 (10): 1349–1356. DOI:10.1586/1744666X.2014.949675 |
| [23] | Miyake F, Ishii M, Hoshina T, et al. Analysis of the physiological variation in neutrophil CD64 expression during the early neonatal period[J]. Am J Perinatol, 2016, 33 (14): 1377–1381. DOI:10.1055/s-0036-1583191 |
| [24] | Shi J, Tang J, Chen D. Meta-analysis of diagnostic accuracy of neutrophil CD64 for neonatal sepsis[J]. Ital J Pediatr, 2016, 42 (1): 57. DOI:10.1186/s13052-016-0268-1 |
| [25] | 余加林, 吴仕孝. 败血症[M]//邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学. 第4版. 北京: 人民卫生出版社, 2011: 340-347. |
| [26] | El Shimi MS, Abou Shady NM, Hamed GM, et al. Significance of neutrophilic CD64 as an early marker for detection of neonatal sepsis and prediction of disease outcome[J]. J Matern Fetal Neonatal Med, 2017, 30 (14): 1709–1714. DOI:10.1080/14767058.2016.1223030 |
| [27] | van Veen M, Nijman RG, Zijlstra M, et al. Neutrophil CD64 expression is not a useful biomarker for detecting serious bacterial infections in febrile children at the emergency department[J]. Infect Dis (Lond), 2016, 48 (5): 331–337. DOI:10.3109/23744235.2015.1118156 |
 2017, Vol. 19
2017, Vol. 19