2. 解放军陆军总医院放射诊断科, 北京 100700;
3. 苏州大学附属儿童医院新生儿科, 江苏 苏州 215000
胎儿生长受限(fetal growth restriction, FGR)是指因孕妇、胎盘、胎儿等因素造成的胎儿宫内未达到基因决定的理想生长潜能,生后常表现为小于胎龄儿(small gestational age, SGA),发生率达9%~15%[1-2]。FGR不但导致胎儿出生体重低,对胎儿脑发育也造成影响。Liu等[3]通过透射电镜发现FGR可导致胎鼠脑皮质结构紊乱、脑细胞凋亡增加、神经元数量减少等损害。Samuelsen等[4]利用光学分馏器检测FGR患儿大脑神经元数量,发现皮质、皮质边缘区、海马和小脑等神经元数量显著减少,神经细胞增殖速度也明显慢于适于胎龄儿。胎儿生长受限可对神经元发育造成严重不良影响,但是否导致脑白质发育障碍,相关报道尚少见。
磁共振弥散张量成像(diffusion tensor imaging,DTI)是迄今唯一可在活体无创性评价脑白质的成像技术[5-6],其通过比较DTI序列的参数如各向异性分数(fractional anisotropy, FA)、平均弥散系数(mean diffusivity, MD)、平行弥散系数(longitudinal diffusivity, λ//)、垂直弥散系数(radial diffusivity, λ⊥)的变化,定量评价FGR患儿脑白质的发育状况。为此,本研究对28例宫内生长受限的足月新生儿进行头颅DTI序列扫描的前瞻性研究,并与15例足月适于胎龄儿(appropriate for gestational age, AGA)比较,以初步了解宫内生长受限是否影响胎儿脑白质发育。
1 资料与方法 1.1 研究对象以2013年7月至2015年3月期间八一儿童医院新生儿监护中心住院、出生胎龄37~40+6周的小于胎龄儿28例(男15例、女13例)为研究对象,出生体重均低于同胎龄、同性别出生体重的第十百分位;并以同期出生、同期住院的足月适于胎龄儿15例(男8例、女7例)作为对照组,出生体重位于第25~75百分位。为除外胎龄因素及生后环境因素对脑白质发育的可能影响,本研究以足月儿为研究对象,两组均在生后7 d内因诊疗需要(如需排除颅内出血、颅脑畸形、缺氧缺血性脑病、胆红素脑病、颅内感染等)行头颅磁共振及DTI序列扫描。本研究获得医院伦理委员会批准及家长知情同意。
1.2 扫描参数及观察指标使用仪器为GE 3.0 T Discovery 750 MR扫描仪,运用8通道头线圈完成图像扫描。
扫描序列及参数:DTI 25个方向,脉冲序列重复时间(TR)6 000 ms,回波时间(TE)95 ms,层厚2 mm,无间隔扫描,FOV 180 mm×180 mm,矩阵256×256,体素大小0.70 mm×0.70 mm×4.00 mm。
所有MR图像判读均由2名具有丰富儿科影像诊断经验的放射科医师采用双盲法独立完成,对于磁共振提示明确脑损伤的予以剔除。当两人判读结果不一致时,则重复阅片后讨论诊断。
1.3 图像处理与分析采用FSL软件TBSS流程进行分析[7-8](1)对DTI数据进行涡流校正处理,减少对脑白质参数的干扰,经FIT工具计算出全脑FA、MD、λ//、λ⊥参数图;(2)建立足月儿标准FA模板,将所有患儿的FA图非线性配准到已建立的足月儿标准FA模板上,生成平均FA纤维束骨架图;(3)将配准后的FA图投射到平均FA纤维束骨架内生成各组FA骨架,全脑白质相关区域共计生成122个脑区;(4)将所有受试者图像依次非线性配准到MD、λ⊥、λ//图,生成各自配准后参数图,并将之投射到平均FA纤维束骨架上,进而比较是否具有差异性;(6)各参数图比较的结果通过FSL Viewer工具叠加到足月儿FA模板上,显示有差异的区域,提取并记录这些区域的相应数值。
FA值、MD值、λ//值、λ⊥值各参数的临床意义[9-11]:
(1)FA值:评价脑白质纤维束最主要的参数,反映脑白质的发育程度,是各向异性弥散与整体弥散的比值,结果介于0~1之间,FA值越高,提示脑白质纤维束成熟度越高。
(2)MD值:反映脑白质纤维束发育成熟度,是脑白质纤维束内水分子各方向弥散速率的平均值,MD值升高表示自由水含量增多。
(3)λ//值:反映白质纤维束及髓鞘发育的完整度、连续性,以及脑白质纤维束内与白质纤维束走形方向平行的水分子弥散值,λ//值升高反映脑白质纤维束发育的连续性差。
(4)λ⊥值:反映白质纤维束及髓鞘发育的通透度及紧密性,是脑白质纤维束内与白质纤维束走形方向垂直的水分子弥散值,λ⊥值升高反映脑白质纤维束发育的紧密性差。
1.4 统计学分析采用SPSS 16.0统计软件进行数据处理。正态分布的计量资料采用均数±标准差(x±s)表示,方差齐者采用t检验或单因素分析;非正态分布计量资料以中位数四分位数间距差值[M(QR)]表示,多组间比较采用Kruskal-Wallis H检验,两组间比较使用Nemenyi法。P < 0.05差异有统计学意义。
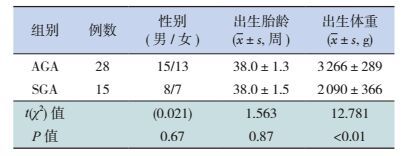
2 结果 2.1 两组新生儿基本资料比较43例符合研究条件,其中SGA组的出生体重低于AGA组(P < 0.05),两组出生胎龄及性别构成比的差异无统计学意义(P > 0.5),见表 1。
| 表 1 SGA组与AGA组新生儿基本资料 |
2.2 两组新生儿全脑白质的DTI参数比较
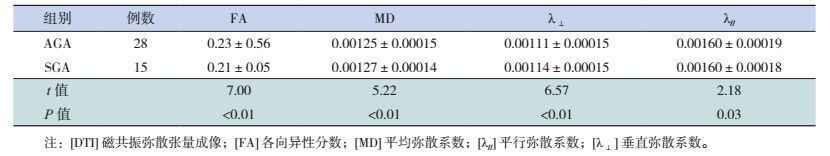
两组DTI参数的FA值、MD、λ⊥、λ//值差异具有统计学意义(P < 0.01),见表 2。
| 表 2 SGA组与AGA组新生儿全脑白质的DTI参数比较(x±s,×10-3 mm2s-1) |
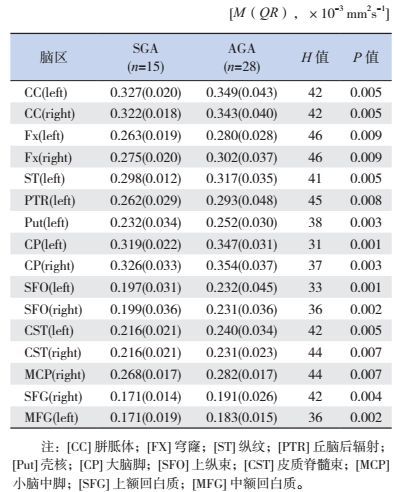
与AGA组相比,SGA组的FA值在下列脑区显著下降(P < 0.01):如右侧大脑胼胝体(CC)、穹窿(FX)、纵纹(ST)、丘脑后辐射(PTR)、壳核(Put)、大脑脚(CP)、上纵束(SFO)、皮质脊髓束(CST)、小脑中脚(MCP)、上额回白质(SFG);左侧大脑胼胝体(CC)、穹窿(FX)、大脑脚(CP)、上纵束(SFO)、皮质脊髓束(CST)、中额回白质(MFG)。见表 3。
| 表 3 SGA组与AGA组存在差异的各脑区FA值 |
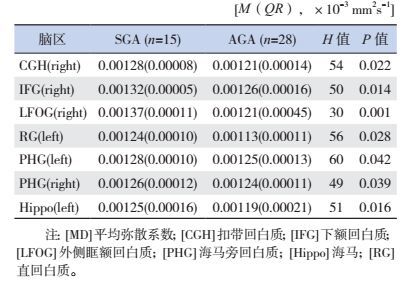
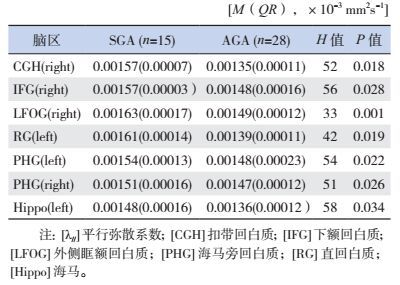
与AGA组相比,SGA患儿MD值在下列脑区显著升高(P < 0.05):如右侧大脑扣带回白质(CGH)、下额回白质(IFG)、外侧眶额回白质(LFOG)、海马旁回白质(PHG);左侧大脑海马(Hippo)、直回白质(RG)、海马旁回白质(PHG)。见表 4。
| 表 4 SGA组与AGA组存在差异的各脑区MD值 |
与AGA患儿相比,SGA患儿在下列脑区λ//值显著升高(P < 0.05):如右侧大脑扣带回白质(CGH)、下额回白质(IFG)、外侧眶额回白质(LFOG)、海马旁回白质(PHG);左侧大脑:直回白质(RG)、海马旁回白质(PHG)、海马(Hippo)。见表 5。
| 表 5 SGA组与AGA组λ//值存在差异的各脑区λ//值 |
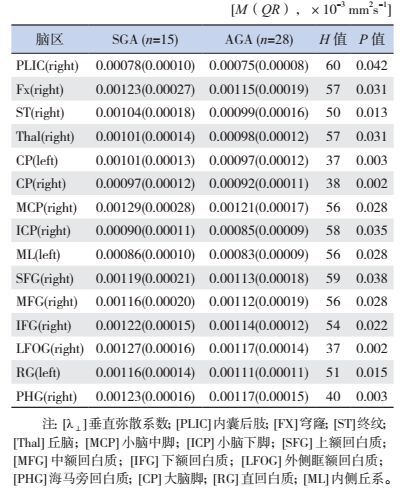
与AGA患儿相比,SGA患儿在下列脑区λ⊥值显著升高(P < 0.05):如右侧大脑内囊后肢(PLIC)、穹窿(FX)、终纹(ST)、丘脑(Thal)、小脑中脚(MCP)、小脑下脚(ICP)、上额回白质(SFG)、中额回白质(MFG)、下额回白质(IFG)、外侧眶额回白质(LFOG)、海马旁回白质(PHG)、大脑脚(CP);左侧大脑直回白质(RG)、内侧丘系(ML)、大脑脚(CP)。见表 6。
| 表 6 SGA组与AGA组存在差异的各脑区λ⊥值 |
3 讨论
DTI可无创定量评价脑白质纤维,目前已应用于新生儿脑发育的评价[12-14]。婴幼儿随年龄增长,脑白质髓鞘化逐步完善,表现为DTI的FA值增加,MD、λ⊥、λ//值降低[15]。这一点在动物实验研究也得到了证实,如Shi等[16]通过DTI技术观察25只灵长类动物恒河猴的脑成熟过程,发现随年龄增长,其脑白质FA值逐步升高,MD值则逐步降低。而FA值下降提示着脑白质纤维发育异常(如结构紊乱、成熟度低),若同时伴MD、λ⊥、λ//值增高,则提示脑白质纤维髓鞘化障碍或损伤较严重,预示远期预后差[17]。
本研究采用无创DTI技术,发现SGA患儿与AGA患儿的脑白质发育存在差异,主要表现在SGA患儿胼胝体、纵纹、丘脑后辐射、壳核、上纵束、皮质脊髓束、小脑中脚、中额回白质等脑区FA值下降,内囊后肢、终纹、丘脑、小脑中脚、小脑下脚、中额回白质、下额回白质、内侧丘系、大脑脚等脑区λ⊥值升高,海马λ//值升高;而穹窿、大脑脚、上额回白质区域FA值降低的同时伴λ⊥值升高,海马旁回白质、海马、扣带回白质、下额回白质、外侧眶额回白质区MD、λ//值同时升高,而外侧眶额回白质、直回白质、海马旁回白质区域MD、λ⊥、λ//值同时升高。提示不同脑区存在不同程度异常,证实胎儿生长受限影响颅脑白质的发育。
脑白质发育的过程即白质纤维的髓鞘化,始于宫内,易受宫内环境等多种因素影响,部分重要的脑白质区域发育异常对患儿预后影响较大。本研究SGA患儿的FA值在胼胝体、穹窿、纵纹、丘脑后辐射、壳核、大脑脚、上纵束、皮质脊髓束、小脑中脚、上额回白质、中额回白质等脑白质区域显著下降,提示此部分脑白质存在发育异常,而这部分脑区白质具有重要的功能,如胼胝体由前向后可分为嘴、膝、体及压部,与大脑的额、顶、颞、枕叶之间有着密切联系,起连接两侧大脑半球的重要作用,对两侧大脑半球之间感觉、运动、认知等功能传递起重要的作用,其损伤常导致运动及认知功能障碍,而其损伤还可连带颅脑中线区域如穹窿、海马、扣带回白质受影响,这也可以解释为什么SGA儿运动及认知功能常落后于AGA[18]。皮质脊髓束负责连接大脑皮层的运动神经区与脊髓,控制肢体的自主、不自主运动等[19]。本研究SGA患儿皮质脊髓束及其连接的大脑脚FA值均较AGA组降低,可能导致肢体运动协调的障碍等。SGA患儿穹窿、大脑脚、上额回白质脑区FA值降低的同时伴λ⊥值升高,可能与髓鞘化不良或少突胶质前体细胞损伤造成脑白质纤维结构紊乱,髓鞘紧密性降低有关[20]。海马旁回白质、海马、扣带回白质、下额回白质、外侧眶额回白质脑区MD值、λ//值显著增加,提示这些白质纤维束自由水含量增多,白质纤维束髓鞘连续性差;外侧眶额回白质、直回白质、海马旁回白质的MD值、λ⊥值、λ//值同时升高,也提示这些脑区白质纤维束自由水含量较多,同时连续性及紧密性均较差。
脑白质髓鞘是由少突胶质细胞胞膜沿轴突缠绕而成的复合双层类脂质结构,对神经纤维束起保护作用。而髓鞘化则是少突胶质前体细胞分化成熟、转化为髓鞘的过程[21]。组织缺氧、缺血可损害少突胶质细胞,阻碍髓鞘化进程,甚至破坏已完成髓鞘化的白质纤维束[22]。DTI参数的改变可客观反映髓鞘化水平,且这种改变可延续至学龄前甚至青春期[23-24]。FA值可反映脑白质髓鞘化程度,本研究部分足月小于胎龄儿的脑区存在MD值、λ⊥值或者λ//值的改变,但无FA值的改变,推测损伤可能仅导致了部分白质轴索排列紊乱,未对脑白质纤维束及髓鞘造成严重伤害,这可能与后期的追赶性生长有关。
本研究发现,不同脑区FA值的改变规律与脑白质发育规律相符:即由背侧向腹侧、由尾侧向头侧、由中心到四周,SGA患儿FA值下降以深部白质为主,可能与深部白质髓鞘化开始早,早期受易缺氧、缺血等影响有关。与Nossin-Manor等[25]研究基本相符,应用DTI技术观察54例平均胎龄29.0±2.0周的早产儿,在生后2周内行头颅DTI扫描,并在纠正胎龄足月时复查头颅DTI,证实脑白质发育存在一定规律:(1)不同部位髓鞘化开始时间不同,如背侧脑桥和脑室丘脑核28周之前开始、苍白球28周开始、内囊白质36周左右开始等;(2)大脑的灰质、白质含水量与细胞密度存在差异;(3)不同部位轴突的密度不同:如灰质高于白质、丘脑高于内囊后肢等。
DTI技术可在活体、非侵入性地检测脑白质纤维结构,相较于传统磁共振,对人体组织中自由水分子运动更为敏感,且能早于髓鞘形成、定量评价白质纤维束发育,为研究新生儿脑发育提供量化指标。本研究只评价了生后7天内新生儿的脑白质参数,且样本量有限,新生儿再生能力较强,随着年龄的增长其参数可能会出现变化,动态评估和长期随访具有重要价值,这也是将来的工作重点。
| [1] | 王晓凤, 曾军安, 刘敬, 等. 胎儿宫内生长受限发生率调查及其对胎儿-新生儿健康危害的研究[J]. 中国儿童保健杂志, 2013, 21 (10): 1020–1023. |
| [2] | Longo S, Bolani L, Decembrino L, et al. Short-term and long-term sequelae in intrauterine growth retardation (IUGR)[J]. J Matern Fetal Neonatal Med, 2013, 26 (3): 222–225. DOI:10.3109/14767058.2012.715006 |
| [3] | Liu J, Liu L, Chen H. Antenatal taurine supplementation for improving brain ultrastructure in fetal rats with intrauterine growth restriction[J]. Neurosci, 2011, 181 : 265–270. DOI:10.1016/j.neuroscience.2011.02.056 |
| [4] | Samuelsen GB, Pakkenberg B, Bogdanović N, et al. Severe cell reduction in the future brain cortex in human growth-restricted fetuses and infants[J]. Am J Obstet Gynecol, 2007, 197 (1): 56.e1–7. DOI:10.1016/j.ajog.2007.02.011 |
| [5] | van Pul C, van Kooij BJ, de Vries LS, et al. Quantitative fiber tracking in the corpus callosum and internal capsule reveals microstructural abnormalities in preterm infants at term-equivalent age[J]. AJNR Am J Neuroradiol, 2012, 33 (4): 678–684. DOI:10.3174/ajnr.A2859 |
| [6] | Liu Y, Aeby A, Balériaux D, et al. White matter abnormalities are related to microstructural changes in preterm neonates at term-equivalent age: a diffusion tensor imaging and probabilistic tractography study[J]. AJNR Am J Neuroradiol, 2012, 33 (5): 839–845. DOI:10.3174/ajnr.A2872 |
| [7] | Estrin GL, Kyriakopoulou V, Makropoulos A, et al. Altered white matter and cortical structure in neonates with antenatally diagnosed isolated ventriculomegaly[J]. Neuroimage Clin, 2016, 11 : 139–148. DOI:10.1016/j.nicl.2016.01.012 |
| [8] | Oishi K, Mori S, Donohue PK, et al. Multi-contrast human neonatal brain atlas: application to normal neonate development analysis[J]. Neuroimage, 2011, 56 (1): 8–20. DOI:10.1016/j.neuroimage.2011.01.051 |
| [9] | Berman JI, Mukherjee P, Partridge SC, et al. Quantitative diffusion tensor MRI fiber tractography of sensorimotor white matter development in premature infants[J]. Neuroimage, 2005, 27 (4): 862–871. DOI:10.1016/j.neuroimage.2005.05.018 |
| [10] | Uluğ AM, van Zijl PC. Orientation-independent diffusion imaging without tensor diagonalization: Anisotropy definitions based on physical attributes of the diffusion ellipsoid[J]. J Magn Reson Imaging, 1999, 9 (6): 804–813. DOI:10.1002/(ISSN)1522-2586 |
| [11] | Chen Y, An H, Zhu H, et al. Longitudinal regression analysis of spatial–temporal growth pattern of geometrical diffusion measures in early postnatal brain development with diffusiontensor imaging[J]. Neuroimage, 2011, 58 (4): 993–1005. DOI:10.1016/j.neuroimage.2011.07.006 |
| [12] | Brissaud O, Amirault M, Villega F, et al. Efficiency of fractional anisotropy and apparent diffusion coefficient on diffusion tensor imaging in prognosis of neonates with hypoxic-ischemic encephalopathy: a methodologic prospective pilot study[J]. AJNR Am J Neuroradio, 2010, 31 (2): 282–287. DOI:10.3174/ajnr.A1805 |
| [13] | Ancora G, Testa C, Grandi S, et al. Prognostic value of brain proton MR spectroscopy and diffusion tensor imaging in newborns with hypoxic-ischemic encephalopathy treated by brain cooling[J]. Neuroradiology, 2013, 55 (8): 1017–1025. DOI:10.1007/s00234-013-1202-5 |
| [14] | Bonifacioa SL, Saporta A, Glass HC, et al. Therapeutic hypothermia for neonatal encephalopathy results in improved microstructure and metabolism in the deep gray nuclei[J]. AJNR Am J Neuroradiol, 2012, 33 (11): 2050–2055. DOI:10.3174/ajnr.A3117 |
| [15] | Snook L, Paulson LA, Roy D, et al. Diffusion tensor imaging of neurodevelopment in children and young adults[J]. Neuroimage, 2005, 26 (4): 1164–1173. DOI:10.1016/j.neuroimage.2005.03.016 |
| [16] | Shi Y, Short SJ, Knickmeyer RC, et al. Styner diffusion tensor imaging based characterization of brain neurodevelopment in primates[J]. Cereb Cortex, 2013, 23 (1): 36–48. DOI:10.1093/cercor/bhr372 |
| [17] | Skiöld B, Horsch S, Hallberg B, et al. White matter changes in extremely preterminfants, a population-based diffusion tensor imaging study[J]. Acta Paediatr, 2010, 99 (6): 842–849. DOI:10.1111/apa.2010.99.issue-6 |
| [18] | Uda S, Matsui M, Tanaka C, et al. Normal development of human brain white matter from infancy to early adulthood: a diffusion tensor imaging study[J]. Dev Neurosci, 2015, 37 (2): 182–194. DOI:10.1159/000373885 |
| [19] | Montgomery LR, Herbert WJ, Buford JR. Recruitment of ipsilateral and contralateral upper limb muscles following stimulation of the cortical motor areas in the monkey[J]. Exp Brain Res, 2013, 230 (2): 153–164. DOI:10.1007/s00221-013-3639-5 |
| [20] | Provenzale JM, Liang L, DeLong D, et al. Diffusion tensor imaging assessment of brain white matter maturation during the first postnatal year[J]. AJR Am J Roentgenol, 2007, 189 (2): 476–486. DOI:10.2214/AJR.07.2132 |
| [21] | Deoni SC, Mercure E, Blasi A, et al. Mapping infant brain myelination with magnetic resonance imaging[J]. J Neurosci, 2011, 31 (2): 784–791. DOI:10.1523/JNEUROSCI.2106-10.2011 |
| [22] | James A, Christian Z, Riddle A, et al. Central axons preparing to myelinate are highly sensitivity to ischemic injury[J]. Ann Neurol, 2012, 72 (6): 936–951. DOI:10.1002/ana.23690 |
| [23] | Hasegawa T, Yamada K, Morimoto M, et al. Development of corpus callosum in preterm infants is affected by the prematurity: in vivo assessment of diffusion tensor imaging at term-equivalent age[J]. Pediatr Res, 2011, 69 (3): 249–254. DOI:10.1203/PDR.0b013e3182084e54 |
| [24] | Mullen KM, Vohr BR, Katz KH, et al. Preterm birth results in alterations in neural connectivity at age 16 years[J]. Neuroimage, 2011, 54 (4): 2563–2570. DOI:10.1016/j.neuroimage.2010.11.019 |
| [25] | Nossin-Manor R, Card D, Morris D, et al. Quantitative MRI in the very preterm brain: assessing tissue organization and myelination using magnetization transfer, diffusion tensor and T1 imaging[J]. Neuroimage, 2013, 64 : 505–516. DOI:10.1016/j.neuroimage.2012.08.086 |
 2017, Vol. 19
2017, Vol. 19