2. 上海市宝山区罗店医院儿科, 上海 201908
急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)是儿童最为常见的恶性肿瘤,5年以上长期无病生存(long-term disease free survival, L-DFS)率已达到80%以上[1-2]。中枢神经系统白血病(central nervous system leukemia, CNSL)防治是儿童ALL获得良好预后的重要措施之一,主要包括头颅放疗、静脉输注大剂量甲氨蝶呤(high dose methotrexate,HD-MTX)和鞘内注射化疗等[2-4]。有文献报道,HD-MTX等化疗可能对L-DFS ALL患儿的神经认知功能和生存质量产生不良影响[5-7]。本课题组前期研究[8-11]也显示,血液肿瘤患儿在整个病程和序贯化疗期间存在明显心理行为和躯体功能异常,并有随化疗时间延长而加重的倾向。而国内尚无关于L-DFS ALL患儿的神经认知功能及其影响因素的研究。本研究采用中国修订韦氏儿童智力量表(Chinese Wechsler intelligence scale for children, C-WISC)、持续性操作测验(continuous performance test,CPT)及Stroop测试软件,对已获L-DFS的ALL儿童进行神经认知功能及其相关影响因素进行探讨。
1 资料与方法 1.1 研究对象选择符合儿童ALL诊断标准[12]并已获得L-DFS的ALL儿童40例作为研究对象,其中男性21例、女性19例,标危、中危和高危ALL分别为20例、11例和9例。初诊年龄平均为4.3±2.8岁(1~8岁),获得L-DFS后进行神经认知功能评估时的平均年龄为10.9±2.2岁(7~15岁),自初诊至评估的平均间隔时间为6.6±1.3年。家庭年收入 < 8万元计为低收入,≥8万元为中等收入。入组标准:(1)通过序贯化疗获得持续完全缓解(CCR)5年或以上;(2)无CNSL病史;(3)评估时年龄在7~15岁之间,能够配合软件测试。排除标准:(1)根据诸福棠实用儿科学[13]相关疾病诊断标准,排除既往有影响行为发育的神经系统疾病,如脑瘫、精神发育迟滞和唐氏综合征等;(2)白血病复发;(3)接受造血干细胞移植。对照组40例为上海某学校的健康儿童,男22例、女18例,平均年龄10.9±2.3岁(7~15岁)。本研究获得研究对象监护人的知情同意。
已获得L-DFS的ALL儿童采用的同济95方案化疗[14]。CNSL防治主要措施为HD-MTX和鞘内注射,标危型和中高危型ALL分别接受3 g/m2和5 g/m2的HD-MTX化疗,MTX累积剂量分别为24~40 g/m2,HD-MTX治疗中均进行MTX血药浓度监测及四氢叶酸钙解救[14]。
1.2 儿童神经认知功能评定采用C-WISC、CPT以及Stroop字色干扰测验进行神经认知功能综合评定。
C-WISC共11个分测验,其中6个言语测验、5个操作测验。由分测验的粗分(原始分)换算成年龄量表分,然后换算成智商(intelligence quotient, IQ)[15]。韦氏量表的IQ分3种,包括言语智商(verbal intelligence quotient, VIQ)、操作智商(performance intelligence quotient, PIQ)和全智商(full intelligence quotient, FIQ)。所有测验由两名具有心理测量专业技能的医生完成。
CPT用于评估视觉注意能力,测试软件为云鲁科技设计。受试者在清醒、放松状态下及光线充足、安静环境中进行,单个数字检测法和多个数字检测法轮替进行,测试时间为12 min。
Stroop字色干扰测查抗干扰能力,软件为云鲁科技设计。屏幕随机呈现多种不同颜色文字,形式包括字色一致、字色矛盾、字色无关,受试者对屏幕上4种颜色进行点击,时间共2 min。
CPT和Stroop检测结果判定:正确,受试儿童能够及时和正确点击目标;漏答,在反应时间内未能及时点击目标;错误,未能正确点击。测试完成后显示测试的正确数、漏答数和错误数。
1.3 统计学分析用SPSS 22.0软件进行数据处理。计数资料以百分率(%)表示,组间比较采用χ2检验;计量资料用均数±标准差(x±s)表示,组间比较采用t检验;影响因素分析采用多元回归分析。P < 0.05为差异有统计学意义。
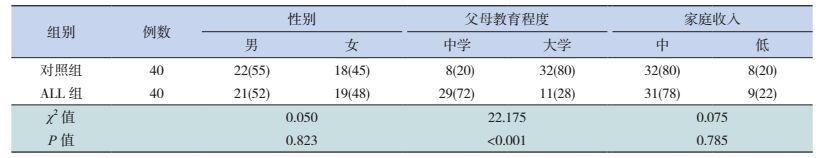
2 结果 2.1 L-DFS ALL组和对照组的一般资料比较对照组儿童的性别构成、年龄和家庭收入等与ALL组的差异均无统计学意义(P > 0.05);ALL组17例(42%)来自中小城市,23例(58%)来自农村,对照组均来自上海市;ALL组化疗期间失学24~36个月;对照组父母受教育程度较高(P < 0.01)。见表 1。
| 表 1 长期无病生存的ALL组和健康对照组的一般资料[例(%)] |
2.2 L-DFS的ALL组与对照组儿童C-WISC结果比较
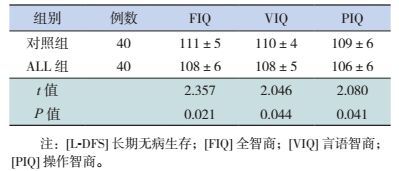
L-DFS ALL组的FIQ,VIQ和PIQ得分均明显低于对照组(P < 0.05),见表 2。
| 表 2 L-DFS的ALL组和对照组韦氏儿童智力测验FIQ、VIQ、PIQ结果比较(x±s) |
2.3 L-DFS ALL组与对照组的CPT结果比较
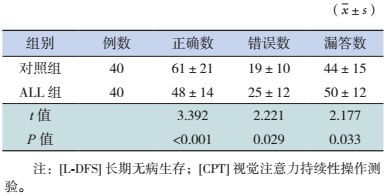
L-DFS ALL组CPT测试正确数低于对照组,错误数及漏答数高于对照组,差异有统计学意义(P < 0.05)。见表 3。
| 表 3 L-DFS的ALL组和对照组CPT测试结果比较 |
2.4 L-DFS的ALL组与对照组儿童Stroop测试结果比较
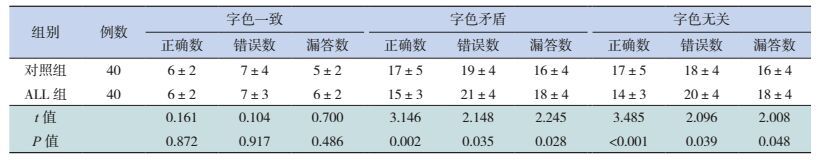
L-DFS ALL组的Stroop测试中字色一致的正确数、错误数、漏答数与对照组的差异无统计学意义(P > 0.05);字色矛盾及字色无关的正确数低于对照组,错误数、漏答数高于对照组,差异均有统计学意义(P < 0.05)。见表 4。
| 表 4 长期无病生存ALL组和对照组的Stroop测试结果比较(x±s) |
2.5 L-DFS ALL儿童神经认知功能影响因素分析
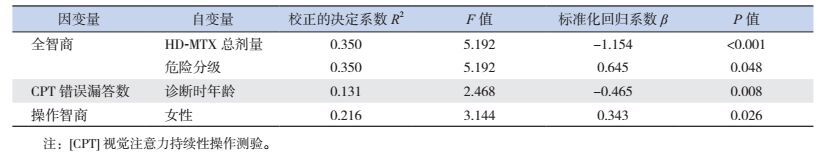
ALL危险分级、HD-MTX总剂量与智商降低相关(P < 0.05);ALL诊断时的年龄与CPT漏答数相关(P < 0.01);女性操作智商较低(P < 0.05)。见表 5。
| 表 5 长期无病生存ALL儿童神经认知功能相关因素的多元回归分析 |
3 讨论
随着医疗技术的发展,儿童白血病治愈率逐步提高,对其生存质量和心理状态的研究也日趋深入。家长在被告知病情后,常出现强烈的情绪应激反应,在一定程度上对患儿情绪造成负面影响。而治疗过程的疲乏、恶心、呕吐、感染等不良反应可导致年长儿出现焦虑、烦躁、抑郁等消极情绪反应,所以对已经获得L-DFS的ALL康复儿童开展心理评估很有必要。
中枢神经系统白血病防治对于提高儿童ALL长期无病生存率起到重要作用。但有研究认为,HD-MTX可降低细胞内叶酸含量、增高中枢神经系统兴奋性氨基酸浓度,并使DNA自我修复能力下降,血管收缩、脑血流量减少,从而导致神经认知功能障碍[16-17]。Iyer等[18]对获得L-DFS的白血病儿童认知功能进行评估,发现他们的言语智商、操作智商和全智商等低于对照组。本研究显示,已获得L-DFS ALL儿童的FIQ,VIQ和PIQ得分也低于对照组,而且智商降低与ALL危险分级、HD-MTX的总剂量相关,与文献报道一致。提示高强度的中枢神经系统防治对ALL患儿的远期智力可能有一定的影响。
注意力是认知功能的重要组成部分,持续注意是认知功能的基础。CPT用于评估视觉注意能力,漏答率高说明难以维持稳定的注意力水平,错误率反映受试者注意功能准确性的高低[19]。Stroop测试主要反映对信息的自动加工和控制加工能力,对轻度认知功能障碍的患儿有很好的筛查性[20-23]。本研究采用的CPT、Stroop测试软件由第三军医大学心理学及计算机专家联合开发,信度和效度已经全国20多家三甲医院10余年实践验证。本研究显示,L-DFS ALL组的错误数及漏答数高于对照组,表明获得L-DFS的ALL儿童可能存在持续性注意和冲动控制缺陷;Stroop测试显示,字色一致错误数、漏答数与对照组的差异无统计学意义;字色矛盾及字色无关的错误数、漏答数高于对照组,表明长期无病生存ALL儿童可能存在选择性注意、信息加工处理和冲动控制缺陷。有研究[5-6]报道,长期无病生存白血病儿童可出现较严重的执行功能、持久注意力、记忆力等方面的损害。本研究L-DFS ALL组的C-WISC的FIQ,VIQ和PIQ得分以及CPT测试正确数、Stroop测试的字色矛盾及字色无关的正确数均明显低于对照组。与文献报道基本一致。
国外研究[24-25]显示,女童对化疗的神经毒性更为敏感,可能与女童的脑白质增量较少,儿童期各脑区髓鞘化比率也存在性别差异有关。本研究L-DFS ALL女性操作智商较低,而且ALL诊断时的年龄与CPT漏答数、错误数相关。这可能是由于大脑皮层灰质在4岁达发育顶峰,故低年龄ALL患儿较年长儿更易发生认知功能缺陷[26]。
值得注意的是,本研究的白血病患儿来自全国各城市或农村,父母文化程度不一,难以获得与研究对象类似的对照组,可能使研究结果出现偏差。进一步开展多中心临床协作研究可获得更为全面客观的结果。
本研究显示长期无病生存ALL患儿存在神经认识功能损害,可能与性别、诊断时年龄,危险分级,HD-MTX的总剂量相关。因此,定期评估L-DFS ALL神经认知功能、早期监测治疗相关的神经毒性,以指导临床制定个体化干预措施、提高患儿生存质量,对患儿重返社会、健康生活具有重要意义,也为今后有效开展儿童血液肿瘤神经心理研究提供参考。
| [1] | 儿童急性淋巴细胞性白血病诊疗研究协作组. 上海儿童医学中心急性淋巴细胞性白血病2005方案疗效多中心研究[J]. 中华儿科杂志, 2013, 51 (7): 495–503. |
| [2] | Cooper SL, Brown PA. Treatment of pediatric acute lymphoblastic leukemia[J]. Pediatr Clin North Am, 2015, 62 (1): 61–73. DOI:10.1016/j.pcl.2014.09.006 |
| [3] | 吴敏媛, 李志光, 李志刚. 儿童急性淋巴细胞性白血病治疗策略的思考[J]. 中华儿科杂志, 2010, 48 (3): 161–165. |
| [4] | Campbell LK, Scaduto M, Sharp W, et al. A meta-analysis of the neurocognitive sequelae of treatment for childhood acute lymphocytic leukemia[J]. Pediatr Blood Cancer, 2007, 49 (1): 65–73. DOI:10.1002/(ISSN)1545-5017 |
| [5] | Cheung YT, Krull KR. Neurocognitive outcomes in long-term survivors of childhood acute lymphoblastic leukemia treated on contemporary treatment protocols: A systematic review[J]. Neurosci Biobehav Rev, 2015, 53 : 108–120. DOI:10.1016/j.neubiorev.2015.03.016 |
| [6] | Ki Moore IM, Hockenberry MJ, Krull KR. Cancer-related cognitive changes in children, adolescents and adult survivors of childhood cancers[J]. Semin Oncol Nurs, 2013, 29 (4): 248–259. DOI:10.1016/j.soncn.2013.08.005 |
| [7] | Essig S, Li Q, Chen Y, et al. Risk of late effects of treatment in children newly diagnosed with standard-risk acute lymphoblastic leukemia: a report from the Childhood Cancer Survivor Study Cohort[J]. Lancet Oncol, 2014, 15 (8): 841–851. DOI:10.1016/S1470-2045(14)70265-7 |
| [8] | 傅晓燕, 谢晓恬, 梅竹. 结构式家庭治疗对血液肿瘤患儿家庭结构与功能的影响[J]. 中国当代儿科杂志, 2014, 16 (9): 905–909. DOI:10.7499/j.issn.1008-8830.2014.09.008 |
| [9] | 宋婷婷, 傅晓燕, 谢晓恬. 血液病或肿瘤患儿生存质量及行为问题的初步调查[J]. 临床精神医学杂志, 2013, 23 (1): 55–57. |
| [10] | 宋婷婷, 傅晓燕, 谢晓恬. 血液病或肿瘤患儿家长心理状况研究[J]. 中国小儿血液与肿瘤杂志, 2013, 18 (6): 264–266. |
| [11] | 赵磊. 儿童白血病运动与功能康复研究进展[J]. 中国小儿血液与肿瘤杂志, 2013, 18 (5): 238–240. |
| [12] | 中华医学会儿科学分会血液学组. 儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[J]. 中华儿科杂志, 2006, 44 (5): 392–395. |
| [13] | 秦炯, 林庆. 精神发育迟滞和脑性瘫痪[M]//江载芳, 申昆玲, 沈颖. 诸福棠实用儿科学. 第8版. 北京: 人民卫生出版社, 2015: 2006-2009. |
| [14] | 谢晓恬, 石苇, 李本尚. 同济95方案治疗儿童急性淋巴细胞性白血病和晚期淋巴瘤远期疗效研究[J]. 中国实用儿科杂志, 2002, 17 (12): 734–737. DOI:10.3969/j.issn.1005-2224.2002.12.007 |
| [15] | 龚耀先, 蔡太生. 中国修订韦氏儿童智力量表手册[M]. 长沙: 湖南地图出版社, 1993: 11-37. |
| [16] | Jansen NC, Kingma A, Schuitema A, et al. Post-treatment intellectual functioning in children treated for acute lymphoblastic leukemia with chemotherapy-only: a prospective, sibling-controlled study[J]. Eur J Cancer, 2006, 42 (16): 2765–2772. DOI:10.1016/j.ejca.2006.06.014 |
| [17] | Reddick WE, Taghipour DJ, Glass JO, et al. Prognostic factors that increase the risk for reduced white matter volumes and deficits in attention and learning for survivors of childhood cancers[J]. Pediatr Blood Cancer, 2014, 61 (6): 1074–1079. DOI:10.1002/pbc.v61.6 |
| [18] | Iyer NS, Balsamo LM, Bracken MB, et al. Chemotherapy-only treatment effects on long-term neurocognitive functioning in childhood ALL survivors: a review and meta-analysis[J]. Blood, 2015, 126 (3): 346–353. DOI:10.1182/blood-2015-02-627414 |
| [19] | Nolin P, Stipanicic A, Henry M, et al. ClinicaVR: Classroom-CPT: A virtual reality tool for assessing attention and inhibition in children and adolescents[J]. Comput Human Behav, 2016, 59 : 327–333. DOI:10.1016/j.chb.2016.02.023 |
| [20] | Kemper M, Gaschler R, Schwager S, et al. The benefit of expecting no conflict—stronger influence of self-generated than cue-induced conflict expectations on stroop performance[J]. Acta Psychol (Amst), 2016, 163 : 135–141. DOI:10.1016/j.actpsy.2015.11.008 |
| [21] | Ibragić S, Matak I, Dračić A, et al. Effects of botulinum toxin type A facial injection on monoamines and their metabolites in sensory, limbic and motor brain regions in rats[J]. Neurosci Lett, 2016, 617 : 213–217. DOI:10.1016/j.neulet.2016.02.020 |
| [22] | Yasumura A, Kokubo N, Yamamoto H, et al. Neurobehavioral and hemodynamic evaluation of Stroop and reverse Stroop interference in children with attention-deficit/hyperactivity disorder[J]. Brain Dev, 2014, 36 (2): 97–106. DOI:10.1016/j.braindev.2013.01.005 |
| [23] | Chou TL, Chia S, Shang CY, et al. Differential therapeutic effects of 12-week treatment of atomoxetine and methylphenidate on drug-naïve children with attention deficit/hyperactivity disorder: A counting Stroop functional MRI study[J]. Eur Neuropsychopharmacol, 2015, 25 (12): 2300–2310. DOI:10.1016/j.euroneuro.2015.08.024 |
| [24] | De Bellis MD, Keshavan MS, Beers SR, et al. Sex differences in brain maturation during childhood and adolescence[J]. Cereb Cortex, 2001, 11 (16): 552–557. |
| [25] | Buizer AI, de Sonneville LM, van den Heuvel-Eibrink MM, et al. Chemotherapy and attentional dysfunction in survivors of childhood acute lymphoblastic leukemia: effect of treatment intensity[J]. Pediatr Blood Cancer, 2005, 45 (3): 281–290. DOI:10.1002/(ISSN)1545-5017 |
| [26] | Nahid R, Leila K. Comparison of intelligence quotient in children surviving leukemia who received different prophylactic central nervous system treatments[J]. Adv Biomed Res, 2012, 1 : 83. DOI:10.4103/2277-9175.103005 |
 2017, Vol. 19
2017, Vol. 19