手足口病(hand, foot and mouth disease, HFMD)是由柯萨奇病毒A组16型(CoxA16)、肠道病毒71型(enterovirus71, EV71)等肠道病毒引起的急性传染病,大多数为自限性、预后良好;少数出现脑炎、脑脊髓炎、肺水肿、循环障碍的HFMD多为EV71感染,致死原因主要为脑干脑炎及神经源性肺水肿[1],但具体机制尚未完全阐明。S100B是一种酸性钙结合蛋白,与中枢神经系统感染、癫癎、急性缺血性脑卒中等多种中枢神经系统疾病的发生发展密切相关[2-4]。而且S100B基因多态性与许多中枢神经系统疾病的易感性、疾病进展及预后明显相关[5-6]。但S100B基因多态性与EV71感染所致HFMD的相关性未见报道。本研究检测健康儿童和EV71感染HFMD患儿S100B基因rs9722位点基因多态性及表达水平,探讨S100B基因多态性在发病机制中的作用及意义。
1 资料与方法 1.1 研究对象选取2011年10月至2015年9月期间青岛市妇女儿童医院诊断并治疗的EV71感染(咽拭子或大便标本EV71荧光定量RT-PCR检测阳性)所致的HFMD患儿124例作为研究对象,既往无癫癎、脑瘫或运动、精神发育落后等;选取同期健康体检儿童56例作为对照组,其中男30例、女26例,年龄25±10个月。124例HFMD患儿中男75例、女49例,年龄22±11个月,其中80例为普通HFMD、44例为重症HFMD。对照组与HFMD患儿性别构成比(χ2=0.036,P=0.85)及年龄的差异(t=1.31,P=0.19)无统计学意义。HFMD诊断及分型符合手足口病诊疗指南(2010年版)[1]。疗效判断参照文献[7],124例中118例痊愈,预后不良6例:包括住院过程中死亡、放弃治疗后死亡以及3个月内仍有严重神经系统后遗症的患儿。本研究获得医院伦理委员会批准及受试者家属知情同意。
1.2 S100B基因rs9722位点基因多态性检测选取位于S100B基因的第三个外显子单核苷酸多态性(single nucleotide polymorphisms, SNP)rs9772位点测序,用Premier Primer 5.0软件设计引物(北京六合华大基因科技有限公司合成),序列如下:S100B-F GCATTGTGGAAAGGCACG,S100B-RAAAGAGCAGGAGGTTGTGGAC,扩增产物长度为147 bp。
入院后立即采集静脉血2 mL(EDTA抗凝),-20℃储存。提取基因组DNA,测定DNA浓度后-20℃冰箱保存。PCR反应体系为dNTP 2.0 μL,10×rTaq buffer 3 μL,Forward Primer 1.0 μL,Reverse Primer 1.0 μL,模板DNA 2.0 μL,rTaq 0.2 μL,ddH2O 20.8 μL,总体积30.0 μL。PCR反应条件为预变性95℃ 5 min,变性95℃ 30 s,退火56℃ 45 s,延伸72℃ 1 min,37个循环;终末延伸:72℃ 10 min,12℃ forever。PCR产物纯化、测序,反应体系为DNA 2.0 μL,Primer 1.0 μL,Bigdye 2.0 μL,DMSO 1.0 μL,总体积6.0 μL;测序反应条件为95℃ 2 min,95℃ 30 sec,55℃ 30 s,60℃ 90 s,共30个循环;12℃ forever。由华大基因提供测序服务。
1.3 ELISA法检测血清S100B74例患儿入院第1天采集外周静脉血3 mL,室温静置30 min,离心3 000 rpm×15 min,收集血清,-20℃保存待测。血清S100B检测按照试剂盒(上海恒远生物科技有限公司)说明书进行。
1.4 统计学分析采用SPSS 19.0软件进行数据处理。采用基因计数法计算基因频率,基因型频率和等位基因频率,组间比较用χ2检验。研究对象与Hardy-Weinberg平衡的符合程度用χ2检验或Fisher确切概率检验。正态分布的计量资料用均数士标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
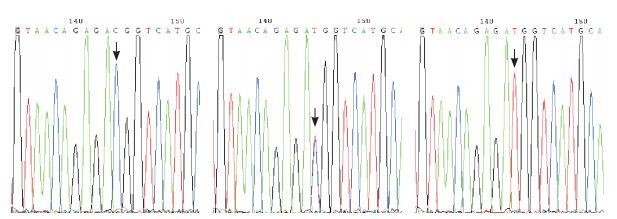
2 结果 2.1 S100B基因rs9722位点基因测序结果S100B基因rs9722位点测序结果(图 1)与Genebank中检索出的人S100B DNA序列一致,检出3种基因型:CC型(GTAACAGAGA[C/C]GGTCATGCAA)、CT型(GTAACAGAGA[C/T]GGTCATGCAA)和TT型(GTAACAGAGA[T/T]GGTCATGCAA)。S100B基因rs9722位点基因型频率分布符合Hardy-Weinberg平衡(χ2 < 3.84,P > 0.05),表示资料代表性好。
|
图 1 S100B基因rs9722位点PCR产物测序结果 左图为CC基因型,中图为CT基因型,右图TT基因型。突变位点如箭头所示。 |
2.2 EV71感染所致HFMD患儿的S100B基因rs9722位点多态性
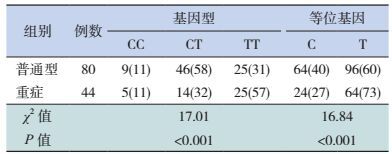
与对照组比较,HFMD组S100B基因rs9722位点TT基因型频率和T等位基因频率均明显增高,见表 1。重症HFMD患儿的TT基因型频率和T等位基因频率明显高于普通型患儿,见表 2。
| 表 1 对照组与HFMD组S100B基因rs9722位点多态性分布[例(%)] |
| 表 2 普通HFMD与重症HFMD患儿S100B基因rs9722位点多态性分布[例(%)] |
2.3 不同预后HFMD患儿的S100B基因rs9722位点基因型及等位基因类型
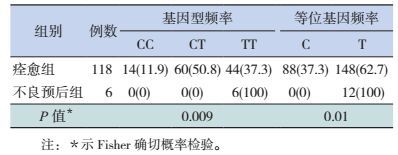
与痊愈组比较,HFMD不良预后组患儿S100B基因rs9722位点TT基因型频率和T等位基因频率均明显增高(P < 0.05),见表 3。
| 表 3 手足口病患儿不同预后组S100B基因rs9722位点多态性分布[例(%)] |
2.4 EV71感染HFMD患儿S100B基因rs9722位点各基因型血清S100B蛋白水平比较
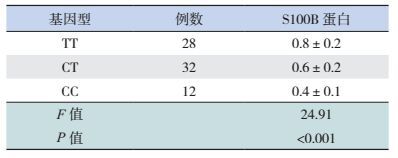
74例初发HFMD患儿各基因型的血清S100B蛋白水平差异有统计学意义,以TT基因型最高,CC型最低,见表 4。
| 表 4 手足口病患儿S100B基因rs9722位点各基因型血清 S100B 蛋白水平(x±s,μg/L) |
3 讨论
S100B属于S100家族的一员,分子量小,活性最强,基因定位于21号常染色体长臂2区2带,含有3个外显子和2个内含子。S100B蛋白是星形胶质细胞释放的神经营养因子,但高浓度有神经毒性作用,可通过刺激致炎因子表达导致细胞凋亡,并通过一氧化氮依赖途径诱导神经元细胞死亡,其过量表达与急性脑损伤有直接关系[8-11]。与一些脑损伤常用标志物如脑型肌酸激酶、髓鞘碱性蛋白、神经元烯醇化酶等比较,S100B蛋白被认为是最能反映脑损伤程度及预后的标志物[12-13]。
EV71属无包膜小RNA病毒,具有高度嗜神经性,最易侵犯脑干,导致循环不稳定及神经源性肺水肿。张乐海等[14]研究发现,合并脑炎与未合并脑炎的手足口病患儿EV71 VP1区基因型的差异无统计学意义,提示HFMD病情与个体差异有关。Zou等[15]研究显示,Ⅰ型干扰素受体启动子(IFNAR1)rs2843710位点基因多态性与EV71感染HFMD的易感性和严重程度相关。Li等[16]研究显示,白介素-4 -589C/T基因多态性是汉族儿童EV71感染性疾病进展的重要原因。而最能反映脑损伤程度及预后的S100B蛋白,其基因多态性是否与EV71感染HFMD发生发展有关,尚未见报道。
本研究发现,EV71感染HFMD患儿S100B基因rs9722位点TT基因型频率和T等位基因频率均明显高于对照组,提示T等位基因可能是EV71感染所致HFMD的高危宿主因素。而且,重症患儿TT基因型频率和T等位基因频率均高于普通患儿;与痊愈组比较,HFMD不良预后组患儿的S100B基因rs9722位点TT基因型频率和T等位基因频率也增高,提示TT基因型感染EV71更易发展为重症HFMD,有临床预警意义。74例初发HFMD患儿各基因型的血清S100B蛋白水平以TT基因型最高,CC型最低,提示S100B基因rs9722位点TT基因型转录水平较高。
综上所述,本研究从基因水平揭示了S100B基因多态性对EV71感染HFMD的发生发展及预后的作用,也表明CT和TT基因型可影响EV71感染HFMD患儿S100B水平,为进一步明确HFMD发病机制提供了线索,为其治疗提供了新的靶点。但同时本研究也存在一定的局限性,如样本量较小,以及性别、环境、病情等因素未进一步分层,这也是今后继续研究的方向。
| [1] | 中华人民共和国卫生部. 手足口病诊疗指南(2010年版)[J]. 国际呼吸杂志, 2010, 30 (24): 1473–1475. |
| [2] | 孙晓峰, 杨郁野, 张宏义, 等. 开颅术后颅内感染患者脑脊液与血清S-100B蛋白含量的变化意义[J]. 中华医院感染学杂志, 2016, 26 (6): 1345–1347. |
| [3] | 王晶, 殷亮, 吕涌涛, 等. S100B在癫癎患者脑脊液和血清中的表达[J]. 实用医学杂志, 2016, 32 (20): 3422–3424. DOI:10.3969/j.issn.1006-5725.2016.20.039 |
| [4] | 王百灵, 陈玉平, 孔伶俐, 等. 血清S-100B蛋白水平与前循环进展性卒中关系的研究[J]. 中国老年保健医学, 2016, 14 (3): 14–16. |
| [5] | Zhai J, Cheng L, Dong J, et al. S100B gene polymorphisms predict prefrontal spatial function in both schizophrenia patients and healthy individuals[J]. Schizophr Res, 2012, 134 (1): 89–94. DOI:10.1016/j.schres.2011.09.029 |
| [6] | 杨坤, 谢光荣, 胡义秋, 等. S100B基因rs9722多态性与抑郁症的关联分析[J]. 中国神经精神疾病杂志, 2008, 34 (5): 305–307. |
| [7] | 安妍, 聂莹雪, 赵传胜. 107例病毒性脑炎患者近期预后相关因素分析[J]. 中国医科大学学报, 2011, 40 (11): 1014–1017. |
| [8] | Staffa K, Ondruschka B, Franke H, et al. Cerebellar gene expression following human traumatic brain injury[J]. J Neurotrauma, 2012, 29 (17): 2716–2721. DOI:10.1089/neu.2011.2246 |
| [9] | Lo TY, Jones PA, Minns RA. Pediatric brain trauma outcome prediction using paired serum levels of inflammatory mediators and brain-specific proteins[J]. J Neurotrauma, 2009, 26 (9): 1479–1487. DOI:10.1089/neu.2008.0753 |
| [10] | 王鹏高, 施新革, 赵文增. S100蛋白与体外循环脑损伤[J]. 新乡医学院学报, 2006, 23 (4): 426–428. |
| [11] | 刘希尧, 张建生, 丁永忠, 等. 广泛脑挫裂伤早期脑脊液S100B蛋白、IL-1β动态变化的实验研究[J]. 中国急救医学, 2006, 26 (5): 329–331. |
| [12] | Laribi S, Kansao J, Borderie D, et al. S100B blood level measurement to exclude cerebral lesions after minor head injury: the multicenter STIC-S100 French study[J]. Clin Chem Lab Med, 2013, 6 (8): 1–10. |
| [13] | White M, Foulis AK, Smith G, et al. The role of S100 staining in the pathological assessment of perineural invasion in rectal cancer[J]. Colorectal Dis, 2013, 11 (3): 278–286. |
| [14] | 张乐海, 马丽霞, 王世富. 山东省部分地区脑炎与非脑炎手足口病肠道病毒71型VP1区基因特征[J]. 中国病原生物学杂志, 2010, 5 (8): 567–571. |
| [15] | Zou R, Zhang G, Li S, et al. A functional polymorphism in IFNAR1 gene is associated with susceptibility and severity of HFMD with EV71 infection[J]. Sci Rep, 2015, 5 : 18541. |
| [16] | Li F, Liu XP, Li JA, et al. Correlation of an interleukin-4 gene polymorphism with susceptibility to severe enterovirus 71 infection in Chinese children[J]. Arch Virol, 2015, 160 (4): 1035–1042. DOI:10.1007/s00705-015-2356-8 |
 2017, Vol. 19
2017, Vol. 19