2. 郑州市儿童急危重症医学重点实验室, 河南 郑州 450003
手足口病(hand, foot and mouth disease, HFMD)是我国儿童常见的急性传染病,主要由肠道病毒71型或柯萨奇病毒A组16型(Coxsackievirus A16, CA16)感染引起[1-2]。资料显示,CA16病毒感染更易侵犯心肌,重症HFMD甚至可合并爆发性心肌炎、心源性休克导致死亡[2-6]。左卡尼汀作为细胞代谢供能类药物,对病毒性心肌炎、心力衰竭等显示出较好的心脏保护作用[7-8],但对于手足口病心肌损害的保护作用如何未见报道。本文采用左卡尼汀辅助治疗心肌酶谱异常的HFMD患儿,观察治疗前后心肌酶、丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、细胞凋亡因子sFas/sFasl等指标的变化,探讨左卡尼汀对CA16病毒感染手足口病心肌酶谱的影响,并探讨其心肌保护作用及其机制。
1 资料与方法 1.1 研究对象选取2015年3月至2016年7月郑州市儿童医院收治的柯萨奇病毒A16型感染且心肌酶谱异常的手足口病患儿60例为研究对象,其中男31例、女29例,发病年龄8个月至4岁6个月,中位年龄2岁5个月,病程1~3天;普通HFMD 49例,重症HFMD 11例。诊断均符合《手足口病诊疗指南(2010年版)》手足口病诊断标准[9]。入组标准:普通或重症HFMD患儿,肛拭子RT-PCR检测CA16病毒阳性,且心肌酶谱异常:CK-MB > 25 U/L,AST > 40 U/L,CK > 190 U/L,LDH > 245 U/L,肌钙蛋白Ⅰ(cTnI) > 0.1 ng/mL。排除标准:合并其他严重疾病(结核、麻疹、水痘等传染病、先天性心脏病、血液病、肺炎、肾病、精神病等);外院转入、用药史不详的患儿。患儿随机分为左卡尼汀治疗组(左卡组)和1, 6-二磷酸果糖治疗组(果糖组),每组30例。并以同期体检ECG和心肌酶谱均正常的健康儿童30例作为对照组,其中男16例、女14例,中位年龄2岁8个月(11个月至5岁2个月)。
HFMD临床疗效判定[10]:(1)痊愈:体温正常,皮疹消退,生命体征稳定,精神反应正常,心肌酶谱及心电图恢复正常。(2)好转:临床症状或精神反应好转,皮疹减轻,无神经系统并发症,心肌酶谱、心电图好转但未恢复正常。(3)无效:发展为重症HFMD,心肌酶谱、心电图仍异常。痊愈及好转均判断为有效。
本研究获得医院伦理委员会批准及受试对象家长知情同意。
1.2 治疗方法根据《手足口病诊疗指南(2010年)》和《肠道病毒EV71型感染临床救治专家共识(2011年)》[9, 11]治疗。所有病例依据病情给予抗病毒、退热等支持治疗,左卡组另予以左卡尼汀注射液:每次0.1 g/kg,每日1次;果糖组予以果糖二磷酸钠注射液:每次0.1 g/kg,每日1次,疗程均为1周。
1.3 观察指标HFMD患儿分别在治疗前、治疗后7d采集外周血,采用全自动生化分析仪测定心肌酶谱AST、LDH、CK、CK-MB水平;双抗夹心ELISA法(试剂盒购自上海森雄科技公司)测定血清细胞凋亡因子sFas和sFasL;硫代巴比妥酸法(TBA法)测定MDA;比色法测定SOD变化(试剂盒购自南京建成生物工程研究所)。
1.4 统计学分析采用SPSS 16.0软件进行数据处理。正态分布的计量资料用均数±标准差(x±s)表示,组间比较采用t检验或方差分析;定性资料采用率(%)表示,组间比较采用χ2检验;等级资料比较采用秩和检验。P < 0.05为差异有统计学意义。
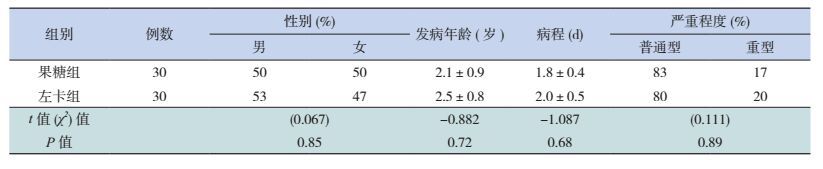
2 结果 2.1 两组HFMD患儿一般情况比较两组HFMD患儿治疗前的性别、发病年龄、入院时病程、病情等方面的差异均无统计学意义(P > 0.05),见表 1。
| 表 1 两组手足口病患儿的一般情况比较[例(%)] |
2.2 两组HFMD患儿的临床疗效及转归
两组HFMD患儿治疗有效性的差异无统计学意义(P > 0.05),其中果糖组1例进展为危重型,左卡组无进展为危重型的患者。见表 2。
| 表 2 两组手足口病患儿的临床疗效和转归 |
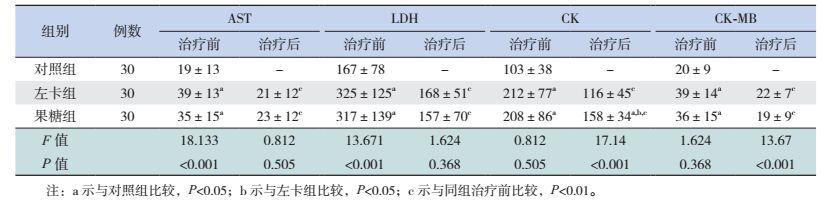
2.3 两组HFMD患儿治疗前后的心肌酶变化
治疗前左卡组及果糖组的各项心肌酶指标均高于对照组(P < 0.05),但两组间的差异无统计学意义(P > 0.05);治疗后两组的各项心肌酶指标较治疗前均降低(P < 0.05),除果糖组的CK高于对照组和左卡组,其余心肌酶指标在两组间及与对照组的差异均无统计学意义(P > 0.05)。见表 3。
| 表 3 HFMD各组治疗前后AST、LDH、CK、CK-MB的比较(x±s,IU/L) |
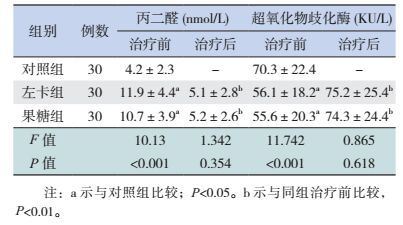
2.4 两组治疗前后的MDA和SOD变化
治疗前左卡组、果糖组的MDA浓度高于对照组(P < 0.05),SOD浓度低于对照组(P < 0.05),但两组间MDA、SOD浓度的差异无统计学意义(P > 0.05);与治疗前相比,治疗后左卡组和果糖组的MDA浓度降低,SOD浓度增高,差异有统计学意义(P < 0.05);HFMD两组间的MDA、SOD的差异,以及与对照组的差异均无统计学意义(P > 0.05)。见表 4。
| 表 4 HFMD各组治疗前后的MDA和SOD比较(x±s) |
2.5 MDA、SOD与心肌酶谱的相关性分析
HFMD患儿的SOD浓度与AST、LDH、CK、CK-MB呈负相关(r分别为-0.437、-0.364、-0.397和-0.519,P < 0.05)。MDA浓度与LDH、CKMB呈正相关(r分别为0.382、0.411,P < 0.05),与AST、CK无明显相关性(r分别为-0.219,-0.121,P > 0.05)。
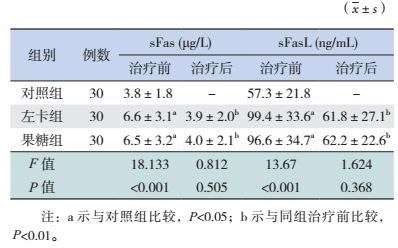
2.6 HFMD患儿治疗前后的sFas和sFasL变化左卡组和果糖组治疗前的sFas、sFasL浓度均高于对照组(P < 0.05),但HFMD两组间的sFas、sFasL浓度差异无统计学意义(P > 0.05)。左卡组和果糖组治疗后的sFas、sFasL降低(P < 0.05),但两组间的差异及与对照组的差异均无统计学意义(P > 0.05)。见表 5。
| 表 5 手足口病各组患儿治疗前后的sFas和sFasL比较 |
3 讨论
手足口病主要由CA16或EV71等肠道病毒感染引起,以发热和手、足、臀部、口腔等部位的丘疹或疱疹为主要特征[1-2]。多数病例为轻症,病程自限;但肠道病毒还可累及神经系统和心脏,甚至引发爆发性心肌炎、心源性休克导致死亡[2-4]。
肠道病毒感染并发心肌损害的机制尚不清楚,可能与病毒及其毒素对心肌直接损害,或病毒感染引发的心肌细胞免疫损伤有关[5, 12-13]。研究显示,柯萨奇等肠道病毒所致的心肌损害与氧自由基(oxygen free radical, ROS)和细胞凋亡有关[14-15]。MDA是ROS攻击细胞膜多价不饱和脂肪酸产生的脂质过氧化终产物,可反映脂质过氧化程度,也可间接反映活性氧的生成及组织细胞损伤程度。SOD是氧自由基的天然清除剂,是机体对抗ROS损伤的主要防御酶[16-17]。本研究观察到伴心肌酶谱异常的HFMD患儿MDA升高、SOD下降,说明HFMD患儿存在氧化与抗氧化失衡。而且相关性分析显示,HFMD患儿心肌酶谱指标异常与MDA、SOD水平具有一定相关性,提示CA16感染后HFMD的心肌损害可能与机体氧化/抗氧化失衡有关。
Fas广泛分布在机体淋巴细胞、单核细胞、心肌细胞等细胞中,与其配体sFasL结合后介导细胞凋亡,在清除病毒感染细胞、激活T淋巴细胞以及减轻免疫反应等过程中具有重要作用[15, 18]。细胞凋亡因子sFas与配体sFasL结合诱导细胞凋亡,参与了病毒感染后的心肌损害[15]。李军等[19]研究显示,柯萨奇病毒感染所致的病毒性心肌炎患儿sFas和sFasL高于同龄健康儿童。刘怡平等[18]认为,病毒性心肌炎患儿sFas及sFasL表达增高,并通过减少活化的T淋巴细胞凋亡造成心肌损害。本研究观察到,心肌酶谱异常的HFMD患儿sFas和sFasL均显著增高,提示细胞凋亡因子sFas、sFasL异常可能参与CA16病毒所致的HFMD心肌损害。
心肌酶谱、cTnI等异常的HFMD患儿预后较差,给予营养心肌辅助治疗可一定程度改善预后[12, 19]。左卡尼汀可有效清除心肌细胞内的氧自由基,提高心肌细胞的抗氧化能力,改善心肌细胞膜的稳定性,避免心肌细胞遭到氧自由基破坏[20]。本研究对心肌酶谱异常的手足口病患儿采用左卡尼汀或果糖二磷酸钠辅助治疗后,心肌酶谱明显下降,仅果糖组的1例患儿转化为重症HFMD,两组均无死亡病例,提示左卡尼汀等在HFMD心肌损害治疗中的有效性;而且左卡尼汀治疗后sFas、sFasL及MDA降低,SOD增高,提示左卡尼汀对CA16病毒感染后HFMD的心肌保护作用可能与抑制氧自由基和心肌细胞凋亡有关。
综上所述,左卡尼汀对儿童柯萨奇病毒A16型感染后手足口病有较好的心肌保护作用,其机制可能与清除氧自由基和抑制心肌细胞凋亡有关。
| [1] | Huang X, Wei H, Wu S, et al. Epidemiological and etiological characteristics of hand, foot, and mouth disease in Henan, China, 2008-2013[J]. Sci Rep, 2015, 5 : 8904. DOI:10.1038/srep08904 |
| [2] | Liu SL, Pan H, Liu P, et al. Comparative epidemiology and virology of fatal and nonfatal cases of hand, foot and mouth disease in mainland China from 2008 to 2014[J]. Rev Med Virol, 2015, 25 (2): 115–128. DOI:10.1002/rmv.v25.2 |
| [3] | 李秋园. 手足口病并发心肌炎患儿的临床治疗分析[J]. 中西医结合心血管病电子杂志, 2015, 3 (26): 74–75. |
| [4] | 王晓华, 刘维婵. 小儿手足口病并暴发性心肌炎4例报告[J]. 临床儿科杂志, 2003, 21 (1): 9. |
| [5] | 邹美银, 方翠钧, 陆宗汉, 等. 柯萨奇病毒、肠道病毒71型引起的重型手足口病比较[J]. 临床荟萃, 2011, 26 (18): 1619–1620. |
| [6] | Jin J, Li R, Jiang C, et al. Transcriptome analysis reveals dynamic changes in coxsackievirus A16 infected HEK 293T cells[J]. BMC Genomics, 2017, 18 (Suppl 1): 933. |
| [7] | 朱凤喜, 杨渊, 黄玮. 左卡尼汀改善心力衰竭疗效的Meta分析[J]. 第三军医大学学报, 2014, 36 (13): 1428–1430. |
| [8] | 朱建林, 姜双英. 1, 6-FDP与左卡尼汀治疗小儿病毒性心肌炎的疗效[J]. 中国妇幼健康研究, 2015, 26 (3): 559–561. |
| [9] | 中华人民共和国卫生部. 手足口病诊疗指南(2010年版) [J]. 2010, 30 (24): 1473-1475. |
| [10] | 叶金花, 章哲, 赵佳佳. 加味葛根芩连汤联合西药治疗小儿手足口病疗效观察及对心肌酶的影响[J]. 中华中医药学刊, 2015, 33 (7): 1738–1740. |
| [11] | 卫生部手足口病临床专家组. 肠道病毒71型(EV71) 感染重症病例临床救治专家共识[J]. 中华儿科杂志, 2011, 49 (9): 675–678. |
| [12] | 黄娇甜, 祝益民, 卢秀兰, 等. 重症手足口病并心肌损伤的临床特征[J]. 实用儿科临床杂志, 2012, 27 (18): 1414–1417. DOI:10.3969/j.issn.1003-515X.2012.18.013 |
| [13] | Yajima T. Viral myocarditis: potential defense mechanisms within the cardiomyocyte against virus infection[J]. Future Microbiol, 2011, 6 (5): 551–566. DOI:10.2217/fmb.11.40 |
| [14] | Tada Y, Suzuki J. Oxidative stress and myocarditis[J]. Curr Pharm Des, 2016, 22 (4): 450–471. DOI:10.2174/1381612822666151222160559 |
| [15] | Huang TF, Wu XH, Wang X, et al. Fas-FasL expression and myocardial cell apoptosis in patients with viral myocarditis[J]. Genet Mol Res, 2016, 15 (2): gmr.15027607. |
| [16] | Campos JC, Gomes KM, Ferreira JC. Impact of exercise training on redox signaling in cardiovascular diseases[J]. Food Chem Toxicol, 2013, 62 : 107–119. DOI:10.1016/j.fct.2013.08.035 |
| [17] | Tsikas D. Assessment of lipid peroxidation by measuring malondialdehyde (MDA) and relatives in biological samples: Analytical and biological challenges[J]. Anal Biochem, 2017, 524 : 13–30. DOI:10.1016/j.ab.2016.10.021 |
| [18] | 刘怡平, 朱薇薇, 安丽. 病毒性心肌炎患儿血清sFas、sFasL的表达水平[J]. 临床儿科杂志, 2004, 22 (3): 149–150. |
| [19] | 李军, 李鸿珠, 李萍, 等. 磷酸肌酸对儿童柯萨奇病毒性心肌炎的保护作用[J]. 实用儿科临床杂志, 2010, 25 (6): 424–426. |
| [20] | Pekala J, Patkowska-Sokoła B, Bodkowski R, et al. L-carnitine--metabolic functions and meaning in humans life[J]. Curr Drug Metab, 2011, 12 (7): 667–678. DOI:10.2174/138920011796504536 |
 2017, Vol. 19
2017, Vol. 19