注意缺陷多动障碍(attention deficit hyperactivity disorder, ADHD)又称儿童多动症,是儿童时期常见的精神神经异常性疾病,全球发病率约为5.9%,且有不断上升的趋势[1]。该病以多动、冲动、注意力不集中为主要特征[2],影响儿童的健康成长。本病的发病机制不明,Swanson等[3]提出的多巴胺缺陷理论当前在国际学术界认可度最高,成为研究的重点方向。在本病的治疗中,哌甲酯类药物为目前的一线药物,在控制核心症状上疗效显著[4],但作为精神类药物,并伴有不断涌现的一系列副作用,使得医从性较差,影响本病的治疗[5-6]。
黄芩为唇形科植物黄芩(scutellaria baicalensis georgi)的干燥根,在中国拥有数千年的药用植物历史。黄芩苷为黄酮类化合物,是中药黄芩的主要有效成分,为淡黄色粉末,无臭,味苦。在前期文献研究中本课题组发现,黄芩苷能够迅速通过血脑屏障,富集于大脑前额叶、纹状体、海马等区域[7-8],对多巴胺系统发挥保护、调节作用,维持脑内多巴胺的含量,并能显著提高大鼠的学习记忆能力[9],脑内多巴胺系统可能是黄芩苷的“脑内靶系统”[10],因此我们提出假设“黄芩苷可能对ADHD拥有治疗作用”,相关假设已有文献发表[11]。
自发性高血压大鼠(spontaneously hypertensive rats, SHR)是国际上应用最为广泛、研究最多的ADHD动物模型[12],SHR大鼠起源于东京远交系Wistar Kyoto(WKY)大鼠,是Okamoto等[13]经过数代的交叉培育而获得,因此WKY大鼠常用来作为SHR大鼠的种系控制对照动物。为验证假设,我们以公认的SHR大鼠为模型动物,基于ADHD多动、冲动、注意力不集中的核心症状,从行为学角度观察黄芩苷是否存在控制ADHD核心症状的作用,以期为验证黄芩苷治疗ADHD的假设提供实验依据,现将实验过程介绍如下。
1 材料与方法 1.1 动物分组SPF级4周龄雄性SHR大鼠40只,体重78±5 g;SPF级4周龄雄性WKY大鼠8只,体重76±5 g;均购自北京维通利华实验动物技术有限公司[SCXK(京)2014-0001]。将SHR大鼠随机分为模型组、盐酸哌甲酯组、黄芩苷低剂量组、黄芩苷中剂量组、黄芩苷高剂量组,每组8只,WKY大鼠8只作为正常对照组。所有动物饲养于南京中医药大学SPF级实验动物中心,温度控制在20~24℃,湿度控制在45%~55%,调整昼夜节律,大鼠自由进食及饮水。
1.2 药品准备黄芩苷(淡黄色粉末状)购自成都菲普斯生物技术有限公司,高效液相色谱法检测药物纯度 > 95%(检测波长280 nm),购买之后4℃保存。应用时按需称取药品,加生理盐水配制成黄芩苷低剂量3.33 mg/mL、中剂量6.67 mg/mL[14]、高剂量10 mg/mL的混合液,4℃保存,灌胃前按需取出,复温至25±2℃后灌胃给药,每次灌胃前摇匀。盐酸哌甲酯(专注达,36 mg/片,Janssen Cilag Manufacturing LLC生产,西安杨森制药有限公司分装,进口药品注册证号H20120111,进口准许证号TP120120504)。将药品加生理盐水配制成0.07mg/mL混合液,4℃保存,灌胃前按需取出,复温至室温后灌胃给药。
1.3 动物给药大鼠适应性喂养5 d后开始灌胃给药,大鼠灌胃量根据9岁(体重26 kg)儿童体表面积和4周龄(体重60 g)SHR大鼠体表面积进行转换得出[15]。灌胃持续4周,于每日上午8 : 00~9 : 00、下午13 : 30~14 : 30准时给药,每日上午给药前称量大鼠体重,根据体重调整给药量,灌胃标准为1.5 mL/100 g。正常对照组、模型组依据体重给予生理盐水灌胃,盐酸哌甲酯组、黄芩苷低剂量组、黄芩苷中剂量组、黄芩苷高剂量组按照体重变化分别给予对应药物灌胃。为避免药物颜色不同对动物的影响,所有透明灌胃容器均用白色医用胶带包裹。
1.4 主要实验设备旷场实验、水迷宫实验设备购自北京硕林苑科技有限公司,设备包括黑色旷场实验箱(100 cm×100 cm×30 cm),水迷宫实验装置(160 cm×50 cm)及水温恒定系统,小动物行为活动记录分析图像采集电脑控制系统(SLY-ETS Version 1.66)。
1.5 旷场实验运用小动物行为活动记录分析系统将旷场实验箱底部分为25 cm×25 cm的16个方格。旷场实验于白天9 : 00~17 : 00进行,将大鼠轻柔置于实验箱中央区域,电脑软件统计大鼠的运动距离、运动速度、中心运动距离、穿格次数、理毛次数等数据,摄像头跟踪描绘动物运动轨迹。大鼠于灌胃给药第0天、第7天、第14天、第21天、第28天分别进行1次实验,每次实验5 min。每只动物实验结束后,清除动物粪便,消毒液清洗实验箱底部及内壁,然后用75%酒精擦拭,风扇吹干后放入下一只动物。
1.6 Morris水迷宫实验水迷宫宫体为圆柱形,直径160 cm,高约50 cm,内部为黑色,宫体内充水高度约30~35 cm,通过水温恒定系统恒定水温至23±2℃。站台高约29~34 cm,直径12 cm,表面粗糙。电脑软件将水迷宫分为东北、东南、西北、西南4个象限,站台固定放置于西南象限中央区域,约低于水平面0.7~1 cm。水池四周用黑色遮光布包围以避免外部环境干扰,水池周围高于水平面位置约15~20 cm处放置4~5个10 cm大小、形态各异的几何图形作为空间参照物。实验连续6 d,第1~5天为隐匿站台实验,每天从不同入水部位训练4次,每次120 s,训练间隔为30 s,观察各组大鼠潜伏期的变化。因每个象限与站台的距离不同,为防止固定顺序的入水位置及不同的入水距离对实验结果的影响,本实验采用半随机4象限循环入水位置实验方法[16-17],尽量保持入水顺序的变化和距离的相同。第6天为空间探索实验,撤除站台,将大鼠从东北象限放入,统计120 s内大鼠的穿台次数及在目标象限内游泳时间和距离占总时间和总距离的百分比以评价大鼠的学习记忆能力,实验进行2次求均值。实验结束后用干毛巾擦拭动物,并用吹风机将大鼠吹干后放入笼内。每天实验结束后放干宫体内部污水,清洗宫体后注入清水备用。
1.7 统计学分析采用SPSS 19.0统计软件对数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
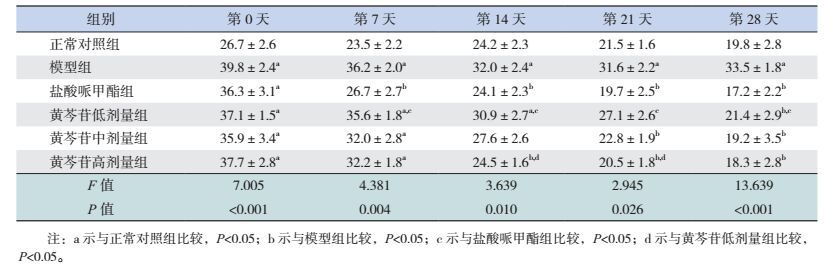
2 结果 2.1 旷场实验大鼠总运动距离观察实验第0天,与正常对照组比较,其余各组大鼠运动距离均显著升高(P < 0.05);实验第7天(用药1周后),与正常对照组比较,除盐酸哌甲酯组外,其余各组运动距离仍显著升高(P < 0.05);与盐酸哌甲酯组比较,模型组及黄芩苷低剂量组运动距离显著升高(P < 0.05)。实验第14天(用药2周后),与正常对照组比较,模型组及黄芩苷低剂量组运动距离仍显著升高(P < 0.05);与模型组比较,盐酸哌甲酯组、黄芩苷高剂量组运动距离显著降低(P < 0.05);与黄芩苷低剂量组比较,盐酸哌甲酯组及黄芩苷高剂量组运动距离显著减少(P < 0.05)。实验第21天(用药3周后),与正常对照组比较,模型组运动距离仍显著升高(P < 0.05);与模型组比较,盐酸哌甲酯组、黄芩苷中、高剂量组运动距离显著降低(P < 0.05);与黄芩苷低剂量组比较,盐酸哌甲酯组及黄芩苷高剂量组运动距离显著减少(P < 0.05)。实验第28天(用药第4周),与正常对照组比较,模型组运动距离仍显著升高(P < 0.05);而与模型组相比,各用药组运动距离均显著降低(P < 0.05),与盐酸哌甲酯组比较,黄芩苷低剂量组运动距离升高(P < 0.05)。见表 1。
| 表 1 旷场实验中每周大鼠总运动距离的比较结果(x±s,m,n=8) |
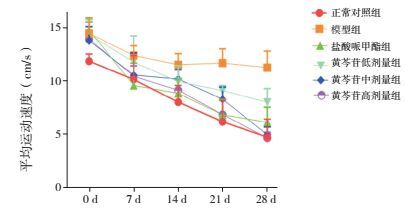
2.2 旷场实验平均运动速度的比较
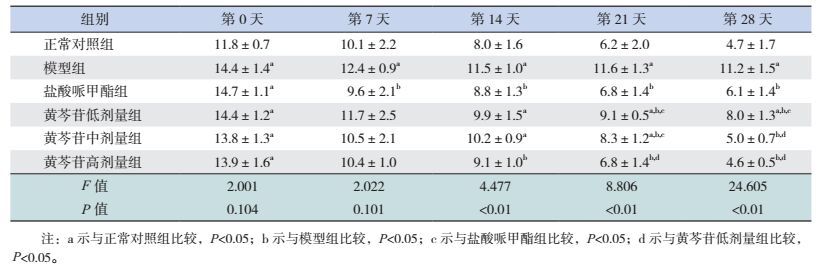
实验第0天,与正常对照组比较,其余各组平均运动速度均显著升高(P < 0.05)。实验第7天(用药1周后),与正常对照组比较,模型组平均运动速度仍显著升高(P < 0.05);与模型组比较,盐酸哌甲酯组平均运动速度显著降低(P < 0.05)。实验第14天(用药2周后),与正常对照组比较,模型组、黄芩苷低、中剂量组平均运动速度显著升高(P < 0.05);与模型组比较,盐酸哌甲酯组及黄芩苷高剂量组平均运动速度显著降低(P < 0.05)。实验第21天(用药3周后),与正常对照组比较,模型组、黄芩苷低、中剂量组平均运动速度仍显著升高(P < 0.05);与模型组比较,各用药组平均运动速度均显著降低(P < 0.05);与盐酸哌甲酯组比较,黄芩苷低、中剂量组平均运动速度显著升高(P < 0.05);与黄芩苷低剂量组比较,黄芩苷高剂量组平均运动速度显著降低(P < 0.05)。实验第28天(用药4周后),与正常对照组比较,模型组、黄芩苷低剂量组平均运动速度显著升高(P < 0.05);与模型组比较,各用药组平均运动速度均显著降低(P < 0.05);与盐酸哌甲酯组比较,黄芩苷低剂量组运动速度显著升高(P < 0.05);与黄芩苷低剂量组比较,黄芩苷中、高剂量组平均运动速度显著降低(P < 0.05)。见表 2及图 1。
| 表 2 旷场实验中每周大鼠平均运动速度比较(x±s,cm/s,n=8) |
|
图 1 旷场实验中每周大鼠平均运动速度折线图 |
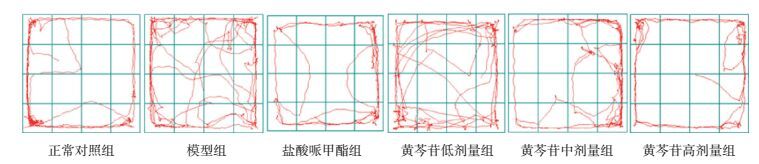
2.3 旷场实验典型轨迹
旷场实验典型运动轨迹描绘结果显示,正常对照组、盐酸哌甲酯组、黄芩苷中剂量组及黄芩苷高剂量组大鼠旷场实验箱内运动轨迹较短,轨迹呈周围型分布,中心运动轨迹较少;模型组、黄芩苷低剂量组大鼠旷场实验箱内运动轨迹较其余组增多,轨迹分布特点不明确,中心运动轨迹增多。见图 2。
|
图 2 旷场实验中各组大鼠典型运动轨迹图 正常对照组、盐酸哌甲酯组、黄芩苷中剂量组及黄芩苷高剂量组大鼠旷场实验箱内运动轨迹较短,轨迹呈周围型分布,中心运动轨迹较少;模型组、黄芩苷低剂量组大鼠旷场实验箱内运动轨迹较其余组增多,轨迹分布特点不明确,中心运动轨迹增多。 |
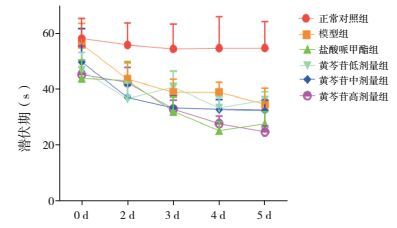
2.4 水迷宫实验潜伏期比较
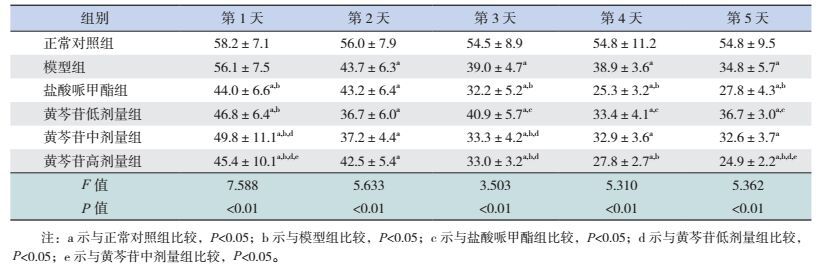
实验第1天,与正常对照组比较,除模型组外,其余各用药组潜伏期均明显缩短(P < 0.05);与模型组比较,各用药组潜伏期亦均明显缩短(P < 0.05);与黄芩苷低剂量组比较,黄芩苷高剂量组潜伏期显著缩短(P < 0.05);与黄芩苷中剂量组比较,黄芩苷低、高剂量组潜伏期显著缩短(P < 0.05)。实验第2天,与正常对照组比较,其余各组潜伏期均显著缩短(P < 0.05)。实验第3天,与正常对照组比较,其余各组潜伏期均显著缩短(P < 0.05);与模型组比较,盐酸哌甲酯组、黄芩苷中、高剂量组潜伏期显著缩短(P < 0.05);与黄芩苷低剂量组比较,盐酸哌甲酯组、黄芩苷中、高剂量组潜伏期显著缩短(P < 0.05)。实验第4天,与正常对照组比较,其余各组潜伏期均显著缩短(P < 0.05);与模型组相比,盐酸哌甲酯组、黄芩苷高剂量组潜伏期显著缩短(P < 0.05);与盐酸哌甲酯组比较,黄芩苷低剂量组潜伏期延长(P < 0.05)。实验第5天,与正常对照组比较,其余各组潜伏期仍显著缩短(P < 0.05);与模型组比较,盐酸哌甲酯组、黄芩苷高剂量组潜伏期缩短(P < 0.05);与黄芩苷低剂量组比较,盐酸哌甲酯组、黄芩苷高剂量组潜伏期缩短(P < 0.05);与黄芩苷中剂量组比较,黄芩苷高剂量组潜伏期缩短(P < 0.05)。见表 3及图 3。
| 表 3 水迷宫实验不同时间各组大鼠潜伏期比较(x±s,s,n=8) |
|
图 3 水迷宫实验不同时间各组大鼠潜伏期变化折线图 |
2.5 水迷宫空间探索实验穿越平台次数、目标象限停留时间与运动距离百分比
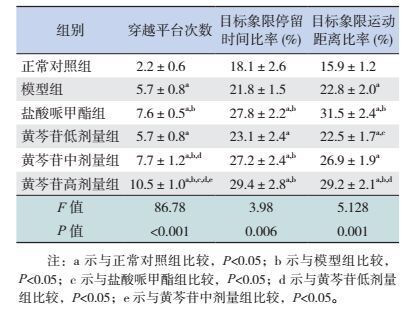
在穿越平台次数比较中,与正常对照组比较,其余各组穿越平台次数均显著增多(P < 0.05);与模型组及黄芩苷低剂量组比较,盐酸哌甲酯组、黄芩苷中、高剂量组显著增多(P < 0.05);与黄芩苷高剂量组比较,盐酸哌甲酯组和黄芩苷中剂量组显著减少(P < 0.05)。在目标象限停留时间比较中,与正常对照组比较,除模型组外,其余各组目标象限停留时间所占比率显著升高(P < 0.05);与模型组比较,除黄芩苷低剂量组外,其余各组所占比率显著升高(P < 0.05)。在目标象限运动距离比较中,与正常对照组比较,其余各组目标象限运动距离所占比率均显著升高(P < 0.05);与模型组比较,盐酸哌甲酯组、黄芩苷高剂量组所占比率显著升高(P < 0.05);与黄芩苷低剂量组比较,盐酸哌甲酯组和黄芩苷高剂量组所占比率显著升高(P < 0.05)。见表 4。
| 表 4 水迷宫空间探索实验穿越平台次数、目标象限停留时间及运动距离百分比比较(x±s,n=8) |
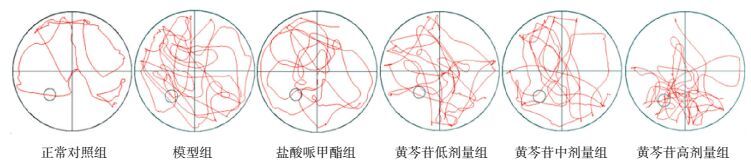
2.6 水迷宫空间探索实验典型轨迹图
水迷宫空间探索实验典型轨迹描绘结果显示,正常对照组轨迹呈周围型分布,目标象限分布较少;其余各组轨迹呈不同程度的向心性分布特征,目标象限分布较多。见图 4。
|
图 4 水迷宫空间探索实验各组大鼠典型轨迹图 正常对照组轨迹呈周围型分布,目标象限分布较少;其余各组轨迹呈不同程度的向心性分布特征,目标象限分布较多。图中小圆圈所示为目标象限内站台所在位置。 |
3 讨论
ADHD以多动、冲动、注意力不集中为核心症状,黄芩苷是否能够控制ADHD核心症状,这是验证假设的基本条件。旷场实验是评价动物自主运动能力的常用实验方法,在ADHD的行为学研究中,国外经常将旷场实验中大鼠的运动距离及运动速度作为评价ADHD多动、冲动两大核心症状的重要依据[18]。通常情况下,旷场实验中动物总运动距离数据常作为评估多动行为的客观依据,而平均运动速度的快慢则作为大鼠激惹冲动程度的评定标准,具有一定的说服力[19]。因此,本次实验重点比较了各组大鼠总运动距离及平均运动速度的变化情况,以评估黄芩苷控制SHR大鼠多动、冲动症状的能力。旷场实验数据显示,在灌胃给药前(即实验第0天),5组SHR大鼠的总运动距离及平均运动速度均显著高于WKY大鼠,而在SHR大鼠各组间比较差异无统计学意义,表明SHR大鼠较WKY大鼠存在明显的活动能力增强的表现。在灌胃给药1周后,实验第7天,盐酸哌甲酯组总运动距离及平均运动速度较模型组显著降低,与正常对照组无差异,而其余各组在总运动距离上仍高于正常对照组,这一结果提示盐酸哌甲酯能够快速控制SHR大鼠多动、冲动的行为特点,较黄芩苷效果明显。实验第14天,盐酸哌甲酯组及黄芩苷高剂量组大鼠在总运动距离及平均运动速度上均较模型组显著降低,与正常对照组比较差异无统计学意义,而黄芩苷低、中剂量组变化较小。实验第21、28天的数据表明,黄芩苷各剂量组在总运动距离及平均运动速度上较模型组均呈不断下降趋势,且黄芩苷中、高剂量组与盐酸哌甲酯组比较差异无统计学意义。实验结果表明,黄芩苷能够降低SHR大鼠的总运动距离及平均运动速度,控制SHR大鼠的运动能力,这一作用于给药3周后最为明显,且剂量与药效存在正相关。
学习记忆能力能够从侧面反映注意力的情况,Morris水迷宫实验作为评价动物学习记忆能力的经典实验方法[16-17],在国外众多文献中常用来从侧面评价ADHD模型注意力不集中这一核心症状的严重程度[20-21]。因此,本实验选取Morris水迷宫实验来评估黄芩苷能否提高SHR大鼠学习记忆能力,进而达到改善注意力不集中这一核心症状的目的。实验结果显示,各组SHR大鼠的潜伏期在整个实验过程中均显著短于WKY大鼠,而在整个实验过程中,除盐酸哌甲酯组及黄芩苷高剂量组潜伏期较模型组稳定性的缩短之外,黄芩苷低、中剂量组潜伏期虽呈不断缩短趋势,但较模型组稳定性较差。水迷宫空间探索实验目标象限停留时间及运动距离结果显示,盐酸哌甲酯组及黄芩苷中、高剂量组目标象限停留时间比率显著高于模型组,盐酸哌甲酯组、黄芩苷高剂量组目标象限运动距离所占比率亦显著高于模型组;穿越平台次数结果显示,黄芩苷高剂量组穿越平台次数高于其余各组,显示出巨大优势。综合结果表明,黄芩苷能够显著提高SHR大鼠的学习记忆能力,这一作用以黄芩苷高剂量组效果最为稳定,且优于盐酸哌甲酯组,这一结果从侧面反映黄芩苷具有改善ADHD注意力不集中的作用。
行为学实验结果综合表明,黄芩苷及盐酸哌甲酯均能够调控ADHD模型SHR大鼠的运动能力及学习记忆能力,从而控制ADHD多动、冲动及注意力不集中的核心症状,黄芩苷药效的发挥迟于盐酸哌甲酯且与药物剂量呈正相关性。这些结果为验证黄芩苷具有治疗ADHD作用的假说提供了实验依据,为后续的实验研究奠定了基础。但在实验研究过程中,本课题组发现WKY大鼠在水迷宫实验中的运动能力及学习记忆能力异常降低,WKY大鼠在实验过程中存在水上漂浮不动或极少运动的现象,这导致WKY大鼠潜伏期显著延长,目标象限比率及穿越平台次数等实验数据显著降低,并且这一现象有悖于大鼠的生理特征,可能会影响对实验结果的分析。纵观文献,前人研究亦有相关报道[22-23],甚至有学者提出增加Sprague-Dawley大鼠作为SHR大鼠的对照组的改良方案[24-25],这一问题值得深入研究,课题组后期会跟进研究,以明确这一现象产生的原因及解决方案。此外,此次实验仍有许多不足之处需要指出,在对ADHD模型大鼠注意力不集中这一核心症状的检测中,Morris水迷宫实验虽能够从侧面反映注意力的情况,且国际上有诸多应用先例,但Morris水迷宫并非专业的注意力检测设备,我们将会在后期的实验中运用近期国际通用的五项连续反映时间任务(5-choice serial reaction time task, 5-CSRTT)实验[26]代替Morris水迷宫实验,以更准确的评估黄芩苷对SHR大鼠注意力的调控作用。同时,此次研究中发现黄芩苷在控制ADHD核心症状中可能存在药效与剂量的相关性,课题组将会针对这一问题,在接下来的实验中联合运用质谱、液相及分子生物学方法等探索黄芩苷入血剂量与药效之间的关联性,并进一步研究黄芩苷的药效机制,以期为验证假设提供更为详尽的数据支撑,为ADHD的研究提供参考,造福广大儿童。
| [1] | Thomas R, Sanders S, Doust J, et al. Prevalence of attention-deficit/hyperactivity disorder: a systematic review and meta-analysis[J]. Pediatrics, 2015, 135 (4): e994–e1001. DOI:10.1542/peds.2014-3482 |
| [2] | Antle MC, van Diepen HC, Deboer T, et al. Methylphenidate modifies the motion of the circadian clock[J]. Neuropsychopharmacology, 2012, 37 (11): 2446–2455. DOI:10.1038/npp.2012.103 |
| [3] | Swanson JM, Kinsbourne M, Nigg J, et al. Etiologic subtypes of attention deficit/hyperactivity disorder: brain imaging, molecular genetic and environmental factors and the dopamine hypothesis[J]. Neuropsychol Rev, 2007, 17 (1): 39–59. DOI:10.1007/s11065-007-9019-9 |
| [4] | McCarthy S, Wilton L, Murray ML, et al. The epidemiology of pharmacologically treated attention deficit hyperactivity disorder (ADHD) in children, adolescents and adults in UK primary care[J]. BMC Pediatr, 2012, 12 : 78. |
| [5] | Gürkan K, Bilgiç A, Türkoglu S, et al. Depression, anxiety and obsessive-compulsive symptoms and quality of life in children with attention-deficit hyperactivity disorder (ADHD) during three-month methylphenidate treatment[J]. J Psychopharmacol, 2010, 24 (12): 1810–1818. DOI:10.1177/0269881109348172 |
| [6] | Charach A, Fernandez R. Enhancing ADHD medication adherence: challenges and opportunities[J]. Curr Psychiatry Rep, 2013, 15 (7): 371. DOI:10.1007/s11920-013-0371-6 |
| [7] | Wang X, Zhang L, Hua L, et al. Effect of flavonoids in scutellariae radix on depression-like behavior and brain rewards: possible in dopamine system[J]. Tsinghua Sci Technol, 2010, 15 (4): 460–466. DOI:10.1016/S1007-0214(10)70088-2 |
| [8] | 周荣易, 王娇娇, 尤月, 等. 黄芩苷对注意缺陷多动障碍大鼠突触体ATP酶和LDH的影响及对AC/cAMP/PKA信号通路的调控作用[J]. 中国当代儿科杂志, 2017, 19 (5): 576–582. DOI:10.7499/j.issn.1008-8830.2017.05.020 |
| [9] | Cheng O, Li Z, Han Y, et al. Baicalin improved the spatial learning ability of global ischemia/ reperfusion rats by reducing hippocampal apoptosis[J]. Brain Res, 2012, 1470 : 111–118. DOI:10.1016/j.brainres.2012.06.026 |
| [10] | Chen L, Zhang L, Wang X, et al. Determination of dopamine and its relativity of baicalin in rat nuclei after intravenous administration of flavonoids from Scutellariae radix[J]. Biomed Chromatogr, 2007, 21 (1): 84–88. DOI:10.1002/(ISSN)1099-0801 |
| [11] | Zhou R, Han X, Wang J, et al. Baicalin may have a therapeutic effect in attention deficit hyperactivity disorder[J]. Med Hypotheses, 2015, 85 (6): 761–764. DOI:10.1016/j.mehy.2015.10.012 |
| [12] | Cao AH, Yu L, Wang YW, et al. Effects of methylphenidate on attentional set-shifting in a genetic model of attention-deficit/hyperactivity disorder[J]. Behav Brain Funct, 2012, 8 (1): 10. DOI:10.1186/1744-9081-8-10 |
| [13] | Okamoto K, Aoki K. Development of a strain of spontaneously hypertensive rats[J]. Jpn Circ J, 1963, 27 : 282–293. DOI:10.1253/jcj.27.282 |
| [14] | Liu YF, Gao F, Li XW, et al. The anticonvulsant and neuroprotective effects of baicalin on pilocarpine-induced epileptic model in rats[J]. Neurochem Res, 2012, 37 (8): 1670–1680. DOI:10.1007/s11064-012-0771-8 |
| [15] | Reagan-Shaw S, Nihal M, Ahmad N. Dose translation from animal to human studies revisited[J]. FASEB J, 2008, 22 (3): 659–661. |
| [16] | Vorhees CV, Williams MT. Value of water mazes for assessing spatial and egocentric learning and memory in rodent basic research and regulatory studies[J]. Neurotoxicol Teratol, 2014, 45 : 75–90. DOI:10.1016/j.ntt.2014.07.003 |
| [17] | Liu LL, Yang J, Lei GF, et al. Atomoxetine increases histamine release and improves learning deficits in an animal model of attention-deficit hyperactivity disorder: the spontaneously hypertensive rat[J]. Basic Clin Pharmacol Toxicol, 2008, 102 (6): 527–532. DOI:10.1111/j.1742-7843.2008.00230.x |
| [18] | Yang MT, Lu DH, Chen JC, et al. Inhibition of hyperactivity and impulsivity by carbonic anhydrase inhibitors in spontaneously hypertensive rats, an animal model of ADHD[J]. Psychopharmacology (Berl), 2015, 232 (20): 3763–3772. DOI:10.1007/s00213-015-4036-5 |
| [19] | Majdak P, Bucko PJ, Holloway AL, et al. Behavioral and pharmacological evaluation of a selectively bred mouse model of home cage hyperactivity[J]. Behav Genet, 2014, 44 (5): 516–534. DOI:10.1007/s10519-014-9667-5 |
| [20] | Liu LL, Yang J, Lei GF, et al. Atomoxetine increases histamine release and improves learning deficits in an animal model of attention-deficit hyperactivity disorder: the spontaneously hypertensive rat[J]. Basic Clin Pharmacol Toxicol, 2008, 102 (6): 527–532. DOI:10.1111/j.1742-7843.2008.00230.x |
| [21] | Hong Q, Wang YP, Zhang M, et al. Homer expression in the hippocampus of an animal model of attention-deficit/hyperactivity disorder[J]. Mol Med Rep, 2011, 4 (4): 705–712. |
| [22] | 郑小兰, 陈燕惠. 注意缺陷多动障碍的实验动物模型[J]. 中华行为医学与脑科学杂志, 2015, 24 (3): 276–280. |
| [23] | Banerjee E, Nandagopal K. Does serotonin deficit mediate susceptibility to ADHD?[J]. Neurochem Int, 2015, 82 : 52–68. DOI:10.1016/j.neuint.2015.02.001 |
| [24] | Sjoberg EA. Logical fallacies in animal model research[J]. Behav Brain Funct, 2017, 13 (1): 3. DOI:10.1186/s12993-017-0121-8 |
| [25] | 曹爱华, 张昕婷, 于琳, 等. SHR/WKY/SD大鼠的行为学特征研究[J]. 中国儿童保健杂志, 2013, 21 (7): 704–707. |
| [26] | Caballero-Puntiverio M, Fitzpatrick CM, Woldbye DP, et al. Effects of amphetamine and methylphenidate on attentional performance and impulsivity in the mouse 5-Choice Serial Reaction Time Task[J]. J Psychopharmacol, 2017, 31 (2): 272–283. DOI:10.1177/0269881116684339 |
 2017, Vol. 19
2017, Vol. 19