新生儿缺氧缺血脑病(hypoxic-ischemic encepha-lopathy, HIE)是新生儿期一种常见的中枢神经系统疾病,是新生儿致残和致死的主要原因之一,严重威胁患儿的健康和生命。目前其发病机制尚不完全清楚,临床治疗缺乏特异治疗手段[1]。因此,探讨HIE的发病机制及防治措施,对指导临床治疗HIE具有重要意义。
自噬是指细胞通过包裹受损的细胞器、蛋白等大分子物质形成自噬体,再转运到溶酶体形成自噬溶酶体进行降解,以维持细胞内环境稳定的生理过程[2-3]。自噬是参与新生大鼠缺氧缺血后神经损伤的重要因素,在新生大鼠局灶性脑缺血模型中,抑制自噬后,脑损伤减轻[4]。已有研究表明,在新生儿HIE中,濒临死亡的神经元自噬显著增强,提示自噬增加与神经元死亡密切相关[5]。因此,探索神经元自噬的调控机制有利于阐明HIE的发病机制。最新研究表明,节律基因参与调控细胞自噬,使细胞自噬过程具有节律性[6]。节律因子Rev-erbα和Per1b敲除的斑马鱼中,自噬相关基因表达和自噬活性都增强,而且自噬节律出现紊乱[7]。自噬节律对维持细胞自噬稳定具有重要作用,但是关于自噬节律与缺氧缺血的研究还未见报道。本研究通过建立体内、体外缺氧缺血脑损伤模型,检测不同时间点自噬相关蛋白Beclin1和LC3的表达情况,研究缺氧缺血与自噬相关蛋白Beclin1和LC3表达节律的关系。并采用RNA干扰技术抑制神经元节律基因Clock表达,研究节律基因对自噬相关蛋白Beclin1和LC3的表达影响,以期为阐明缺氧缺血引起神经损伤的新机制及发现新的HIE治疗靶点奠定基础。
1 材料与方法 1.1 实验动物缺氧缺血动物模型采用10日龄SPF级Sprague-Dawley(SD)大鼠12只,雌雄不限,体重18~20 g,随机分为缺氧缺血组和假手术组,每组6只。神经元体外缺氧缺血模型采用孕18 d SPF级SD孕鼠3只。
1.2 实验试剂与仪器实验所需试剂:Neurobasal培养基、DMEM高糖培养基、DMEM无糖培养基、PBS、双抗、胰蛋白酶、胎牛血清(美国Gibco公司),L-谷氨酰胺、多聚赖氨酸、DNA酶I(DNAseⅠ)(美国Sigma公司),Clock shRNA慢病毒和阴性对照慢病毒(上海吉凯基因化学技术有限公司),RIPA细胞裂解液(上海碧云天生物技术有限公司),抗Clock抗体(英国Abcam公司);抗Beclin1抗体、抗LC3抗体(美国Novus公司);抗β-actin抗体、辣根过氧化物酶标记山羊抗兔和山羊抗小鼠IgG抗体(成都正能生物技术有限责任公司),ECL检测试剂盒(美国Millipore公司),预染蛋白Marker(立陶宛Fermentas公司)。
主要仪器:二氧化碳恒温培养箱(日本三洋公司);生物安全柜(德国贝克公司);倒置显微镜TE 2000-U(日本尼康公司);微量移液器、水平离心机、低温离心机(德国Eppendorf公司);化学发光仪(美国GE公司);聚丙烯酰胺凝胶电泳(SDS-PAGE)垂直电泳系统及湿式膜转移系统(美国BIO-RAD公司)。
1.3 模型建立动物缺氧缺血模型[8]:缺氧缺血组大鼠经异氟烷吸入麻醉后,结扎并切断右侧颈总动脉,术后送回母鼠处休息1 h,然后置于低氧仓(8%O2/92%N2混合气)内,37℃低氧处理2.5 h。假手术组仅分离颈总动脉,不结扎,不作低氧处理。
神经元体外缺氧缺血模型[8]:取孕18 d SD胎鼠大脑,分离出大脑皮质并剪碎,以0.25%胰蛋白酶和终浓度为10 μg/mL的DNAseⅠ在37℃孵箱中消化15 min,吸去消化液,加入4 mL含有10%胎牛血清的DMEM培养基终止消化,用1 mL移液器轻柔吹打,静置3 min后吸取上部细胞悬液,用70 μm细胞滤网过滤,再加入4 mL培养基,重复吹打剩余组织2次,收集细胞悬液离心,吹打成单细胞悬液,以2×106个/mL的细胞密度接种于培养皿中,置于37℃、5%CO2培养箱中培养7 d后分为对照组和氧糖剥夺(OGD)组,弃去培养基,用PBS轻轻洗涤两次,加入预处理的OGD培养基(无糖无血清DMEM培养基)模拟细胞缺血状态,置于37℃、5%CO2、1%O2缺氧培养箱中孵育2 h,对照组给予正常培养基置于正常条件培养箱中培养,OGD结束后两组细胞用PBS清洗后给予正常培养基于正常条件培养箱中继续培养。
1.4 神经元自噬相关蛋白表达节律检测体外培养7 d的神经元经50%马血清诱导2 h,使神经元细胞节律同步[9],然后参照1.3小节对神经元细胞进行分组和处理,当两组都换回正常培养基,置于正常条件培养箱中继续培养时,记为0 h,从0~48 h每间隔4 h收集OGD组和正常对照组神经元细胞,利用Western blot检测自噬相关蛋白Beclin1和LC3在各时间点的表达水平。实验独立重复3次。
1.5 标本采集新生大鼠缺氧缺血术后24 h,断头取脑,将脑组织置于冰上,去除嗅球和小脑,取结扎颈总动脉同侧大脑半球组织(右侧),去除脑白质,用眼科镊夹取海马组织后,将海马和皮层分别置于预冷的RIPA裂解液中。假手术组采取与缺氧缺血组大鼠相同方法,采集右侧皮层和海马组织,置于预冷的RIPA裂解液中。
1.6 神经元转染提取孕18 d SD胎鼠大脑皮层神经元细胞,按2×106个/mL的细胞密度接种于6孔板中,分为Clock shRNA干扰组和阴性对照组,细胞培养3 d后,分别用慢病毒包装的Clock shRNA病毒和阴性对照病毒感染细胞,每组设3个复孔。感染24 h后,换为正常培养基,继续培养3 d,收集细胞提取总蛋白。
1.7 Western blot检测蛋白表达分别提取神经元细胞、大鼠大脑皮层及海马组织总蛋白,并进行SDS-PAGE,然后转移至PVDF膜上,用脱脂奶粉封闭1 h,分别加入抗Clock抗体、抗Beclin1抗体、抗LC3抗体、抗β-Actin抗体,4℃孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的二抗,用ECL发光液(北京全式金生物技术有限公司)进行显色,用化学发光系统进行拍照分析。实验独立重复3次。
1.8 统计学分析采用SPSS 13.0统计软件对数据进行统计学分析。计量资料采用均数±标准差(x±s)表示,两组间比较采用t检验,P < 0.05为差异有统计学意义。
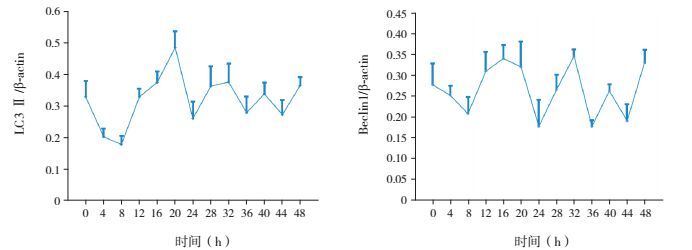
2 结果 2.1 两组不同时间点Beclin1和LC3表达情况体外正常培养神经元自噬相关蛋白Beclin1表达在24 h内呈现节律性波动,其中在8 h和24 h时处于表达低谷;在24~48 h内具有与24 h内相似的节律波动。同时,自噬相关蛋白LC3 Ⅱ的表达与Beclin1具有相似趋势,在24 h内也是在8 h和24 h时处于表达低谷,且在24~48 h内具有与24 h内相似的节律波动。Beclin1和LC3 Ⅱ的表达情况在3次独立重复实验中的变化趋势一致,提示神经元自噬相关蛋白Beclin1和LC3 Ⅱ的表达具有节律性。见图 1~2。

|
图 1 Western blot法检测神经元自噬相关蛋白Beclin1和LC3表达电泳图 |
|
图 2 Western blot法检测神经元自噬相关蛋白Beclin1和LC3表达情况(n=3) |
2.2 OGD处理后神经元自噬相关蛋白Beclin1和LC3表达情况
体外培养神经元经OGD处理后,自噬相关蛋白Beclin1和LC3 Ⅱ的表达随着时间的延长逐渐升高,不再呈现节律性波动(图 3~4),在40 h时开始出现表达降低。提示,OGD处理能够影响神经元自噬相关基因Beclin1和LC3 Ⅱ节律性表达。

|
图 3 Western blot法检测OGD处理后神经元自噬相关蛋白Beclin1和LC3表达电泳图 |

|
图 4 Western blot法检测OGD处理后神经元自噬相关蛋白Beclin1和LC3表达情况(n=3) |
2.3 缺氧缺血对神经元Clock蛋白表达的影响
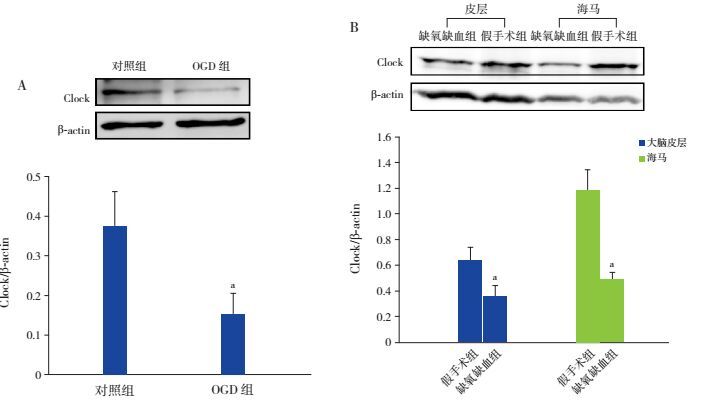
体外培养神经元经OGD处理后,与对照组相比,OGD组神经元Clock蛋白表达量显著降低(t=3.735,P < 0.05)。与体外培养神经元结果相似,新生大鼠经缺氧缺血处理后,缺氧缺血组大鼠大脑皮层和海马Clock蛋白表达量较假手术组均显著降低(分别t=3.628、7.365,P < 0.05)。表明缺氧缺血会引起神经元Clock蛋白表达降低。见图 5。
|
图 5 Western blot法检测神经元Clock蛋白的表达 A:体外培养神经元经OGD处理后,Clock基因蛋白表达电泳条带图及统计图(n=3);B:缺氧缺血处理后,新生大鼠大脑皮层和海马Clock基因蛋白表达电泳条带图及统计图(n=6)。a示与对照组/假手术组相比,P < 0.05。 |
2.4 抑制Clock基因表达对自噬相关蛋白Beclin1和LC3表达的影响
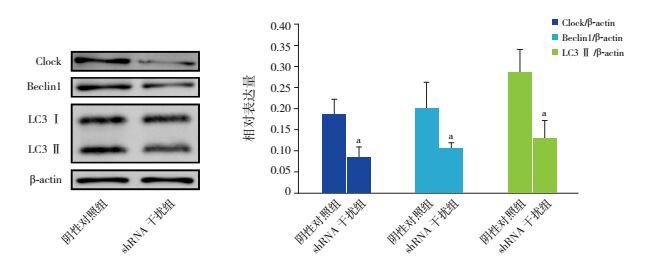
为了探明Clock基因表达降低能否影响自噬相关蛋白Beclin1和LC3的表达,采用慢病毒包装的Clock shRNA和阴性对照病毒感染体外培养神经元。与阴性对照组相比,Clock shRNA干扰组Clock表达显著降低(t=4.286,P < 0.05),表明成功抑制神经元Clock基因表达;与阴性对照组相比,抑制神经元Clock基因表达后,自噬相关蛋白Beclin1和LC3 Ⅱ的表达都显著降低(分别t=2.567、3.950,P < 0.05),提示Clock基因参与调控自噬相关蛋白Beclin1和LC3 Ⅱ的表达。见图 6。
|
图 6 抑制Clock基因表达对自噬相关基因Beclin1和LC3蛋白表达的影响 左图为Western blot检测相关蛋白表达电泳条带图,右图为统计图(n=3)。a示与阴性对照组相比,P < 0.05。 |
3 讨论
目前新生儿HIE发病机制的研究主要集中在探索缺氧缺血引起的神经损伤的机制。发育期中枢神经系统在缺氧缺血应激后会产生一系列级联反应,引起神经细胞死亡,参与调控神经细胞死亡的过程包括自噬、凋亡和坏死性凋亡等[10-11]。已有研究表明自噬在缺氧缺血引起的神经损伤过程中发挥重要作用。采用自噬激活剂雷帕酶素可致缺氧缺血后细胞凋亡明显增加[12]。然而最新研究表明,自噬在神经病理状态下具有双重作用,缺氧缺血引发神经细胞过度自噬会导致细胞死亡,但一些应激刺激下适度增加自噬可抵御应激损伤,发挥神经保护作用[13-15]。也有研究发现,细胞自噬过程具有节律性,并且自噬节律受到节律系统和节律基因的调控[6]。自噬的这种双重作用可能和自噬节律相关,维持神经细胞自噬节律稳定可能是神经细胞保持正常生理功能的重要因素之一。
我们建立体外缺氧缺血模型,探索神经元自噬相关基因Beclin1和LC3的表达是否具有节律性,且是否受到缺氧缺血的影响。Beclin1作为自噬信号通路中重要的因子,参与缺氧缺血诱导的自噬发生[16]。干扰Beclin1表达能够降低缺氧缺血诱导的自噬[17]。LC3 Ⅱ表达被认为是自噬体形成和成熟的标志。本研究发现,神经元细胞自噬相关蛋白Beclin1和LC3 Ⅱ的表达具有节律性,并且缺氧缺血会引起神经元Beclin1和LC3 Ⅱ的表达节律紊乱。由于Beclin1和LC3在自噬过程中具有重要作用,Beclin1和LC3 Ⅱ的表达具有节律性,表明神经元自噬具有节律性。而缺氧缺血会扰乱神经元的自噬节律,提示自噬节律在缺氧缺血引起的神经损伤中具有重要作用,值得进行深入研究。
最近有研究报道,缺氧缺血引起新生大鼠节律基因Clock表达异常[18]。Clock基因作为节律系统的核心基因,在多种组织中都有表达,并参与调控下游其他基因的表达[19-20]。并且,Clock基因在维持细胞正常生理活动中起到重要作用,如参与调控细胞增殖和凋亡等[21]。而且,节律基因还参与调控细胞自噬,使细胞自噬过程具有节律性[6]。节律因子Rev-erbα和Per1b敲除的斑马鱼中,自噬相关基因表达和自噬活性都增强,而且自噬节律出现紊乱[7]。因此,本课题组推测节律基因Clock可能参与了缺氧缺血引起的神经细胞自噬节律紊乱的调控。本研究发现,缺氧缺血引起新生大鼠神经元Clock基因蛋白表达降低。采用shRNA抑制神经元Clock基因表达后,神经元细胞中自噬相关蛋白Beclin1和LC3 Ⅱ表达降低,表明Clock基因能够调控自噬相关蛋白Beclin1和LC3 Ⅱ的表达,提示Clock基因调控的自噬信号通路可能参与缺氧缺血引起的神经细胞自噬节律紊乱的调控。而OGD处理后的神经元自噬相关蛋白Beclin1和LC3 Ⅱ的表达相较对照组有升高,与抑制神经元Clock基因表达后,神经元细胞中自噬相关蛋白Beclin1和LC3 Ⅱ表达降低的结果相反,这可能与Clock shRNA转染成功后3 d才检测Beclin1和LC3 Ⅱ的表达(OGD处理后48 h内完成蛋白检测),或在OGD处理过程中,可能存在其他调节Beclin1和LC3 Ⅱ表达的因素有关。由于自噬在缺氧缺血脑损伤中发挥重要的作用[22],因而自噬节律紊乱可能是缺氧缺血引起神经细胞损伤的新机制。缺氧缺血后神经细胞自噬的节律调控及效应也有待深入研究。
| [1] | Shankaran S, Laptook AR, Pappas A, et al. Effect of depth and duration of cooling on deaths in the NICU among neonates with hypoxic ischemic encephalopathy: a randomized clinical trial[J]. JAMA, 2014, 312 (24): 2629–2639. DOI:10.1001/jama.2014.16058 |
| [2] | Hurley JH, Young LN. Mechanisms of autophagy initiation[J]. Annu Rev Biochem, 2017, 86 : 225–244. DOI:10.1146/annurev-biochem-061516-044820 |
| [3] | Strzyz P. Autophagy: Nuclear autophagy in tumour suppression[J]. Nat Rev Mol Cell Biol, 2015, 16 (12): 700–701. |
| [4] | Liu Y, Shoji-Kawata S, Sumpter RM Jr, et al. Autosis is a Na+, K+-ATPase-regulated form of cell death triggered by autophagy-inducing peptides, starvation, and hypoxia-ischemia[J]. Proc Natl Acad Sci U S A, 2013, 110 (51): 20364–20371. DOI:10.1073/pnas.1319661110 |
| [5] | Ginet V, Pittet MP, Rummel C, et al. Dying neurons in thalamus of asphyxiated term newborns and rats are autophagic[J]. Ann Neurol, 2014, 76 (5): 695–711. DOI:10.1002/ana.v76.5 |
| [6] | Ma D, Lin JD. Circadian regulation of autophagy rhythm through transcription factor C/EBPβ[J]. Autophagy, 2012, 8 (1): 124–125. DOI:10.4161/auto.8.1.18081 |
| [7] | Huang G, Zhang F, Ye Q, et al. The circadian clock regulates autophagy directly through the nuclear hormone receptor Nr1d1/Rev-erbα and indirectly via Cebpb/ (C/ebpβ) in zebrafish[J]. Autophagy, 2016, 12 (8): 1292–1309. DOI:10.1080/15548627.2016.1183843 |
| [8] | Qu Y, Mao M, Zhao F, et al. Proapoptotic role of human growth and transformation-dependent protein in the developing rat brain after hypoxia-ischemia[J]. Stroke, 2009, 40 (8): 2843–2848. DOI:10.1161/STROKEAHA.109.553644 |
| [9] | Balsalobre A, Damiola F, Schibler U. A serum shock induces circadian gene expression in mammalian tissue culture cells[J]. Cell, 1998, 93 (6): 929–937. DOI:10.1016/S0092-8674(00)81199-X |
| [10] | Qu Y, Shi J, Tang Y, et al. MLKL inhibition attenuates hypoxia-ischemia induced neuronal damage in developing brain[J]. Exp Neurol, 2016, 279 : 223–231. DOI:10.1016/j.expneurol.2016.03.011 |
| [11] | Crino PB. The mTOR signalling cascade: paving new roads to cure neurological disease[J]. Nat Rev Neurol, 2016, 12 (7): 379–392. DOI:10.1038/nrneurol.2016.81 |
| [12] | Chen H, Xiong T, Qu Y, et al. mTOR activates hypoxia-inducible factor-1α and inhibits neuronal apoptosis in the developing rat brain during the early phase after hypoxia-ischemia[J]. Neurosci Lett, 2012, 507 (2): 118–123. DOI:10.1016/j.neulet.2011.11.058 |
| [13] | Puyal J, Ginet V, Grishchuk Y, et al. Neuronal autophagy as a mediator of life and death: contrasting roles in chronic neurodegenerative and acute neural disorders[J]. Neuroscientist, 2012, 18 (3): 224–236. DOI:10.1177/1073858411404948 |
| [14] | Su Y, Qu Y, Zhao F, et al. Regulation of autophagy by the nuclear factor κB signaling pathway in the hippocampus of rats with sepsis[J]. J Neuroinflammation, 2015, 12 : 116. DOI:10.1186/s12974-015-0336-2 |
| [15] | Nixon RA. The role of autophagy in neurodegenerative disease[J]. Nat Med, 2013, 19 (8): 983–997. DOI:10.1038/nm.3232 |
| [16] | Nazarko VY, Zhong Q. ULK1 targets Beclin-1 in autophagy[J]. Nat Cell Biol, 2013, 15 (7): 727–728. DOI:10.1038/ncb2797 |
| [17] | Xing S, Zhang Y, Li J, et al. Beclin 1 knockdown inhibits autophagic activation and prevents the secondary neurodegenerative damage in the ipsilateral thalamus following focal cerebral infarction[J]. Autophagy, 2012, 8 (1): 63–76. DOI:10.4161/auto.8.1.18217 |
| [18] | Sun B, Feng X, Ding X, et al. Expression of Clock genes in the pineal glands of newborn rats with hypoxic-ischemic encephalopathy[J]. Neural Regen Res, 2012, 7 (28): 2221–2226. |
| [19] | Doi M, Hirayama J, Sassone-Corsi P. Circadian regulator CLOCK is a histone acetyltransferase[J]. Cell, 2006, 125 (3): 497–508. DOI:10.1016/j.cell.2006.03.033 |
| [20] | Peek CB, Affinati AH, Ramsey KM, et al. Circadian clock NAD+ cycle drives mitochondrial oxidative metabolism in mice[J]. Science, 2013, 342 (6158): 1243417. DOI:10.1126/science.1243417 |
| [21] | Takahashi JS. Transcriptional architecture of the mammalian circadian clock[J]. Nat Rev Genet, 2017, 18 (3): 164–179. |
| [22] | Galluzzi L, Bravo-San Pedro JM, Blomgren K, et al. Autophagy in acute brain injury[J]. Nat Rev Neurosci, 2016, 17 (8): 467–484. DOI:10.1038/nrn.2016.51 |
 2017, Vol. 19
2017, Vol. 19


