2. 海军总医院儿科, 北京 100048
早产儿脑白质损伤(white matter injury, WMI)是一种由于感染、缺氧缺血等因素引起的以脑白质损伤为主的疾病,为早产儿最常见、最严重的脑损伤形式[1]。目前对早产儿WMI的治疗缺乏有效的方法。少突胶质前体细胞(OPCs)是中枢神经系统中少突胶质细胞(OLs)的前体。目前研究认为,OPCs是WMI后髓鞘再生的主要来源细胞[2-3],OPCs在损伤早期的大量丢失和成熟障碍与髓鞘损伤和随后的神经功能障碍高度相关[4]。在采用OPCs移植治疗中枢神经损伤性疾病的研究中显示,使用OPCs移植后,植入的细胞可以通过神经营养作用、旁分泌作用等途径保护神经组织,促进再髓鞘化,维持正常神经功能[5-6],显示了不错的治疗效果。尽管如此,在治疗早产儿WMI的研究中目前依旧少见OPCs的影子。因此,本研究在成功创建了早产儿WMI大鼠模型[7-8]的基础上,进行了OPCs移植治疗早产儿WMI的实验研究,分别对建模后5、9、14 d大鼠进行经脑室/白质的OPCs移植,在大鼠60日龄和90日龄时进行电镜下脑髓鞘评估和神经功能评估,评价OPCs移植治疗早产儿脑白质损伤的长期效果。
1 材料与方法 1.1 实验动物分组与模型制备清洁级新生Sprague-Dawley大鼠80只,雌雄不限,由北京维通利华提供孕鼠,在本院动物房出生,动物许可证号:SCXK(京)2012-0001。动物实验均报送海军总医院伦理学委员会,经批准符合伦理学要求。将80只新生大鼠进行标号,然后按随机数字表法随机分配为假手术组、模型组、5 d脑室移植组、5 d白质移植组、9 d脑室移植组、9 d白质移植组、14 d脑室移植组和14 d白质移植组,每组10只。新生大鼠脑白质损伤模型的制备参照参考文献[7],模型组和各移植组的新生大鼠在出生3 d时仰卧位胶布固定,沿颈正中切口切开皮肤,分离暴露出右侧颈总动脉,用电凝笔将其离断,术后送入6%氧气、94%氮气、37℃恒温缺氧箱中缺氧80 min,之后送回母鼠笼内。假手术组仅在出生3 d时手术游离右侧颈总动脉,不予离断和缺氧。
1.2 细胞培养和制备OPCs由本实验室制备,采用自愿流产的孕10~12周人胚胎脑组织(经本院伦理委员会批准),机械分散、离心、分离等步骤后形成单细胞悬液,接种于神经干细胞专用培养基上,传代扩增得到神经干细胞,经体外诱导培养制得OPCs。使用A2B5、O4、PDGFRs等OPCs特异性标志物鉴定为OPCs。经超速离心,浓缩于0.9%生理盐水中制成细胞悬液,每5 μL生理盐水中含细胞3×105。
1.3 移植前环孢素注射各移植组均在移植前3 d开始经腹腔注射环孢素,剂量10 mg/kg,每日1次,连用至OPCs移植后3 d,共使用6 d。模型组和假手术组于相应日龄注射环孢素,剂量用法与移植组相同。
1.4 移植各移植组分别在建模后第5、9、14天于右侧脑室/脑白质进行OPCs移植。6%水合氯醛麻醉大鼠后固定于脑立体定位仪上,沿颅中线切开头皮暴露颅骨。以前囟为参照点,穿刺定位点包括前后、中线、深度;5 d脑室移植组定位于前囟后0.5 mm、中线右侧2.0 mm、深度2.0 mm;5 d白质移植组定位于前囟后1.0 mm、中线右侧1.5 mm、深度1.0 mm;9 d脑室移植组定位于前囟后1.0 mm、中线右侧1.5 mm、深度2.5 mm;9 d白质移植组定位于前囟后1.0 mm、中线右侧1.5 mm、深度1.0 mm;14 d脑室移植组定位于前囟后1.0 mm、中线右侧1.5 mm、深度2.5 mm;14 d白质移植组定位于前囟后1.0 mm、中线右侧1.5 mm、深度1.0 mm;10 μL微量注射器吸取5 μL OPCs悬液,采用上述定位点准确定位位置后,注射器缓慢注入,速度0.5 μL/min。注射完毕后留置5 min,缓慢取出,用棉签压迫片刻,观察无出血后缝合头皮,待鼠苏醒后送回母鼠旁喂哺。
1.5 神经功能缺陷评分参照文献[9]所述办法,在大鼠60日龄和90日龄时由不了解实验的第三方人员进行大鼠神经功能缺陷评分(mNSS)测定,每组8只大鼠。对反映大鼠神经功能的运动、感觉、平衡、反射活动和异常运动全面评估,总分18分,分值越高表明神经功能障碍越严重。
1.6 电镜制备大鼠60日龄和90日龄时,在大鼠mNSS测定后,每组随机取2只大鼠。6%水合氯醛麻醉后解剖暴露心脏,先用生理盐水250 mL/kg行心脏灌注,然后2.5%戊二醛250 mL/kg灌注,取出大脑并分离出脑室周围组织,置于2.5%戊二醛中4℃固定,之后经1%锇酸后固定、环氧树脂包埋、超薄切片机切片,最后醋酸铀和柠檬酸铅染色。透射电镜观察,拍照分析。
1.7 统计学分析采用SPSS 19.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,各组间比较采用单因素方差分析,组间两两比较采用SNK-q检验;配对资料采用配对t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 实验动物术中观察以脑立体定位仪行OPCs移植,术中顺利,进针过程无阻滞,准确定位后缓慢注入细胞,注射过程避光,术中大鼠麻醉平稳、注射过程顺利,注射完毕留针5 min,拔针后观察颅骨表面未见出血、液体渗漏等情况发生。术后除3只鼠出现暂时性呼吸停止、麻醉时间延长外,其余鼠无不良反应发生,大鼠苏醒后活动如常。
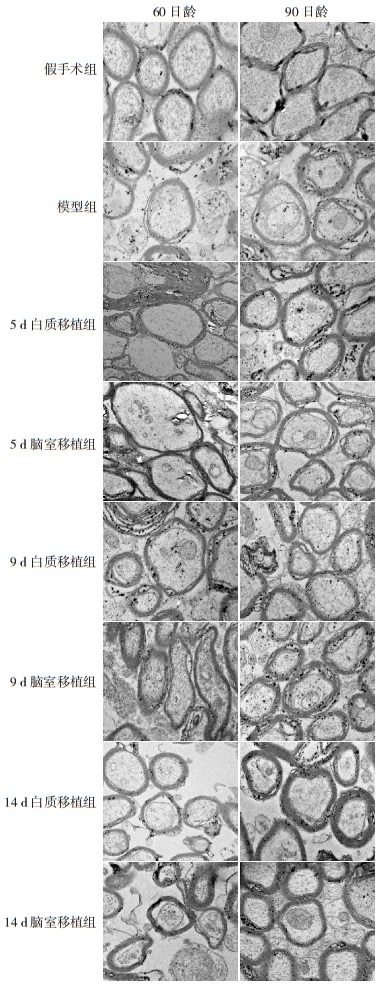
2.2 电镜病理评估60日龄大鼠中,假手术组的髓鞘形态正常,髓鞘厚度均匀一致,边界清晰,髓鞘同心圆结构正常,致密层无分离崩解。模型组的髓鞘肿胀、崩解,致密层分离,髓鞘正常的多层同心圆结构破坏。与模型组相比较,5、9、14 d脑室/白质移植组的髓鞘损害程度略有改善,其中14 d脑室/白质移植组改善最为明显。90日龄大鼠中,假手术组和模型组与60日龄大鼠的镜下髓鞘结构特点相同,5、9、14 d 90日龄脑室/白质移植组相比于60日龄同时间点脑室/白质移植组大鼠的髓鞘损害程度明显减轻,尤其是14 d脑室/白质移植组的髓鞘明显增厚,肿胀减轻,致密层分离现象减少,同心圆结构大致保持完整。不过,无论在60日龄还是90日龄时,各组各时间点脑室移植组与白质移植组间比较差异均不显著。见图 1。
|
图 1 60日龄和90日龄大鼠电镜下髓鞘形态(×70 000) 60日龄和90日龄假手术组髓鞘厚度均匀一致,边界清晰,同心圆结构正常;而相应模型组髓鞘变薄并肿胀、崩解,致密层分离;5 d、9 d、14 d脑室/白质移植组的髓鞘结构相比模型组更为完整,其中90日龄时14 d移植组大鼠髓鞘明显增厚,肿胀减轻,同心圆结构大致完整,致密层分离现象减少。 |
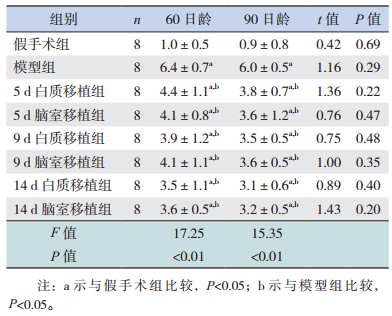
2.3 各组大鼠mNSS结果
各组大鼠60日龄和90日龄mNSS结果显示,与假手术组比较,模型组和各时间点脑室/白质移植组mNSS均增高(P < 0.05);与模型组比较,各时间点脑室/白质移植组的mNSS均下降(P < 0.05);各时间点脑室/白质移植组间mNSS比较差异无统计学意义(P > 0.05);同组中60日龄和90日龄大鼠mNSS配对比较差异均无统计学意义(P > 0.05)。结果表明移植组的神经功能损害程度比模型组显著减轻,但与移植时间、部位和大鼠日龄无关。见表 1。
| 表 1 各组大鼠mNSS比较 (x±s) |
3 讨论
本系列研究先期进行了早产儿WMI大鼠模型制作的探索研究,单侧颈总动脉离断+6% O2缺氧80 min的模型组苏木精-伊红染色结果显示手术侧白质损伤,而皮质和海马损伤较小,MBP染色显示手术侧外囊区髓鞘明显丢失,结果显示采用上述方法制作的早产儿WMI模型形成了脑白质选择性损伤,提示模型成功[8]。在此基础上,本研究成功进行了对早产儿WMI模型大鼠OPCs移植治疗的实验研究。
过往研究显示,OPCs在早产儿WMI发生发展过程中起着中心作用,脑损伤时感染、缺氧等不利因素导致OPCs损伤并使OLs成熟过程终止,进而形成髓鞘发育不良、脑白质容量下降和脑室扩大的早产儿WMI病理改变[10-11]。外源性OPCs移植可能是一条可行的治疗早产儿WMI的路径,目前已经有有限的几例使用OPCs治疗髓鞘形成不良相关疾病的研究,2006年,Givogri等[12]在异染性脑白质营养不良(MLD)小鼠上进行的少突胶质祖细胞(OLPs)移植实验证实了外源性OLPs能够和内源性OLPs整合并分化替代受损的OLs。该研究同时显示MLD脑组织更易接受外源性OLPs的存活和分化迁移,而健康脑组织对外源性OLPs的接受能力更为低下。2015年,Chen等[9]在早产儿WMI模型大鼠造模后立即将OPCs移植入大鼠脑皮质中,6周后病理检验鼠脑发现植入的细胞存活且促进NSC的增殖、抑制神经元凋亡,鼠髓鞘形成增多,鼠的空间学习和记忆能力改善。这些研究结果均提示对早产儿WMI进行OPCs的脑移植是有效、可行的治疗手段。本研究采用OPCs在早产儿脑白质损伤模型大鼠建模后5 d、9 d和14 d移植,大鼠日龄60 d和90 d时检查鼠脑,结果显示移植组大鼠90日龄时相比模型组的脑髓鞘病变明显改善,提示OPCs移植可以有效减轻早产儿WMI的髓鞘损害。
移植时间点、移植部位和移植细胞数量等都是影响移植效果的重要因素。移植时间点的选择上,目前对于细胞移植治疗早产儿损伤,普遍都是选择在建模后第7天移植。在对脑损伤的研究中发现,缺血缺氧损伤后3~7 d是脑内各种生化物质和因子激活的“窗口期”[13],此时一方面各种营养因子、有丝分裂原的大量分泌有利于移植物的存活和分化;另一方面,此时也是炎症反应、自由基损害和兴奋性氨基酸毒性的爆发期,大量炎症因子、脂质过氧化物、谷氨酸的蓄积使OPCs严重损害和分化障碍,对外源性植入的OPCs存活、分化和迁移更为不利[11, 14]。研究发现,如果OPCs能够避免受到急性期炎症爆发的影响,OPCs向OLs的分化速度将加快,对外界耐受性增加[15],因此延迟移植时间可能是一有益的选择。本研究同时设置了建模后5 d、9 d、14 d移植组,通过比较各组间差异,以期望找到最佳的移植时间点。移植部位的选择对移植成功同样重要,目前常用的脑移植部位有皮质、胼胝体、脑室等部位。早产儿WMI选择性损伤脑白质部位,尤其是脑室周围,依据这一特殊病理现象,脑室和白质部位的移植均可能使细胞直接进入损伤区域,发挥细胞治疗的作用。本实验同时设计了脑室和白质移植组,旨在比较移植部位间的差异,以期找到最佳的移植部位。移植细胞数量同样需要斟酌,数量过多增加移植后不良反应发生率,但是移植细胞数量结果过少难以起到治疗作用,参考国内外文献,我们确定以3×105个细胞浓缩5 μL溶液进行移植,已在安全性和治疗效果之间取得平衡。损伤区域局部炎症反应往往导致移植失败,OPCs对炎症反应和炎症因子高度敏感,损伤区的炎症反应严重抑制了OPCs的存活和分化迁移[16]。为抑制损伤区的炎症反应对OPCs的不利影响,本研究在移植前3 d开始每日注射环孢素10 mg/kg,连用6 d。
由于实验条件限制,多数研究选择在移植后30 d内观察结果,对移植后超过30 d的观察研究甚少,由此导致我们对细胞移植治疗早产儿WMI的长期效果存在空白。早产儿WMI后,髓鞘发育障碍的修复历时漫长,移植后细胞对损伤恢复的作用非常复杂,短时间内的观察容易忽略移植细胞的长期治疗效果。本研究选择在大鼠日龄60 d和90 d观察结果,以期观察到OPCs移植对脑发育尤其是髓鞘发育的长期影响。本实验直接采用电镜观察髓鞘损伤的修复情况,采用mNSS评估大鼠神经功能的改善程度。电镜下髓鞘观察显示,随着移植后时间延长,90日龄大鼠相比60日龄大鼠的髓鞘损害程度明显减轻,髓鞘增厚,肿胀减轻,结构破坏更少,与同龄的模型组相比也有同样结果。提示植入OPCs对髓鞘损伤的修复存在长期效应,可能与大脑的可塑性、植入OPCs与宿主环境的相互作用等有关。相比于5 d和9 d移植组,14 d移植组的髓鞘修复效果最为显著,显示延迟移植时间能够获得最大的益处,可能是因为这一移植时间点避开了炎症爆发的窗口期,从而保护了植入的细胞。无论60日龄还是90日龄时,对应的脑室和白质移植组间均无明显差异,提示脑室和白质移植途径间差别不大。
对早产儿WMI模型大鼠行OPCs移植治疗的研究显示了OPCs移植对治疗早产儿脑白质损伤具有可观的应用潜力,为今后更进一步的研究提供了方向。但对于OPCs移植治疗早产儿WMI的具体调控机制目前尚不清楚,OPCs与宿主环境的相互作用、OPCs在体内迁移分化的机制等均有待更进一步的深入探讨,对OPCs参与宿主神经髓鞘修复的证据尚需要更有力的证据。
| [1] | Elitt CM, Rosenberg PA. The challenge of understanding cerebral white matter injury in the premature infant[J]. Neuroscience, 2014, 276 : 216–238. DOI:10.1016/j.neuroscience.2014.04.038 |
| [2] | Boulanger JJ, Messier C. From precursors to myelinating oligodendrocytes:contribution of intrinsic and extrinsic factors to white matter plasticity in the adult brain[J]. Neuroscience, 2014, 269 : 343–366. DOI:10.1016/j.neuroscience.2014.03.063 |
| [3] | Armstrong RC, Mierzwa AJ, Sullivan GM, et al. Myelin and oligodendrocyte lineage cells in white matter pathology and plasticity after traumatic brain injury[J]. Neuropharmacology, 2016, 110 (Pt B): 654–659. |
| [4] | Back SA, Luo NL, Borenstein NS, et al. Late oligodendrocyte progenitors coincide with the developmental window of vulnerability for human perinatal white matter injury[J]. J Neurosci, 2001, 21 (4): 1302–1312. |
| [5] | Kawabata S, Takano M, Numasawa-Kuroiwa Y, et al. Grafted human iPS cell-derived oligodendrocyte precursor cells contribute to robust remyelination of demyelinated axons after spinal cord injury[J]. Stem Cell Reports, 2016, 6 (1): 1–8. DOI:10.1016/j.stemcr.2015.11.013 |
| [6] | Fan HB, Chen LX, Qu XB, et al. Transplanted miR-219-overexpressing oligodendrocyte precursor cells promoted remyelination and improved functional recovery in a chronic demyelinated model[J]. Sci Rep, 2017, 7 : 41407. DOI:10.1038/srep41407 |
| [7] | Stadlin A, James A, Fiscus R, et al. Development of a postnatal 3-day-old rat model of mild hypoxic-ischemic brain injury[J]. Brain Res, 2003, 993 (1-2): 101–110. DOI:10.1016/j.brainres.2003.08.058 |
| [8] | 杨印祥, 索磊, 杜庆安, 等. 缺氧时间对脑白质损伤程度影响的实验研究[J]. 临床儿科杂志, 2015, 33 (10): 883–886. DOI:10.3969/j.issn.1000-3606.2015.10.011 |
| [9] | Chen LX, Ma SM, Zhang P, et al. Neuroprotective effects of oligodendrocyte progenitor cell transplantation in premature rat brain following hypoxic-ischemic injury[J]. PLoS One, 2015, 10 (3): e115997. |
| [10] | Volpe JJ. Systemic inflammation, oligodendroglial maturation, and the encephalopathy of prematurity[J]. Ann Neurol, 2011, 70 (4): 525–529. DOI:10.1002/ana.v70.4 |
| [11] | Back SA. White matter injury in the preterm infant:pathology and mechanisms[J]. Acta Neuropathol, 2017.[Epub ahead of print] |
| [12] | Givogri MI, Galbiati F, Fasano S, et al. Oligodendroglial progenitor cell therapy limits central neurological deficits in mice with metachromatic leukodystrophy[J]. J Neurosci, 2006, 26 (12): 3109–3119. DOI:10.1523/JNEUROSCI.4366-05.2006 |
| [13] | Shuaib A, Murabit MA, Kanthan R, et al. The neuroprotective effects of gamma-vinyl GABA in transient global ischemia:a morphological study with early and delayed evaluations[J]. Neurosci Lett, 1996, 204 (1-2): 1–4. DOI:10.1016/0304-3940(96)12336-3 |
| [14] | Bugiani M, Postma N, Polder E, et al. Hyaluronan accumulation and arrested oligodendrocyte progenitor maturation in vanishing white matter disease[J]. Brain, 2013, 136 (Pt 1): 209–222. |
| [15] | Kinney HC. Human myelination and perinatal white matter disorders[J]. J Neurol Sci, 2005, 228 (2): 190–192. DOI:10.1016/j.jns.2004.10.006 |
| [16] | Hagberg H, Mallard C, Ferriero DM, et al. The role of inflammation in perinatal brain injury[J]. Nat Rev Neurol, 2015, 11 (4): 192–208. DOI:10.1038/nrneurol.2015.13 |
 2017, Vol. 19
2017, Vol. 19