2. 江苏大学医学院, 江苏 镇江 212013
患儿,女,汉族,12 d,系第1胎第1产。因新生儿疾病筛查异常提示高甲硫氨酸血症入院。患儿于胎龄40+3周剖宫产出生,出生体重4 580 g,身长52 cm,1分钟和5分钟Apgar评分均为9分,出生情况无异常。其母26岁,孕期各项检查均未发现异常。患儿出生3 d后家属自愿接受新生儿疾病筛查以排除29种遗传代谢疾病,初步筛查结果异常。遂将患儿召回行进一步检查。
入院体格检查:患儿吃奶好,无青紫、气促,无惊厥,无呕吐、腹胀,大小便正常;神志清,精神反应好;口唇红,面色红黄,皮肤微黄染,无皮疹、出血点;全身淋巴结无肿大;前囟平软,大小为1.5 cm;两侧瞳孔等大等圆,对光反射灵敏;颈软,胸廓两侧对称;呼吸45次/min,两肺呼吸音清;脐带干燥、未脱;腹软,肝脾无肿大,肠鸣音正常;四肢肌张力正常,生理反射正常。
按新生儿疾病筛查常规,患儿出生后72 h、充分哺乳6次后,足跟采集血斑进行新生儿遗传代谢病筛查。结果显示,促甲状腺激素(TSH)为4.46 U/mL,苯丙氨酸(Phe)为0.807 mg/dL,17α-羟孕酮(17-OHP)为3.38 nmol/L,均未见异常。串联质谱初次筛查发现甲硫氨酸(Met)为101 µmol/L(参考值:8.0~55.0 µmol/L),Met/Phe比值为2.29(参考值:0.16~1)。于出生后12 d召回重新采集血样进行复查,结果显示Met 152 µmol/L,Met/Phe比值4.48,疑似“高甲硫氨酸血症”。血常规、肝功能未见明显异常。
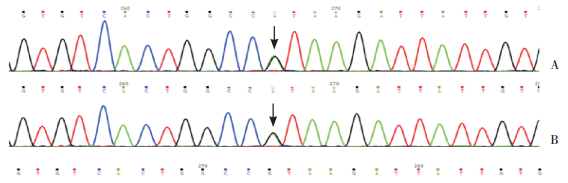
基因分析:在监护人知情同意下采集患儿及患儿父母外周血2 mL,根据文献方法[1],对目的基因(常见的高甲硫氨酸血症致病基因MAT1A、GNMT、ADK、AHCY)进行扩增、文库扩建、测序反应、数据分析。最后对这些变异位点进行功能注释并通过Sanger测序验证。经基因检测,发现该患儿MAT1A基因存在1个错义突变:c.791G > A(p.R264H)(图 1A),为杂合突变,经人类基因突变数据库(HGMD)查询,其ID为CM970910,呈显性遗传,可导致高甲硫氨酸血症。其他常见高甲硫氨酸血症致病基因GNMT、ADK、AHCY经测序检测未发现可疑致病性突变。对患儿及其父母进行Sanger测序验证发现,其父亲携带了与患儿相同的错义突变(图 1B),表明患儿突变来源于其父亲。对其父亲做了串联质谱的检查,其父串联检测正常,血浆Met浓度正常(47 µmol/L)。
|
图 1 患儿及其父亲MAT1A基因Sanger测序结果 A:患儿MAT1A基因存在c.791G > A错义突变;B:患儿父亲携带了该错义突变。箭头所示为突变位点。 |
治疗随访:按文献报道方案[2],根据患儿血浆Met浓度确定治疗方案(若血浆Met浓度超过300~350 µmol/L才给予特殊饮食及药物治疗),并常规随访,检测血浆Met浓度。本例患儿血浆Met浓度为152 µmol/L,因此未给予特殊饮食治疗。患儿1周岁体检时体格发育及智力发育正常,血浆Met浓度为77 µmol/L,较前几次检测稍有下降。
讨论:串联质谱技术可实现同时进行数十种代谢物分析,检测出包括氨基酸、有机酸、脂肪酸氧化代谢紊乱在内的多种遗传代谢性疾病。本例患儿通过串联质谱技术初筛最终确诊为高甲硫氨酸血症。原发性高甲硫氨酸血症可由导致蛋氨酸腺苷转移酶Ⅰ/Ⅲ缺乏的相关基因(MAT1A、GNMT、AHCY等)突变引起,这些突变基因有的表现为隐性遗传,有的表现为显性遗传。本例患儿仅检测出1个致病位点(MAT1A基因R264H突变),该突变位点为显性突变位点[3]。高甲硫氨酸血症的发现一般都是通过新生儿串联质谱筛查提示血片中Met含量异常增高,经召回后确认诊断。
高甲硫氨酸血症的报道甚少,关于其发病率也有较大差异。Chien等[4]报道在1 701 591位中国台湾人群中确诊16例单纯型高甲硫氨酸血症,发病率为1/106 349,其中8例为MAT1A基因突变。Couce等[5]报道西班牙人群中高甲硫氨酸血症发病率约为1/23 469,所报道的6例患者中5例为MAT1A基因缺陷。Nagao等[6]报道日本人群发病率为1/107 850。
高甲硫氨酸血症与遗传的关系备受关注,目前已知有6种遗传因素可导致甲硫氨酸异常,包括甲硫氨酸腺苷转移酶(MATⅠ/Ⅲ)、胱硫醚合成酶(CBS)、甘氨酸N-甲基转移酶缺陷(GNMT)、S-腺苷高半胱氨酸水解酶、Citrin缺乏症和延胡索酰乙酰乙酸水解酶(FAH)[7]。其中以MATⅠ与Ⅲ两种异构体缺陷最为多见,其编码基因为MAT1A,定位于人类10q23.1。本文报道的这例高甲硫氨酸血症确诊患儿即MAT1A基因存在错义突变。迄今为止,国内外已报道该基因15种突变,大多为错义突变,普遍认为突变的方式不仅有地区、种族的差异,而且与疾病的临床表现、疾病程度、治疗方案都有一定关系[8-9]。因此,明确病例基因类别极为必要。本例患儿的突变为R264H,体外研究发现第264位氨基酸残基参与亚单位聚合之间盐桥的形成,R264H突发的显性效应是通过影响R264/R264H二聚体形成从而降低酶的活性[3]。Chien等[4]首次报道的中国台湾人群中MAT1A基因以P357L突变最为多见,3例为R264H突变。随后更新串联质谱技术筛查新确诊的11例患儿中5例为R264H突变[8]。Couce等[5]报道的5例西班牙人群高甲硫氨酸血症均为R264H突变。因此,R264H突变可能是较为常见的突变类型,但我国大陆尚未有高甲硫氨酸血症R264H突变的报道。
单纯性高甲硫氨酸血症是否应当常规进行饮食控制治疗存在争议。然而国内外专家普遍认为,对于MAT1A基因缺陷引起的高甲硫氨酸血症一般临床预后良好,特别是R264H突变[8]。本例确诊患儿未进行特殊治疗,定期复查血浆Met水平,目前患儿生长发育良好。
| [1] | 孙云, 马定远, 杨贵江, 等. 一例瓜氨酸血症临床特征及ASSl基因突变分析[J]. 中华医学遗传学杂志, 2015, 32 (5): 745–747. |
| [2] | 叶军. 高甲硫氨酸血症[M]//顾学范. 临床遗传代谢病. 北京: 人民卫生出版社, 2015: 57-59. |
| [3] | Chamberlin ME, Ubagai T, Mudd SH, et al. Dominant inheritance of isolated hypermethioninemia is associated with a mutation in the human methionine adenosyltransferase 1A gene[J]. Am J Hum Genet, 1997, 60 (3): 540–546. |
| [4] | Chien YH, Chiang SC, Huang A, et al. Spectrum of hypermethioninemia in neonatal screening[J]. Early Hum Dev, 2005, 81 (6): 529–533. DOI:10.1016/j.earlhumdev.2004.11.005 |
| [5] | Couce M, Bóveda MD, Castiñeiras DE, et al. Hypermethioninaemia due to methionine adenosyltransferase Ⅰ/Ⅲ (MAT Ⅰ/Ⅲ) deficiency:diagnosis in an expanded neonatal screening programme[J]. J Inherit Metab Dis, 2008, 31 (Suppl 2): S233–S239. |
| [6] | Nagao M, Tanaka T, Furujo M. Spectrum of mutations associated with methionine adenosyltransferase Ⅰ/Ⅲ deficiency among individuals identified during newborn screening in Japan[J]. Mol Genet Metab, 2013, 110 (4): 460–464. DOI:10.1016/j.ymgme.2013.10.013 |
| [7] | Schweinberger BM, Wyse AT. Mechanistic basis of hypermethioninemia[J]. Amino Acids, 2016, 48 (11): 2479–2489. DOI:10.1007/s00726-016-2302-4 |
| [8] | Mudd SH. Hypermethioninemias of genetic and non-genetic origin:A review[J]. Am J Med Genet C Semin Med Genet, 2011, 157C (1): 3–32. |
| [9] | Chien YH, Harvey MS, Chung LN, et al. Spectrum of hypermethioninemia in Taiwan[J]. Jpn J Inherit Metab Dis, 2008, 24 (1): 66–70. |
 2017, Vol. 19
2017, Vol. 19
