患儿,男,11岁,反复抽搐10年余。患儿10年前(生后7个月)无明显诱因出现抽搐,表现为双眼凝视、双手握拳、意识丧失、四肢强直,无口唇发绀、流涎、四肢抖动、大小便失禁等,每月发作1~2次,每次持续数秒至数分钟,外院诊断“癫癎”,予丙戊酸钠溶液口服,定期检测血药浓度均达标,发作次数无明显减少,多次动态脑电图监测提示异常:背景活动慢,双侧前头部和双侧枕、后颞区多量尖波、2.5~3 Hz尖慢波散发,右侧为著,头颅磁共振(平扫+弥散加权成像)提示左侧脑室体后角旁异常信号、双侧颞叶脑沟稍宽,癫癎基因芯片检测无异常,先后加用或换用托吡酯(每日5 mg/kg)、拉莫三嗪(每日4.2 mg/kg)、左乙拉西坦(每日45 mg/kg)、奥卡西平(每日40 mg/kg),并于4年前在外院行“左侧迷走神经刺激器植入术”,术后初期最长有1年5个月无抽搐发作,但后期发作逐渐增多,近2年每周发作5~7次,入院前6个月患儿食纳明显变少。患儿为第1胎第1产,足月剖宫产出生,出生体重不详;2个月时发现“先天性白内障”,于2岁行“人工晶体植入术”;生长发育较正常同龄儿童落后:5个月抬头、9个月独坐,1岁2个月独站,1岁6个月独走,2岁能叫“爸爸、妈妈”,3岁能跑及与人简单交流,现交流少,走路易摔跤,不会数数、未上学;食量少,近2~3年体重未增加。
入院体查:体重19.3 kg(< P3),神志清楚,发育、营养差,反应差,交流极少,体查不能配合,皮肤弹性差,皮下脂肪菲薄,头围49 cm(< P3),眼距宽,耳位偏低,心音有力,心率92次/min、律齐、未及杂音,双肺呼吸音清,未及啰音,腹平软,肝脾肋下未触及,外生殖器未见异常,脊柱、四肢无畸形,四肢肌力、肌张力降低,双下肢膝腱反射对称引出,病理征均阴性。血常规、肾功能、心肌酶、血脂、血糖、电解质均大致正常;肝功能:ALT 66 U/L(参考值9~50 U/L),余项正常;丙戊酸浓度:77 μg/mL(参考值50~100 μg/mL);血氨、乳酸、血气分析及血、尿代谢筛查无异常;线粒体热点突变基因(3243A、8344A、8993T、11778G)测序无异常。复查脑电图(见图 1)提示异常:右侧枕、后颞区棘波、多棘波发放,波及右侧半球及左侧枕区,监测到清醒期1次右侧后头部起始的局灶性发作。
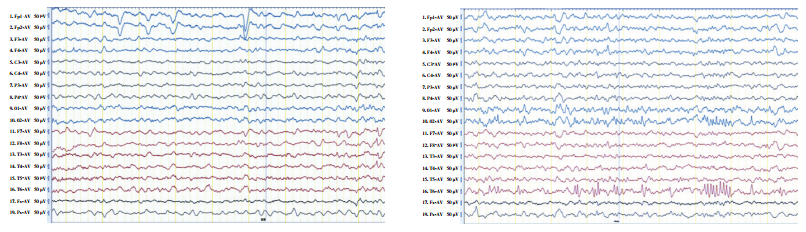
|
图 1 患者发作间期脑电图 A.清醒安静状态下双侧枕区可见低-中波幅6~7 Hz θ节律,夹杂少量低-中波幅8~9 Hz α活动及低波幅快波;B.睡眠期右侧枕、后颞区可见大量中波幅棘波、多棘波发放,可波及右侧半球及左侧枕区。 |
本例患者最突出的表现为难以控制的癫癎发作,根据国际抗癫癎联盟(International League Against Epilepsy, ILAE)指南[1],排除误诊、误治或人为因素后,可诊断药物难治性癫癎(drug-resistant epilepsy, DRE)。本例患者影像学检查未见明显结构性改变,排除了感染性、炎症免疫性、代谢性等因素的参与,结合其面容异常、先天性白内障、智力障碍、小头畸形等特点,高度怀疑遗传学因素致病的可能,进行染色体核型分析及单核苷酸多态性微阵列芯片(single nucleotide polymorphism microarray, SNP array)检测,结果分别为“46,XY,r(14)(p12q32)”(见图 2)及“染色体14q32.33杂合缺失约3.2 Mb”(见图 3),最终诊断为存在14号染色体长臂末端微缺失的14号环状染色体综合征(ring 14 chromosome syndrome)。予以胃管鼻饲喂养及加强护理等对症治疗,并继续前述药物治疗,患儿抽搐无明显变化,最终于12岁因多脏器功能衰竭死亡。
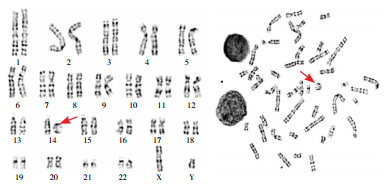
|
图 2 患者染色体核型分析 46, XY, r(14)(p12q32),箭头处所指为环状14号染色体。 |
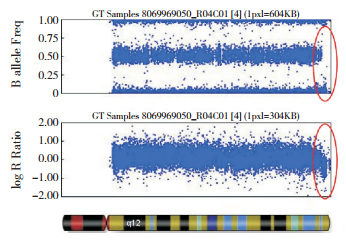
|
图 3 患者SNP array分析结果 14q32.33区域(红圈标记)B等位基因频率分别位于0和1,结合log R值下降,提示该区域存在杂合缺失。 |
讨论:尽管新的抗癫癎药物不断被研发,仍有20%~30%的癫癎患者为DRE[2]。寻找“难治”的病因及调整治疗是诊治的关键。相当部分DRE患者被发现存在遗传因素的参与,但染色体异常相对少见,以往20号环状染色体综合征较为人知。14号环状染色体综合征于1971年由Gilgenkrantz等[3]首次报道,目前全球仅有70余例报道,国内仅6例报道[4]。14号环状染色体综合征最常见的表现为智力障碍、癫癎、眼部病变、肌张力低下和小头畸形,几乎所有患者都存在癫癎发作,癫癎发作形式多样,全面性发作在起初被认为是常见发作类型,但最近文献报道认为局灶性发作更为常见,以痉挛发作、背景高度失律为表现者罕见[5]。此类患者的癫癎发作具有早发以及耐药的特点,也有丛集性以及出现持续状态的趋势,大多数患者的发病年龄 < 1岁,平均起病年龄9.4个月(0~30个月),这一表型常常早于发育落后及面容异常等被发现,甚至有报道认为14号环状染色体综合征可以仅通过早发性局灶性癫癎发作被识别[6]。14号环状染色体综合征另一个显著特点是眼部病变,已报道的有视网膜异常色素沉着斑、青光眼、斜视、近视、远视、散光、虹膜缺损等,其中黄斑和视网膜色素变性是最常见的类型,类似本例患者的先天性白内障也有报道,但不常见。14号环状染色体综合征患者还有不同程度智力障碍、面容异常、骨骼发育异常、肌张力低下、自闭症等表现。头颅影像学常为非特异性改变,可见脑萎缩、胼胝体发育不全等。脑电图亦无特征性的表现,但多有背景节律慢化,局灶性发作多起源于前颞区或中后头部[5]。
14号环状染色体综合征表型与基因型的关系尚未完全阐明,其遗传学变异主要包括14号染色体环形结构,伴或不伴14q末端微缺失。有研究发现,合并14q微缺失的患者与不形成环状结构的单纯14q末端微缺失患者相比,前者癫癎发作以及自闭症、视网膜病变的发生概率较高,后者缺失片段较小的语言发育较好[7-8];此外,单纯的14q末端微缺失患者报道较少,推测可能此类患者症状较轻、易被忽略。另有报道发现无基因组缺失的14号环状染色体综合征患者也可表现出该综合征所有症状[9],因此有学者认为14q末端微缺失也许不是产生所有表型的主要原因,而环形结构可能是引起更严重表型的原因,对这一现象目前有2种解释:(1)环形染色体有丝分裂的不稳定可能导致嵌合体产生,使得部分细胞内为14号染色体单体,引起组织差异性;(2)存在端粒位置效应,即环形结构可能引起14号染色体长臂近端的某些重要基因表达异常[10]。意大利的一项研究比较了20例14号环状染色体综合征患者及9例单纯14q微缺失患者的临床表现,推测面容异常、易感染体质及行为异常可能与14q末端微缺失相关,而癫癎及视网膜变性等表型则可能与环形结构导致的14q11q13区域内基因如FOXG1B表达异常有关[11]。本例患者缺失区域内包含至少45个RefSeq参考序列数据库收录的基因,其中5个为人类孟德尔遗传(Online Mendelian Inheritance in Man, OMIM)数据库收录的已知人类疾病相关基因,分别为:XRCC3、INF2、AKT1、BRF1及ZBTB42,但与患者症状均无明确相关性。在该片段所有的基因中,只有TDRD9、JAG2以及BTBD6可能与神经系统发育及神经精神疾病相关。值得注意的是,RD3L编码retinal degeneration protein 3-like,其同源基因RD3突变与视网膜变性相关,而单纯14q末端微缺失患者也有眼部异常[12],且单纯14q末端微缺失患者均存在智力障碍,我们推测这一区域仍可能存在与这两种表型相关的基因,需进一步研究。
回顾文献后,我们发现本例患儿临床表现与14号环状染色体综合征完全一致,但经过了漫长的十年方得到确诊,考虑本综合征报道较少,其表型有时与癫癎脑病如PCDH19突变所致女性发病的癫癎伴精神发育迟滞等疾病有重叠。因此,对于DRE患者除调整治疗方案外,应尽可能寻找病因。一些遗传因素所致的DRE,如Dravet综合征、20号环状染色体综合征的典型表型已被总结,诊断采用的检测方法各有不同,其中合并智力障碍、面容异常或眼部病变者,需首先考虑染色体数目或结构变异。近年来对于癫癎的遗传学病因认识逐渐深入,检测手段也越来越多,高通量测序、微阵列芯片技术的应用日趋广泛,而传统的细胞遗传学检测—染色体核型分析有时却被忽略,以上方法各有优势及局限性,如微阵列芯片技术、高通量测序等技术可以检测染色体基因组的缺失、重复甚至单亲二倍体,但目前在检测环形染色体或平衡易位等方面暂不能取代染色体核型分析。因此在临床实践中,一方面需要考虑不同检测方法的优势及局限,另一方面需与临床表型结合,当一种遗传学检测阴性时,要考虑其他类型遗传变异的可能,对同一患者,有时需结合不同方法进行检测,方能揭示疾病的全貌。
志谢: 感谢上海诺华贸易有限公司在本研究病例资料收集中给予的支持。| [1] | Kwan P, Arzimanoglou A, Berg AT, et al. Definition of drug resistant epilepsy:consensus proposal by the ad hoc Task Force of the ILAE Commission on therapeutic strategies[J]. Epilepsia, 2010, 51 (6): 1069–1077. |
| [2] | Picot MC, Baldy-Moulinier M, Daurès JP, et al. The prevalence of epilepsy and pharmacoresistant epilepsy in adults:a population-based study in a estern European country[J]. Epilepsia, 2008, 49 (7): 1230–1238. DOI:10.1111/epi.2008.49.issue-7 |
| [3] | Gilgenkrantz S, Cabrol C, Lausecker C, et al. The Dr syndrome. Study of a further case (46, XX, 14r)[J]. Ann Genet, 1971, 14 (1): 23–31. |
| [4] | 沈红霞, 马志敏, 阿周存. 14号环状染色体综合征一例[J]. 中华医学遗传学杂志, 2012, 29 (6): 741. |
| [5] | Giovannini S, Marangio L, Fusco C, et al. Epilepsy in ring 14 syndrome:a clinical and EEG study of 22 patients[J]. Epilepsia, 2013, 54 (12): 2204–2213. DOI:10.1111/epi.12393 |
| [6] | Ville D, DE Bellescize J, Nguyen MA, et al. Ring 14 chromosome presenting as early-onset isolated partial epilepsy[J]. Dev Med Child Neurol, 2009, 51 (11): 917–922. DOI:10.1111/j.1469-8749.2009.03292.x |
| [7] | Zollino M, Ponzi E, Gobbi G, et al. The ring 14 syndrome[J]. Eur J Med Genet, 2012, 55 (5): 374–380. DOI:10.1016/j.ejmg.2012.03.009 |
| [8] | Zampini L, Zanchi P, D'Odorico L. Developing with ring 14 syndrome:A survey in different countries[J]. Clin Linguist Phon, 2014, 28 (11): 844–856. DOI:10.3109/02699206.2014.911963 |
| [9] | Guilherme RS, de Freitas Ayres Meloni V, Sodré CP, et al. Cytogenetic and molecular evaluation and 20-year follow-up of a patient with ring chromosome 14[J]. Am J Med Genet A, 2010, 152A (11): 2865–2869. DOI:10.1002/ajmg.a.v152a:11 |
| [10] | Guilherme RS, Moysés-Oliveira M, Dantas AG, et al. Position effect modifying gene expression in a patient with ring chromosome 14[J]. J Appl Genet, 2016, 57 (2): 183–187. DOI:10.1007/s13353-015-0311-8 |
| [11] | Zollino M, Seminara L, Orteschi D, et al. The ring 14 syndrome:clinical and molecular definition[J]. Am J Med Genet A, 2009, 149A (6): 1116–1124. DOI:10.1002/ajmg.a.v149a:6 |
| [12] | Chung I, Chawla R, FitzGerald DE. Ocular manifestations of chromosome 14 terminal deletion[J]. J Pediatr Ophthalmol Strabismus, 2006, 43 (2): 104–106. |
 2017, Vol. 19
2017, Vol. 19
