2. 济宁医学院公共卫生学院, 山东 济宁 272013
自1968年Kruse首先报告服用丙戊酸钠(VPA)可造成骨病后[1],近年来许多学者进行了大量研究工作,并证实了无论是传统抗癫癎药物或新型抗癫癎药物均可引起骨骼骨质脱钙、骨质疏松、骨软化甚至发生骨折,严重影响患儿的生长发育[2-5]。但对上述损害作用的预防或治疗的具体方法,目前尚未形成统一的认识[6]。本研究观察VPA对癫癎患儿骨代谢造成的损害以及同时服用钙D合剂对这种损害作用的预防效果。
1 资料与方法 1.1 研究对象及分组所选病例均来源于济宁医学院附属济宁市第一人民医院2013年10月至2015年10月间就诊的、并以单药治疗的癫癎患儿,随机分成VPA治疗组和VPA+钙D合剂治疗组,将其中能顺利完成整个治疗及观察过程的68例患儿作为研究对象(全面性发作32例,部分性发作36例)。癫癎的诊断依据国际抗癫癎联盟2010年在癫癎病因分类中符合未知病因癫癎的诊断标准[7],并排除其他神经精神疾病以及影响骨代谢的其他疾病(如佝偻病、甲状腺及甲状旁腺疾病、骨骼疾病等)。
VPA治疗组32例,其中男20例,女12例,年龄3~14岁,平均9±4岁;VPA+钙D合剂治疗组36例,其中男22例,女14例,年龄3~14岁,平均9±4岁。两组年龄及性别分布比较差异无统计学意义。VPA治疗组服用VPA开始剂量为10 mg/(kg·d),逐渐增至20~30 mg/(kg·d),并维持。VPA+钙D合剂组VPA的服用方法和剂量同VPA治疗组,同时给予钙D合剂(维D钙咀嚼片,美国安士制药有限公司生产:含碳酸钙0.75 g,约含钙量0.3 g,维生素D3 100 IU),2片/d,与VPA间隔30 min服用。患儿的诊疗过程患儿父母知情同意,并经济宁医学院附属济宁市第一人民医院医学伦理委员会批准。
1.2 方法两组患儿分别于服药前、服药后1年时检测血钙(Ca2+)、磷(P3+)、血清碱性磷酸酶(ALP)、总维生素D以及骨密度,比较患儿治疗前后各指标的变化及两组间同期上述检测指标的不同,并根据具体情况及时复查血常规、尿常规、VPA浓度、凝血功能以及肝、肾功能等。
骨密度测定采用Sunlight Miniomni超声骨强度测定仪,分别测定腰椎(L1~4)和桡骨-尺骨近端的骨密度值(正常值≥0,单位g/cm2)。生化检测均由美国Beckman公司全自动生化分析仪测定,于患儿发作间期8am采集空腹静脉血,抗凝,留取血清。Ca2+测定采用离子选择电极法(正常值2.1~2.7 mmol/L);P3+测定采用磷钼酶直接比色法(正常值0.61~1.60 mmol/L);ALP测定采用速率法(正常值45~125 U/L);总维生素D(包括25-羟胆骨化醇、1, 25-羟胆骨化醇)的测定采用罗氏Cobasebol测定仪,运用电化学发光法测定(正常值≥30 ng/mL)。
1.3 统计学分析采用SPSS 19.0统计软件进行统计学处理与分析。计量资料采用均数±标准差(x±s)表示,组内治疗前后各指标的比较采用配对t检验,组间比较采用两独立样本t检验。P < 0.05为差异有统计学意义。
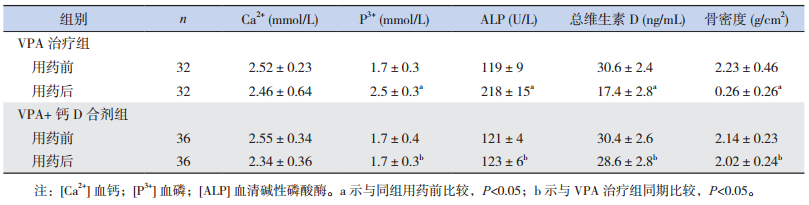
2 结果 2.1 治疗前后骨代谢各项指标的检测结果VPA治疗组血P3+、ALP用药1年后明显升高,而总维生素D、骨密度则明显降低,用药前后比较差异有统计学意义(P < 0.05);血Ca2+稍降低,与用药前比较差异无统计学意义(P > 0.05)。VPA+钙D合剂组用药1年后血P3+、ALP、Ca2+、总维生素D、骨密度与用药前比较差异均无统计学意义(P > 0.05)。两组之间的比较显示,用药前两组各指标比较差异无统计学意义(P > 0.05),但用药后两组除血Ca2+外,各指标的差异均有统计学意义(P < 0.05),见表 1。
| 表 1 两组患儿用药前后1年各项骨代谢指标的变化与比较 (x±s) |
2.2 不良反应
VPA治疗组12例、VPA+钙D合剂组13例服药后出现恶心、呕吐、腹部不适等症状;两组出现头疼、头晕等症状者分别为8例、7例;出现食量增加或发生肥胖者分别为4例、5例;发生多囊卵巢综合征者各1例,均为13岁年长女童。两组在血常规、凝血功能、肝肾功能的监测中均未发现异常。
3 讨论VPA是广谱抗癫癎药物,适合治疗各种发作类型癫癎,但长期服用可导致多系统不良反应。目前,骨代谢或骨损害的常用监测指标主要有骨密度及血Ca2+、P3+、ALP等[8]。本研究结果显示,患儿单纯服用VPA后1年血P3+、ALP水平明显升高,血Ca2+治疗前后变化不明显,而总维生素D、骨密度则显著降低,说明患儿骨代谢发生了严重紊乱,提示VPA对患儿骨代谢造成了损害,这与既往研究结果相一致[9]。其可能的机制是VPA为肝酶抑制剂,通过影响肾小管功能加速尿Ca2+、P3+的排泄,使血中Ca2+、P3+降低。但事实上,患儿服药后血Ca2+、P3+并未下降,P3+反而升高,这种现象的发生推测可能与继发性甲状旁腺机能亢进有关。柯钟灵等[10]对14篇论文507例患儿的资料进行Meta分析,发现服用VPA组患儿甲状旁腺激素明显升高,骨密度降低。VPA可能通过某种机制刺激了甲状旁腺激素的分泌,促进骨吸收、骨转换、Ca2+释放增加并能维持血Ca2+不降的同时最终导致骨密度下降[11]。Sato等[12]也对长期单用VPA治疗的患儿进行观察,发现患儿血清钙浓度增高,1, 25-(OH)2D3浓度下降,骨形成及骨吸收指标均增高,血Ca2+增高可能由于骨吸收增加引起,进而导致骨密度下降。另外,VPA及其代谢产物均具有肝毒性,尤其是对线粒体功能影响明显,从而影响肝、肾的羟化功能,使1, 25-(OH)2VitD3合成减少,同时VPA对肝药酶p450同工酶CYP2C191活性有抑制作用,此外还可抑制尿苷二磷酸葡萄糖醛酸转移酶的活性,从而进一步影响1, 25-(OH)2VitD3的吸收及合成,导致继发性骨代谢障碍及骨骼损害[13]。然而Zhang等[14]荟萃分析的结果是抗癫癎药物并未引起甲状旁腺机能亢进。
本研究显示,在服用VPA的同时加服钙D合剂患儿1年后检测骨代谢各项指标,总维生素D、骨密度值及血Ca2+、P3+、ALP治疗前后比较无明显变化;两组间用药前各指标之间无明显差异,而用药后除Ca2+外,两组间其余各指标比较差异显著。上述结果提示服用钙D合剂后可有效预防VPA对癫癎患儿骨代谢的损害作用。由于癫癎患儿处于生长发育期,且癫癎发作时极易发生摔倒等意外伤害,如果患儿的骨代谢紊乱不能及时得到纠正,发生骨折或意外伤害的机会将明显增加。应注意的是,由于钙剂可抑制抗癫癎药物的吸收,在同时服用两种药物时应错开一定时间[15]。依据美国1997年推荐的标准,儿童每天需要钙1.2 g,维生素D 400 IU。本研究VPA+钙D合剂治疗组所补充的钙及维生素D含量约为儿童需要量的一半,另一半完全可以由正常膳食或日光浴自身合成来提供[16]。钙是维持人体神经、肌肉、骨骼系统正常功能所必需的物质,维生素D参与钙和磷的代谢,促进其吸收并对骨质形成有重要作用[17]。本组病例服用钙D合剂1年后检测骨代谢的各项指标,发现无论是维生素D含量还是骨密度均无明显下降或改变,提示采用钙D合剂预防治疗是有效的。国内也有学者进行这方面的基础研究工作,证实维生素D联合钙剂的使用比单纯钙剂在增加骨密度、骨皮质厚度、改善骨结构和材料力学性能及抗骨吸收能力等方面的效果更明显[18]。本研究中患儿服用钙D合剂后并未出现嗳气、便秘甚至高血钙、碱中毒及肾功能不全等不良反应,说明钙D合剂对服用VPA治疗的癫癎患儿是安全、有效的。对服用VPA已经发生严重骨代谢异常的患儿及时给予钙D合剂进行挽救性治疗的效果如何将是本课题组下一步的研究工作。总之,在癫癎治疗过程中,抗癫癎药物可对患儿的骨代谢产生损害作用,早期加用钙D合剂可有效预防这种损害作用。
志谢: 感谢上海诺华贸易有限公司在本研究病例资料收集中给予的支持。| [1] | Sheth RD, Wesolowski CA, Jacob JC, et al. Effect of carbamazepine and valproate on bone mineral density[J]. J Pediatr, 1995, 127 (2): 256–262. DOI:10.1016/S0022-3476(95)70304-7 |
| [2] | 姜玉武. 发作间期癎性放电对癫癎患儿认知功能的影响[J]. 中华实用儿科临床杂志, 2013, 28 (24): 1841–1843. DOI:10.3760/cma.j.issn.2095-428X.2013.24.001 |
| [3] | 赵昕, 何周康, 张晶, 等. SCNIA基因多态性与卡马西平治疗儿童癫癎疗效的关系[J]. 儿科药学杂志, 2011, 17 (1): 26–28. |
| [4] | 张芳, 李桂新. 抗癫癎药对癫癎患儿骨代谢及生活质量的影响[J]. 陕西医学杂志, 2016, 45 (1): 28–30. |
| [5] | 许莉, 张金环, 许前. 拉莫三嗪、卡马西平及丙戊酸钠对癫癎患儿的骨质影响[J]. 中国实用医药, 2011, 6 (11): 166–167. DOI:10.3969/j.issn.1673-7555.2011.11.126 |
| [6] | 周厚福, 李成荣, 廖建湘, 等. 生酮饮食治疗对难治性癫癎患儿滤泡辅助性T淋巴细胞的影响[J]. 中华实用儿科临床杂志, 2015, 30 (2): 142–146. |
| [7] | Berg AT, Berkovic SF, Brodie MJ, et al. Revised terminology and concepts for organization of seizures and epilepsies:report of the ILAE Commission on Classification and Terminology, 2005-2009[J]. Epilepsia, 2010, 51 (4): 676–685. DOI:10.1111/epi.2010.51.issue-4 |
| [8] | 张双, 庞保东, 曹丽华, 等. 托吡酯对3~12岁癫癎儿童骨代谢影响的研究[J]. 中国妇幼保健, 2008, 23 (35): 5007–5008. DOI:10.3969/j.issn.1001-4411.2008.35.028 |
| [9] | 王凯旋, 韦翊, 徐敏慧, 等. 托吡酯和丙戊酸钠对癫癎患儿骨代谢的影响[J]. 浙江临床医学, 2009, 11 (6): 626–627. |
| [10] | 柯钟灵, 林希, 孙立军, 等. 丙戊酸钠对癫癎患儿骨代谢影响的Meta分析[J]. 中国循证儿科杂志, 2013, 8 (5): 356–362. |
| [11] | 王秋菊. 丙戊酸和托吡酯单药治疗对儿童骨代谢的影响[D]. 郑州: 郑州大学, 2010. |
| [12] | Sato Y, Kondo I, Ishida S, et al. Decreased bone mass and increased bone turnover with valproate therapy in adults with epilepsy[J]. Neurology, 2001, 57 (3): 445–449. DOI:10.1212/WNL.57.3.445 |
| [13] | 杨斌, 陈向涛, 汪惠丽, 等. 丙戊酸钠对癫癎患儿骨代谢的影响[J]. 儿科药学杂志, 2005, 11 (6): 5–7. |
| [14] | Zhang Y, Zheng YX, Zhu JM, et al. Effects of antiepileptic drugs on bone mineral density and bone metabolism in children:a meta-analysis[J]. J Zhejiang Univ Sci B, 2015, 16 (7): 611–621. DOI:10.1631/jzus.B1500021 |
| [15] | 黄铃沂, 任榕娜. 抗癫癎药物对儿童骨密度和骨骼发育的影响[J]. 中国临床康复, 2005, 9 (11): 178–180. DOI:10.3321/j.issn:1673-8225.2005.11.105 |
| [16] | Kafali G, Erselcan T, Tanzer F. Effect of antiepileptic drugs on bone mineral density in children between ages 6 and 12 years[J]. Clin Pediatr (Phila), 1999, 38 (2): 93–98. DOI:10.1177/000992289903800205 |
| [17] | 党瑞丽, 郭玉金, 蔡骅琳, 等. 维生素D对神经发育的影响及其与精神分裂症的关系[J]. 中华脑科疾病与康复杂志(电子版), 2015, 5 (6): 439–442. |
| [18] | 薛延, 高璐, 王芊, 等. 钙加维生素D预防骨质疏松的实验研究[J]. 中国临床康复, 2002, 6 (23): 3544–3545. DOI:10.3321/j.issn:1673-8225.2002.23.057 |
 2017, Vol. 19
2017, Vol. 19