戊二酸尿症Ⅱ型(glutaric aciduria typeⅡ, GAⅡ)又称多酰基辅酶A脱氢酶(multiple acyl-CoA dehydrogenases, MAD)缺乏症,是脂质沉积性肌病中最常见的类型,在我国约90%的脂质沉积性肌病的病因为GAⅡ型[1-2]。戊二酸尿症Ⅱ型的病因为电子转运黄素蛋白(electron transfer flavoprotein, ETF)或电子转运黄素蛋白脱氢酶(electron transfer flavoprotein dehydrogenase, ETFDH)缺陷[3]。戊二酸尿症Ⅱ型分为新生儿型、迟发型或晚发型。新生儿型常于新生儿期死亡,晚发型患者于学龄期至成年起病,以脂肪沉积性肌病为主要临床表现。目前国内对该类疾病的报道较少。本文结合两例晚发型戊二酸尿症Ⅱ型患者的临床资料,并复习相关文献,探讨该病的临床表现及遗传学特点,以提高临床医师的认识。
1 资料与方法 1.1 一般资料患者1,女,12岁,因下肢无力两年余就诊。患者两年前出现下肢无力、走路及上楼困难,并呈进行性加重,吞咽及呼吸未见明显异常。患者系第1胎、足月顺产出生。父母非近亲结婚,弟弟无类似症状。入院体格检查:发育无异常,神志清楚,心肺无阳性体征;肝脾未触及。躯干肌肉萎缩,上肢肌力Ⅳ级,下肢肌力Ⅲ级,四肢肌张力低下;四肢腱反射减弱,病理反射未引出。实验室检查:谷草转氨酶(AST)246 IU/L(参考值:8~40 IU/L),谷丙转氨酶(ALT)124 IU/L(参考值:0~40 IU/L),肌酸激酶(CK)542 IU/L(参考值:24~195 IU/L),肌酸激酶同工酶(CK-MB)105 IU/L(参考值:0~24 IU/L);乳酸脱氢酶(LDH)615 IU/L(参考值:109~245 IU/L)。血脂酰肉碱谱分析:丁酰基肉碱0.68 μmol/L(参考值:0.08~0.6 μmol/L),异戊酰基肉碱0.46 μmol/L(参考值:0~0.4 μmol/L),辛酰基肉碱0.28 μmol/L(参考值:0.03~0.2 μmol/L),羟棕榈酰肉碱0.21 μmol/L(参考值:0.01~0.15 μmol/L)。尿有机酸分析提示异戊酰甘氨酸、己二酸以及乙基丙二酸明显增高。血氨基酸分析提示甘氨酸、谷氨酸、苏氨酸等增高。心电图、腹部B超未见异常。
患者2,男,6岁,因下肢无力半年就诊。患儿半年前出现易疲劳、上楼困难、肌肉酸痛,运动后加重,吞咽及呼吸无异常。患者系第3胎,出生时无窒息。患者父母非近亲结婚,哥哥及姐姐均无类似症状。入院体格检查:发育正常,神志清楚,皮肤、巩膜无黄染;心、肺、腹部查体未见异常。四肢轻度肌萎缩,肌张力稍低,肌力Ⅳ级,膝腱反射消失,巴氏征阴性。实验室检查:谷草转氨酶(AST)281 IU/L(参考值:8~40 IU/L);ALT 96 IU/L(参考值:0~40 IU/L),肌酸激酶(CK)1 240 IU/L(参考值:24~195 IU/L);肌酸激酶同工酶(CK-MB)94 IU/L(参考值:0~24 IU/L),乳酸脱氢酶(LDH)584 IU/L(参考值:109~ 245 IU/L)。血脂酰肉碱谱分析:丁酰基肉碱0.64 μmol/L(参考值:0.08~0.6 μmol/L),辛二酰肉碱0.14 μmol/L(参考值:0.01~0.1 μmol/L),羟棕榈酰肉碱0.18 μmol/L(参考值:0.01~0.15 μmol/L),十八碳烯酰肉碱3.3 μmol/L(参考值:0.4~ 3.0 μmol/L)。尿有机酸检测:2-羟基戊二酸、3-羟基戊二酸及乙基丙二酸水平均明显上升。下肢肌电图提示肌源性病损。心电图、腹部B超未见异常。头部MRI无明显异常。
1.2 致病基因检测采集先证者及家属的外周静脉血各2 mL,提取基因组DNA。高通量测序由康圣达公司完成,并利用Sanger测序进行验证。先证者家属的突变位点验证由课题组完成。ETFDH基因的引物由上海生工合成。PCR反应体系:基因组DNA 50 ng,dNTP 200 μmol/L,MgCl2 1.5 mmol/L,上下游引物各0.5 μmol/L,Taq DNA聚合酶1 U(东盛生物公司),加水至终体积25 μL。94℃预变性5 min,94℃变性30 s,55~60℃退火30 s,72℃延伸30~60 s,35个循环;72℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测合格后进行测序分析。本研究得到医院医学伦理学委员会批准及患者家属知情同意。
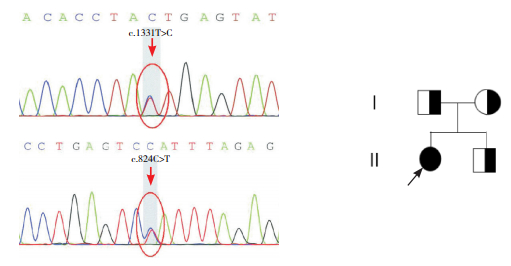
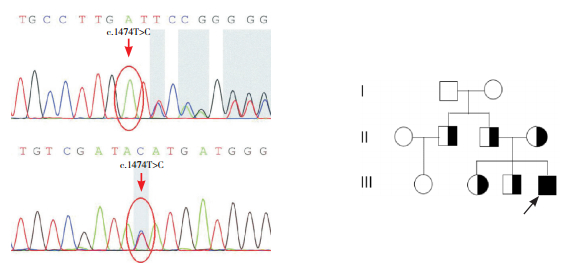
2 结果 2.1 患者致病基因突变分析患者1存在c.1331T > C(p.I444T)及c.824C > T(p.P275L)复杂杂合突变(图 1),分别遗传自母亲和父亲。其弟弟携带c.1331T > C(p.I444T)杂合突变,临床表型正常。患者2存在c.177insT(p.D59fs)及c.1474T > C(p.Y492H)复合杂合突变(图 2),分别来自父母;其哥哥携带c.1474T > C杂合突变,姐姐携带c.177insT杂合突变,伯伯携带c.177insT突变,但均无临床症状。
|
图 1 患者1的ETFDH基因突变分析及其家系图 患者ETFDH基因存在c.1331T > C杂合突变和c.824C > T杂合突变(突变位点如箭头所示)。●示女性患者;◑示女性携带者;◨表示男性携带者;↗示先证者。 |
|
图 2 患者2的ETFDH基因突变分析及其家系图 患者ETFDH基因存在c.177insT杂合突变和c.1474T > C杂合突变(突变位点如箭头所示)。■示男性患者;◑示女性携带者;◨示男性携带者;○示正常女性;□示正常男性;↗示先证者。 |
2.2 突变位点的生物信息学分析
经文献及数据库检索,发现c.1474T > C为已知的致病性突变;c.1331T > C,c.824C > T以及c.177insT未见报道。对c.1331T > C突变利用生物信息学软件Polyphen2进行分析,预测值为0.993(越接近1对蛋白功能的影响越大);SIFT预测值为0(约接近0,对蛋白损害越大)。c.824C > T突变生物信息学软件Polyphen2分析的预测值为0.950,SIFT分析的预测值为0.03。c.177insT插入突变可导致氨基酸移码突变,导致该位点之后的氨基酸改变,从而影响蛋白功能。因此这3个突变均可能影响蛋白的功能,为可能的致病性突变。
2.3 治疗患者1确诊后立即予以维生素B2(40 mg/次,每日3次)治疗,并予以低脂肪、高碳水化合物饮食,3周后症状明显减轻。复查尿有机酸分析,异戊酰甘氨酸、己二酸以及乙基丙二酸水平明显降低;血游离肉碱及酯酰肉碱未见异常。患者2确诊后也予以维生素B2治疗(40 mg/次,每日3次),1个月后症状明显改善,尿有机酸以及血酯酰肉碱谱正常。
3 讨论戊二酸尿症Ⅱ型是多种脂肪酸氧化代谢紊乱导致的疾病,由于多种酯酰辅酶A脱氢酶缺陷导致线粒体多种脂肪酸氧化受阻,能量供应障碍,中间代谢产物积累,引起肌病、肝病、脑病或多脏器损害。戊二酸尿症Ⅱ型由Przyrembel等[4]于1976年首先报道,是一种罕见病,呈常染色体隐性遗传,国内报道尚不足100例。根据发病年龄,戊二酸尿症Ⅱ型分为新生儿型和迟发型或晚发型。其中新生儿型病情危重,出生数日出现呼吸困难、低血糖、代谢性酸中毒等症状,多于新生儿期死亡。迟发型患者的临床表现个体差异很大,发病年龄可从出生数周至成人期,多数以下肢无力、走路及爬楼困难为主要表现[5]。
研究发现,ETF以及ETFDH基因突变是导致戊二酸尿症Ⅱ型的重要原因[6]。ETFDH基因位于4号染色体q32区域,全长36 kb,编码13个外显子;ETF基因位于19q13区域,由17个外显子组成。ETF以及ETFDH是线粒体电子传递链的重要物质,其缺陷可导致脂肪酸、支链氨基酸、异戊酸等多种酰基辅酶A脱氢缺陷,线粒体能量代谢的障碍,引起一系列生化紊乱[7]。不同位点的突变对酶活性的影响不同,临床表现也不同。本研究两个病例均属于晚发型MADD,实验室检测发现肌酶升高,尿有机酸或血酯酰肉碱谱异常,ETFDH基因均存在杂合突变。而且文献检索发现c.1474T > C为已知的致病性突变[8];c.1331T > C、c.824C > T以及c.177insT为新发突变,生物信息学软件Polyphen2以及SIFT预测分析这3个突变为可能的致病性突变。
研究发现,多数戊二酸尿症Ⅱ型患者发病后肝功能异常:转氨酶升高,并合并不同程度的脂肪肝[9]。本研究两例患者均有转氨酶升高,尚未见脂肪肝。典型患者肌肉组织病理分析可见脂质沉积,因条件限制,本文中两例患者未作肌肉病理检查。
部分戊二酸尿症Ⅱ型患者早期利用维生素B2治疗效果较好,可显著改善生活质量,这部分患者被称为维生素B2反应型[10]。其机理可能为外源性黄素嘌呤二核苷酸可作为一种分子伴侣参与线粒体多种酯酰辅酶A脱氢酶以及ETF蛋白表达的调控过程,从而增强维生素B2至泛醌的电子传递,进而使细胞调控通路恢复正常[11]。本文的两例患者高剂量维生素B2治疗后取得较为理想的疗效。
综上所述,晚发性戊二酸尿症Ⅱ型以肌无力、脂肪酸代谢紊乱为主要表现,但个体差异较大,血液及尿液代谢分析以及基因检测有助于本病的早期诊断。
| [1] | Zhu M, Zhu X, Qi X, et al. Riboflavin-responsive multiple Acyl-CoA dehydrogenation deficiency in 13 cases, and a literature review in mainland Chinese patients[J]. J Hum Genet, 2014, 59 (5): 256–261. DOI:10.1038/jhg.2014.10 |
| [2] | 中华医学会神经病学分会. 中国脂质沉积性肌病诊治专家共识[J]. 中华神经科杂志, 2015, 48 (11): 941–945. DOI:10.3760/cma.j.issn.1006-7876.2015.11.003 |
| [3] | Henriques BJ, Rodrigues JV, Olsen RK, et al. Role of flavinylation in a mild variant of multiple acyl-CoA dehydrogenation deficiency:a molecular rationale for the effects of riboflavin supplementation[J]. J Biol Chem, 2009, 284 (7): 4222–4229. DOI:10.1074/jbc.M805719200 |
| [4] | Przyrembel H, Wendel U, Becker K, et al. Glutaric aciduria type Ⅱ:report on a previously undescribed metabolic disorder[J]. Clin Chim Acta, 1976, 66 (2): 227–239. DOI:10.1016/0009-8981(76)90060-7 |
| [5] | 杨艳玲, 木春正彦, 袁云, 等. 戊二酸尿症Ⅱ型所致脂肪沉积型肌肉病的诊断与治疗分析[J]. 中华神经科杂志, 2004, 37 (5): 438–441. |
| [6] | Yamada K, Kobayashi H, Bo R, et al. Clinical, biochemical and molecular investigation of adult-onset glutaric acidemia type Ⅱ:Characteristics in comparison with pediatric cases[J]. Brain Dev, 2016, 38 (3): 293–301. DOI:10.1016/j.braindev.2015.08.011 |
| [7] | Fu HX, Liu XY, Wang ZQ, et al. Significant clinical heterogeneity with similar ETFDH genotype in three Chinese patients with late-onset multiple acyl-CoA dehydrogenase deficiency[J]. Neurol Sci, 2016, 37 (7): 1099–1105. DOI:10.1007/s10072-016-2549-2 |
| [8] | Xi J, Wen B, Lin J, et al. Clinical features and ETFDH mutation spectrum in a cohort of 90 Chinese patients with late-onset multiple acyl-CoA dehydrogenase deficiency[J]. J Inherit Metab Dis, 2014, 37 (3): 399–404. DOI:10.1007/s10545-013-9671-6 |
| [9] | Lund AM, Skovby F, Vestergaard H, et al. Clinical and biochemical monitoring of patients with fatty acid oxidation disorders[J]. J Inherit Metab Dis, 2010, 33 (5): 495–500. DOI:10.1007/s10545-009-9000-2 |
| [10] | Wen B, Dai T, Li W, et al. Riboflavin-responsive lipid-storage myopathy caused by ETFDH gene mutations[J]. J Neurol Neurosurg Psychiatry, 2010, 81 (2): 231–236. DOI:10.1136/jnnp.2009.176404 |
| [11] | Olsen RK, Andresen BS, Christensen E, et al. Clear relationship between ETF/ETFDH genotype and phenotype in patients with multiple acyl-CoA dehydrogenation deficiency[J]. Hum Mutat, 2003, 22 (1): 12–23. DOI:10.1002/(ISSN)1098-1004 |
 2017, Vol. 19
2017, Vol. 19


