社区获得性肺炎(CAP)是儿童常见病、多发病,严重威胁儿童健康。尽管社会经济的提高、肺炎疫苗的接种、治疗策略的改善明显降低了儿童肺炎的发生率,但其依旧是儿童死亡的最主要病因。据统计,每年全球约100万儿童死于肺炎,占5岁以下儿童总死亡人数的15%左右[1]。近年来发现,肺炎病原谱可随季节、地域、患儿年龄、病情严重程度、入院标准、实验室诊断标准的变化而发生变迁[2],使得正确判断病原的难度增加。同时,也有相当比例的患儿用现有的方法检测不到病原[3]。另外,由于抗生素的滥用,细菌耐药情况日趋严重[4]。以上因素都是儿童重症CAP治疗失败的原因。因此,尽早明确病原,合理选择抗生素是治疗儿童重症CAP的关键。为了解重庆地区重症CAP患儿的病原分布特点及提高抗生素疗效,本研究监测了2016年我院住院治疗的522例重症CAP患儿病原体及细菌耐药情况。
1 资料与方法 1.1 研究对象选取2016年1~12月于我院呼吸病房及重症监护室住院治疗的522例重症CAP患儿为研究对象,其中男327例,女195例;最小年龄为29 d,最大年龄为13岁9个月,中位年龄为0.33岁,28 d~(婴儿组)402例(77.0%),1岁~(幼儿组)73例(14.0%),3岁~(学龄前期组)35例(6.7%),≥6岁(学龄期组)12例(2.3%);春季(3~5月份)发病120例(23.0%),夏季(6~8月份)发病93例(17.8%),秋季(9~11月份)发病105例(20.1%),冬季(12~2月份)发病204例(39.1%)。
纳入患儿均符合中华医学会儿科学分会呼吸学组2013年制定的重症CAP诊断标准[5]:CAP患儿出现胸壁吸气性凹陷或鼻翼扇动或呻吟之一表现者,为重症肺炎;如果出现中心性紫绀、严重呼吸窘迫、拒食或脱水症、意识障碍(嗜睡、昏迷、惊厥)之一表现者为极重症肺炎。
排除标准:(1)新生儿;(2)肺结核、非感染性肺炎患儿;(3)院内获得性肺炎患儿;(4)免疫功能缺陷者及长期使用免疫抑制剂患儿;(5)资料不全者。
1.2 痰液采集入选患儿入院24 h内予生理盐水清洗口腔后用一次性吸痰管负压吸取气道深部痰液(经鼻插入约8~12 cm),机械通气者用一次性吸痰管经气管导管吸取痰液置于无菌痰液收集器中。合格痰液标本:低倍镜下上皮细胞≤10个,白细胞≥25个。
1.3 病原检测将痰液标本常规处理后接种于培养皿中,35℃、5%CO2条件下培养24 h,采用phoenix-100全自动细菌鉴定系统进行菌种鉴定及药敏试验,遵循美国实验室质量标准(2013CLSI)判读结果。仪器由美国BD公司生产。
采用直接免疫荧光法检测呼吸道7种病毒:呼吸道合胞病毒(RSV)、腺病毒(ADV)、流感病毒A(IVA)、流感病毒B(IVB)、副流感病毒1(PIV1)、副流感病毒2(PIV2)、副流感病毒3(PIV3),抗原阳性提示病毒感染。
采用荧光定量PCR技术检测痰液标本肺炎支原体(MP)-PCR,颗粒凝集法检测MP血清学抗体,MP-PCR≥5×102基因拷贝/mL和/或MP-IgM≥1:160提示感染。采用荧光定量PCR技术检测痰液标本沙眼衣原体(CT)-PCR,CT-PCR≥5×102基因拷贝/mL提示感染。
1.4 统计学分析采用SPSS 19.0统计软件包对数据进行统计学分析。计数资料采用百分率(%)表示,多组间比较采用卡方检验,P < 0.05为差异有统计学意义。
2 结果 2.1 病原体分布及构成比522例患儿中419例被检出病原体阳性,阳性率为80.3%。其中单纯细菌感染143例(34.1%),单纯病毒感染75例(17.9%),单纯MP感染6例(1.4%),单纯CT感染5例(1.2%),混合感染190例(45.3%),以细菌病毒混合感染多见(156例)。
419例病原体检出阳性患儿中,共检出病原体681株,包括细菌371株(54.5%),其中革兰阳性菌112株(30.2%),以肺炎链球菌(61株)和金黄色葡萄球菌(47株,其中11株为耐甲氧西林金黄色葡萄球菌)为主;革兰阴性菌259株(69.8%),以流感嗜血杆菌(106株)、大肠埃希菌(34株,其中18株为超广谱β内酰胺酶阳性)和肺炎克雷伯菌(33株,其中17株为超广谱β内酰胺酶阳性)为主。病毒259株(38.0%),以RSV(187株)为主。真菌12株(1.8%),以白色假丝酵母菌(8株)为主。MP 15株(2.2%)。CT 24株(3.5%)。
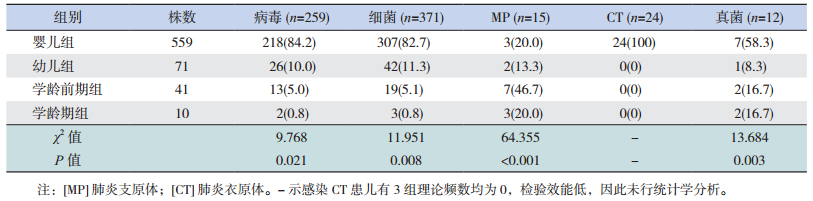
2.2 不同年龄间病原体分布情况细菌、病毒、MP、真菌感染分别在不同年龄组间分布比率比较差异有统计学意义(P < 0.05)。细菌、病毒、真菌感染均主要集中发生在婴儿组(28 d~);MP感染以学龄前期组(3岁~)为主;24株CT感染均发生在婴儿组(28 d~)。见表 1。
| 表 1 不同年龄组病原体感染情况 [株(%)] |
2.3 不同季节间病原体分布情况
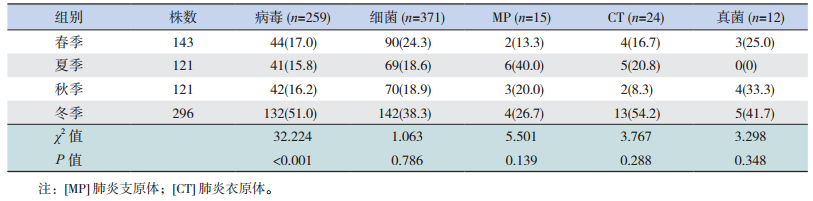
病毒感染发生率在不同季节间比较差异有统计学意义(P < 0.05),且在冬季高发;细菌、MP、真菌、CT感染发生率在不同季节间比较差异均无统计学意义(P > 0.05)。见表 2。
| 表 2 不同季节病原体感染情况 [株(%)] |
2.4 主要细菌对常用抗菌药物的耐药情况
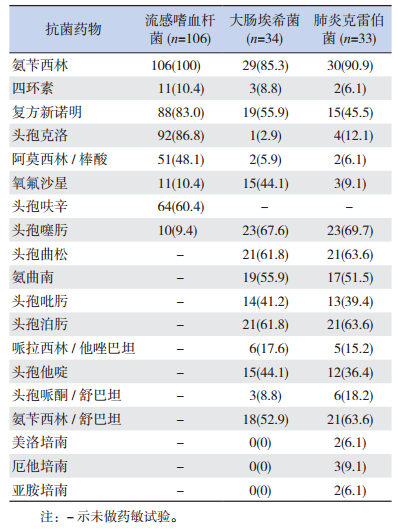
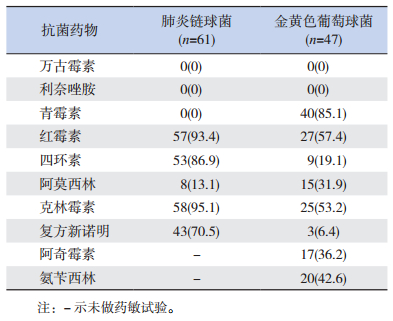
主要革兰阳性菌中,肺炎链球菌对红霉素、四环素、克林霉素耐药率高达85%以上;金黄色葡萄球菌对青霉素、红霉素、克林霉素的耐药率达50%以上;但两者对万古霉素、利奈唑胺均敏感。主要革兰阴性菌中,流感嗜血杆菌对氨苄西林100%耐药,对复方新诺明、头孢克洛、头孢呋辛的耐药率达60%以上,但对头孢噻肟敏感率达90%以上;大肠埃希菌、肺炎克雷伯菌对氨苄西林、头孢噻肟、头孢曲松、头孢泊污的耐药率达60%以上,但对碳青霉烯类抗生素(美罗培南、厄他培南、亚胺培南)敏感率达90%以上,对β内酰胺酶抑制剂复方制剂(除氨苄西林/舒巴坦)敏感率均在80%以上。见表 3~4。
| 表 3 主要革兰阴性菌对常用抗菌药物的耐药情况 [株(%)] |
| 表 4 主要革兰阳性菌对常用抗菌药物的耐药情况 [株(%)] |
3 讨论
本研究中重症CAP患儿的病原检出率为80.3%,略低于蒲开彬等[6]报道的重症CAP患儿81.5%的病原检出率,高于Kurz等[2]及陈金妮[7]报道的CAP患儿68%及58.74%的病原检出率,提示重症CAP患儿病原检出率高于普通CAP患儿。本研究发现重症CAP患儿混合感染比例高达45.3%,明显高于其他研究[8],考虑与本研究患儿病情重、年龄小有关。而大量的混合感染明显增加了重症CAP患儿的病原判断及临床药物选择的难度,使治疗棘手,预后欠佳。
本研究中病原感染以细菌为主,检出的细菌中主要为革兰阴性菌,与既往报道一致[9-10]。检出前5位细菌为流感嗜血杆菌、肺炎链球菌、金黄色葡萄球菌、大肠埃希菌和肺炎克雷伯菌,与李长春等[11]研究相仿,但与刘霞等[12]报道的重症肺炎患儿细菌检出前5位是肺炎克雷伯菌、大肠埃希菌、阴沟肠杆菌、铜绿假单胞菌、肺炎链球菌不同,也不同于De Schutter等[13]报道的肺炎以流感嗜血杆菌、卡他莫拉菌、肺炎链球菌为主要细菌病原,提示细菌谱可随时间、地域、气候、病情严重程度等变化发生变迁。本研究中检出首位的病毒是RSV,占72.2%,稍低于罗蓉等[14]报道的78.9%。RSV感染以小婴儿为主且高发于冬季,提示RSV为冬季小婴儿重症CAP的主要病原之一,考虑小婴儿对病毒的免疫低或缺乏所致[15]。近年来,国内外研究报道MP已逐渐成为儿童肺炎的重要病原,检出率波动在20%~40%[16-17]。但是本研究MP检出率仅为2.2%,考虑与本研究患儿超过80%为小于3岁的婴幼儿有关。MP感染主要发生于学龄前期儿童,但仍有1/3的MP感染患儿为3岁以下的婴幼儿,最小感染年龄为2个多月,提示MP感染有低龄化趋势,与徐莉燕[18]的研究结果一致。本研究中CT感染患儿均为小于1岁的小婴儿,提示CT为小婴儿重症CAP常见病原之一。本研究中真菌感染仅有1.8%,低于蒲开彬等[6]报道的7.8%,提示真菌感染发生率亦可随时间而发生变迁。
本研究革兰阴性菌中流感嗜血杆菌对氨苄西林100%耐药,对复方新诺明、头孢克洛、头孢呋辛的耐药率高达60%以上,但对头孢噻肟、四环素、氧氟沙星的敏感率达85%以上。而杨晓华等[19]2014年报道流感嗜血杆菌对头孢克洛等头孢菌素及酶抑制剂复方制剂的敏感率均大于80%,头孢菌素及酶抑制剂复方制剂仍可作为治疗流感嗜血杆菌的首选药物。可见重庆地区流感嗜血杆菌耐药情况十分严峻。而我院今后可开展流感嗜血杆菌对酶抑制剂复方制剂的药物敏感试验,从而了解重庆地区流感嗜血杆菌对酶抑制剂复方制剂的耐药情况,指导抗生素的选择。
本研究中大肠埃希菌、肺炎克雷伯菌中超广谱β内酰胺酶阳性率分别为52.9%、51.5%,高于沈继录等[20]、胡志军等[21]报道的42.3%、36.9%的超广谱β内酰胺酶阳性率。而有研究报道大肠埃希菌、肺炎克雷伯菌主要耐药机制为产超广谱β内酰胺酶[22]。本研究发现大肠埃希菌、肺炎克雷伯菌对头孢噻肟、头孢曲松、头孢泊肟的耐药率达60%以上,提示革兰阴性菌对二、三代头孢有较高的耐药性。由此可见,重症肺炎产超广谱β内酰胺酶大肠埃希菌或肺炎克雷伯菌检出率较高且具有多药耐药性。而大肠埃希菌、肺炎克雷伯菌对β内酰胺酶抑制剂复方制剂除氨苄西林/舒巴坦外,包括哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、阿莫西林/棒酸的敏感率均在80%以上,提示β内酰胺酶抑制剂复方制剂仍可作为治疗革兰阴性菌的经验性用药之一。此外,对美洛培南、亚胺培南等碳青霉烯类抗生素敏感率达90%以上。因此,碳青霉烯类抗生素仍然是治疗革兰阴性菌最有效的抗生素。
革兰阳性菌中肺炎链球菌对红霉素、四环素、克林霉素耐药率高达85%以上,对复方新诺明耐药率为70.5%,与景春梅等[23]研究近5年重庆地区肺炎链球菌的耐药情况大致相仿,提示近年来肺炎链球菌耐药情况变化不大。金黄色葡萄球菌对青霉素耐药率达85.1%,对红霉素、克林霉素、氨苄西林的耐药率达42.6%~57.4%,但肺炎链球菌、金黄色葡萄球菌对万古霉素、利奈唑胺敏感性均为100%,提示万古霉素、利奈唑胺为治疗革兰阳性菌的最有效药物,与国内研究一致[23-24]。
综上所述,重庆地区重症CAP患儿的病原检出首位是细菌,以流感嗜血杆菌为主,病毒以RSV为主,MP感染有低龄化趋势。若重症CAP患儿治疗效果欠佳,需高度警惕细菌和病毒等混合感染。目前细菌耐药情况较严峻,须引起高度重视,应在疾病初期正确评估病情轻重程度及判断感染病原,合理选择抗生素,后期针对病情变化、细菌培养及药敏试验结果调整抗生素,不可盲目升级抗生素而增加细菌耐药性的发生。
| [1] | Zar HJ, Barnett W, Myer L, et al. Chilhood pneumonia-the Drakenstein Child Health Study[J]. S Afr Med J, 2016, 106 (7): 642–643. DOI:10.7196/SAMJ.2016.v106i7.11108 |
| [2] | Kurz H, Göpfrich H, Huber K, et al. Spectrum of pathogens of in-patient children and youths with community acquired pneumonia:a 3 year survey of a community hospital in Vienna, Austria[J]. Wien Klin Wochenschr, 2013, 125 (21-22): 674–679. DOI:10.1007/s00508-013-0426-z |
| [3] | Chkhaidze I, Manjavidze N, Nemsadze K. Serodiagnosis of acute respiratory infections in children in Georgia[J]. Indian J Pediatr, 2006, 73 (7): 569–572. DOI:10.1007/BF02759919 |
| [4] | Feldman C, Anderson R. Antibiotic resistance of pathogens causing community-acquired pneumonia[J]. Semin Respir Crit Care Med, 2012, 33 (3): 232–243. DOI:10.1055/s-0032-1315635 |
| [5] | 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童社区获得性肺炎管理指南(2013修订)(下)[J]. 中华儿科杂志, 2013, 51 (11): 856–862. DOI:10.3760/cma.j.issn.0578-1310.2013.11.012 |
| [6] | 蒲开彬, 黄英. 重庆地区儿童重症肺炎病原学回顾性分析[J]. 临床儿科杂志, 2016, 34 (4): 264–267. |
| [7] | 陈金妮. 600例儿童社区获得性肺炎病原学特点分析[J]. 中国病原生物学杂志, 2016, 11 (12): 1126–1130. |
| [8] | 彭懿, 舒畅, 符州, 等. 儿童社区获得性肺炎1613例病原学特点分析[J]. 中国当代儿科杂志, 2015, 17 (11): 1193–1199. DOI:10.7499/j.issn.1008-8830.2015.11.009 |
| [9] | 刘翔腾, 王桂兰, 罗序锋, 等. 儿童社区获得性肺炎病原微生物分布特点分析[J]. 中国当代儿科杂志, 2013, 15 (1): 42–45. DOI:10.7499/j.issn.1008-8830.2013.01.011 |
| [10] | 罗征秀, 刘恩梅, 符州, 等. 重庆地区儿童社区获得性肺炎病原体及细菌药敏分析[J]. 儿科药学杂志, 2005, 11 (1): 4–6. |
| [11] | 李长春, 朱玉林, 王亚亭, 等. 509例儿童社区获得性肺炎病原体及临床特征分析[J]. 安徽医药, 2016, 20 (4): 699–702. |
| [12] | 刘霞, 马静, 张忠晓, 等. 儿童重症肺炎2044例肺泡灌洗液细菌病原学分析[J]. 中国实用儿科杂志, 2014, 29 (6): 438–441. DOI:10.7504/ek2014060610 |
| [13] | De Schutter I, De Wachter E, Crokaert F, et al. Microbiology of bronchoalveolar lavage fluid in children with acute nonresponding or recurrent community-acquired pneumonia: identification of nontypeable Haemophilus influenzae as a major pathogen[J]. Clin Infect Dis, 2011, 52 (12): 1437–1444. DOI:10.1093/cid/cir235 |
| [14] | 罗蓉, 黄英, 罗晓菊, 等. 重庆儿童急性呼吸道感染1731例病毒病原学分析[J]. 重庆医科大学学报, 2007, 32 (12): 1279–1346. DOI:10.3969/j.issn.0253-3626.2007.12.013 |
| [15] | Peng D, Zhao D, Liu J, et al. Multipathogen infections in hospitalized children with acute respiratory infections[J]. Virol J, 2009, 6 : 155. DOI:10.1186/1743-422X-6-155 |
| [16] | 刘俊英. 儿童社区获得性肺炎病原体及细菌药敏结果分析[J]. 中国病原生物学杂志, 2012, 7 (11): 855–857. |
| [17] | Yu Y, Fei A. Atypical pathogen infection in community-acquired pneumonia[J]. Biosci Trends, 2016, 10 (1): 7–13. DOI:10.5582/bst.2016.01021 |
| [18] | 徐莉燕. 儿童社区获得性肺炎578例回顾性分析[D]. 郑州: 郑州大学, 2014. |
| [19] | 杨晓华, 谭南, 林爱心, 等. 儿童呼吸道流感嗜血杆菌的耐药性分析[J]. 中国感染与化疗杂志, 2014, 14 (5): 436–439. |
| [20] | 沈继录, 潘亚萍, 徐元宏, 等. 2005-2014年CHINET大肠埃希菌耐药性监测[J]. 中国感染与化疗杂志, 2016, 16 (2): 129–140. |
| [21] | 胡志军, 潘晓龙, 周东升, 等. 肺炎克雷伯菌感染的临床分布及耐药性监测[J]. 中华医院感染学杂志, 2014, 24 (12): 2865–2867. |
| [22] | 刘立涛, 万莉红, 邵振俊, 等. Ⅰ类整合子介导大肠埃希菌与肺炎克雷伯菌耐药机制的初步研究[J]. 中国抗生素杂志, 2012, 37 (2): 132–136. |
| [23] | 景春梅, 王偲. 2009-2014年重庆地区儿童感染肺炎链球菌的耐药性及血清分型研究[J]. 中国抗生素杂志, 2016, 41 (1): 64–69. |
| [24] | 李丽民, 吴先华, 徐礼峰, 等. 金黄色葡萄球菌的临床分布及耐药性分析[J]. 中华医院感染学杂志, 2014, 24 (4): 787–789. |
 2017, Vol. 19
2017, Vol. 19