病例1:患儿,女,13岁,因头痛伴呕吐3 d、发热1 d入院。患儿春季起病,入院前3 d出现间歇性头痛,以前额部为主,伴呕吐,呕吐物为胃内容物,非喷射性,5~6次/d。入院前1天出现发热,体温达39℃,无寒战,偶有胡言乱语,无抽搐及昏迷。既往体健,无心脏病史,近期无外伤及拔牙病史。家族史无特殊。
入院体查:T 38.9℃,P 145次/min,R 30次/min,BP 110/80 mm Hg,体重35 kg。嗜睡状,精神差,对答切题,呼吸规则,全身皮肤见散在瘀点,以下肢较多,浅表淋巴结无肿大,双瞳等大等圆,直径3 mm、对光反射灵敏,颈有抵抗感,心率145次/min,心音有力,律齐,未闻及杂音,双肺呼吸音清晰,肝脾无肿大,克氏征阳性,布氏征阴性,病理征阴性。
辅助检查:血常规WBC 19.2×109/L,N 0.89、L 0.06、M0.05,RBC 3.5×1012/L,Hb 83.4 g/L,PLT 52×109/L;CRP 165.9 mg/L;电解质、肝肾功能及心肌酶无异常;凝血功能无异常;脑脊液常规:透明,潘氏试验(-),细胞总数580×106/L,WBC 255×106/L:N 0.7、L 0.3,糖、氯化物正常,蛋白567 mg/L(参考值:150~450 mg/L),墨汁染色阴性。血培养及骨髓培养:耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus, MRSA);脑脊液培养阴性。
病例2:患儿,男,5岁,因发热、头痛1周,皮肤紫癜4 d入院。患儿春季起病,入院前1周出现间歇发热,最高体温39.5℃,伴头痛,无抽搐、呕吐及昏迷,当地医院予“拉氧头孢”治疗3 d无好转。入院前4 d出现皮肤瘀点、瘀斑,伴面色苍白,无呕血、便血,无鼻衄及牙龈出血。既往体健,无心脏病史,近期无外伤及拔牙病史。家族史无特殊。
体查T 38.7℃,P138次/min,R 36次/min,BP 95/61 mm Hg,体重20 kg。嗜睡状,全身皮肤见散在暗红色瘀点、瘀斑,以躯干、右手虎口及足趾较多,足趾瘀斑可见坏死(图 1A),面色稍苍白,颈部淋巴结肿大(1.5 cm×1.5 cm),皮肤无红热,双瞳等圆等大、直径3 mm,对光反射灵敏,颈有抵抗感,心率138次/min、心音有力、律齐、未闻及杂音,双肺呼吸音清晰,腹软,肝肋下3 cm,脾未触及,克氏征阳性,布氏征阴性,病理征阴性。
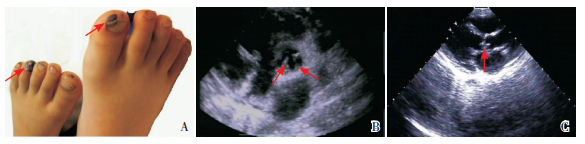
|
图 1 患者的皮肤瘀斑及心脏彩超 A:足趾瘀斑及皮肤坏死(如箭头所示);B、C:两例患者心脏彩超均可见主动脉瓣赘生物(箭头所示)。 |
辅助检查:血常规WBC 12.5×109/L,N 0.90、L 0.07、M 0.03,RBC 2.63×1012/L,Hb 71.6 g/L,PLT 35×109/L;CRP 170 mg/L;电解质、肝肾功能及心肌酶无异常,凝血功能无异常;脑脊液潘氏试验(+),细胞总数9 000×106/L,WBC 1 080×106/L:N 0.8、L 0.2,糖、氯化物正常,蛋白1 614 mg/L。头颅CT右侧小脑、双侧大脑多发血肿。血培养及骨髓培养:MRSA,脑脊液培养阴性。
2 诊断思维2例患儿均为春季急性起病,表现为发热、头痛、呕吐,查体见皮肤瘀点、瘀斑,脑膜刺激征阳性,外周血WBC及中性粒细胞增高、CRP增高,脑脊液白细胞数增高达数百或上千,且以中性粒细胞为主,脑脊液蛋白增高。初诊考虑化脓性脑膜炎(不排除流行性脑脊髓膜炎)。另外,2例患儿均有发热、皮肤紫癜及血常规两系减少(中度贫血、血小板减少),而且病例2有淋巴结和肝脏肿大,需行骨髓细胞学检查排除血液系统恶性疾病。予以大剂量头孢噻肟(每日200 mg/kg)及青霉素(每日40万U/kg)抗感染,治疗48~72 h患儿仍持续高热,根据血培养、骨髓培养(均为MRSA)及药敏结果,抗生素调整为万古霉素,48 h后2例患儿仍持续发热,且出现心脏杂音。而对于发热患儿病程中新出现的心脏杂音或原有杂音增强,需警惕感染性心内膜炎(infective endocarditis, IE);而且患儿细菌培养提示MRSA,金葡菌脓毒症患者极易形成菌栓,结合患儿皮肤有瘀斑及坏死,血常规两系降低,头颅CT提示多发血肿,感染性心内膜炎可能性大,行心脏彩超以确诊。
3 进一步检查骨髓细胞学提示感染性骨髓象。2例患儿的心脏彩超均可见主动脉瓣赘生物形成(图 1B、1C)。
4 诊断及确诊依据2例患儿均诊断为IE,诊断依据:(1)急性起病,发热伴中枢神经系统症状,以及皮肤紫癜、坏死,一般抗感染治疗效果差;(2)新增心脏杂音;(3)白细胞及中性粒细胞增高,合并贫血、血小板降低;CRP升高,血培养及骨髓培养均提示金黄色葡萄球菌,心脏彩超提示主动脉瓣赘生物形成。
5 临床经过入院后2例患者的初步诊断考虑化脓性脑膜炎,予大剂量头孢噻肟、青霉素联合抗感染,甘露醇降颅压等治疗,48~72 h后患儿仍持续高热(最高达40℃),其中病例2还出现抽搐1次,表现为右侧肢体抽搐,伴右下肢活动障碍。2例患者的骨髓细胞学均提示感染性骨髓象,血培养、骨髓培养均提示MRSA,对万古霉素敏感,改用万古霉素抗感染,治疗2天后2例患儿均仍有发热,且皮肤紫癜增多,胸骨左缘第三、四肋间闻及2/6级舒张期杂音。病例2因病程中出现抽搐,复查头颅CT,提示右侧小脑、双侧大脑多发血肿。进一步行心脏彩超检查,均可见主动脉瓣赘生物形成,确诊感染性心内膜炎。病例1规律抗感染6周后痊愈出院,随访4年无异常。病例2放弃治疗后死亡。
6 讨论IE是由于病原微生物引起心内膜或邻近大动脉内膜感染伴赘生物的形成。儿童IE罕见,发病率约为0.34~0.64/10 000,其高危因素有别于成人(成人常见高危因素为风湿性心脏病、牙科手术、吸毒、糖尿病、心脏瓣膜退行性变等),多为先天性心脏病(尤其是青紫型先心病、心内膜垫缺失、室间隔缺损等)或中心静脉导管的应用[1-3]。也有10%的患儿无明显高危因素[2]。本研究的2例患儿均无高危因素。
IE产生的机制是由于各种高危因素引起心脏内皮细胞损伤,导致纤维连接蛋白相关的细胞因子及组织因子释放,使纤维蛋白及血小板聚集形成赘生物,并沉积在心脏或瓣膜[4]。病原微生物入侵后极易粘附于赘生物,有菌赘生物受高速血流冲击容易脱落、栓塞器官而引发不同的临床表现;细菌的毒力、宿主的免疫反应不同,临床症状也不同,轻者表现为不明原因发热、全身不适,重者可表现为感染性休克[5-6]。常见表现有发热(占90%)、心脏杂音(占85%)、心功能不全、皮肤出血点及脾大,而Osier结节、Roth斑罕见[7-8]。儿童IE临床表现往往不典型,常以某一器官栓塞及感染为主要表现,如脑膜炎、骨髓炎、脾梗死、肺栓塞等,甚至表现为不明原因的高热、乏力、体重下降、厌食或精神萎靡等,极易误诊[2]。本研究的2例患儿,均以颅内感染为首发表现。IE确诊依靠血培养及心脏彩超。根据欧洲心脏病学会IE管理指南[9],本研究2例患儿均符合IE诊断标准的2项主要指标:2次细菌培养为同一细菌,心脏彩超证实心内膜受累。IE诊断明确。
抗生素治疗前多次采血进行血培养对于IE诊断至关重要,细菌培养阳性率可高达90%。IE的病原菌以链球菌和金黄色葡萄球菌(金葡菌)为主,近年来报道的金葡菌感染所致IE日益增多[10]。本研究2例患者的细菌培养均为金葡菌,与文献报道相符。心脏彩超对IE诊断极为重要,敏感性为75%,特异性达90%。本研究2例患者初诊考虑颅内感染,当出现心脏杂音后心脏彩超检查发现瓣膜赘生物才得以确诊。因此对于发热患儿要动态观察有无心脏杂音出现,及时行心脏彩超。
IE的抗生素疗程一般4~6周[9];约40%~50%的患者可能需要外科手术治疗[11]。多数患者预后良好,住院患者的死亡率在20%以内,预后主要取决于发病年龄、感染的病原菌、治疗的时间、有无神经系统并发症等[1]。本文病例1经过抗感染治疗后体温正常、皮疹消退、心脏杂音消失、血象恢复正常。
7 结语儿童IE临床表现多样,尤其是心脏杂音出现之前,或以器官栓塞为主要表现时极易误诊。因此,对于不明原因发热患儿的新发心脏杂音或原有心脏杂音增强,及以化脑为表现伴难以用血小板减少解释的皮肤、黏膜出血时,均应警惕IE。
| [1] | Cahill TJ, Prendergast BD. Infective endocarditis[J]. Lancet, 2016, 387 (10021): 882–893. DOI:10.1016/S0140-6736(15)00067-7 |
| [2] | Singh Y, Ganjoo N. Infective endocarditis in children[J]. Paediatr Child Health, 2017, 27 (2): 68–74. DOI:10.1016/j.paed.2016.09.003 |
| [3] | Valente AM, Jain R, Scheurer M, et al. Frequency of infective endocarditis among infants and children with Staphylococcus aureus bacteremia[J]. Pediatrics, 2005, 115 : e15–19. |
| [4] | Widmer E, Que YA, Entenza JM, et al. New concepts in the pathophysiology of infective endocarditis[J]. Curr Infect Dis Rep, 2006, 8 (4): 271–279. DOI:10.1007/s11908-006-0071-z |
| [5] | Werdan K, Dietz S, Löffler B, et al. Mechanisms of infective endocarditis:pathogen-host interaction and risk states[J]. Nat Rev Cardiol, 2014, 11 (1): 35–50. |
| [6] | Olmos C, Vilacosta I, Fernández C, et al. Contemporary epidemiology and prognosis of septic shock in infective endocarditis[J]. Eur Heart J, 2013, 34 (26): 1999–2006. DOI:10.1093/eurheartj/ehs336 |
| [7] | Silverman ME, Upshaw CB Jr. Extracardiac manifestations of infective endocarditis and their historical descriptions[J]. Am J Cardiol, 2007, 100 (12): 1802–1807. DOI:10.1016/j.amjcard.2007.07.034 |
| [8] | Servy A, Valeyrie-Allanore L, Alla F, et al. Prognostic value of skin manifestations of infective endocarditis[J]. JAMA Dermatol, 2014, 150 (5): 494–500. DOI:10.1001/jamadermatol.2013.8727 |
| [9] | Habib G, Lancellotti P, Antunes MJ, et al. 2015 ESC guidelines for the management of infective endocarditis[J]. Rev Esp Cardiol (Engl Ed), 2016, 69 (1): 2285–2286. |
| [10] | Selton-Suty C, Célard M, Le Moing V, et al. Preeminence of Staphylococcus aureus in infective endocarditis:a 1-year population-based survey[J]. Clin Infect Dis, 2012, 54 (9): 1230–1239. DOI:10.1093/cid/cis199 |
| [11] | Prendergast BD, Tornos P. Surgery for infective endocarditis:who and when[J]. Circulation, 2010, 121 (9): 1141–1152. DOI:10.1161/CIRCULATIONAHA.108.773598 |
 2017, Vol. 19
2017, Vol. 19


