小儿全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)常出现在心脏手术或体外循环及手术的双重打击之后,其特征与成人不同,2005年国际小儿脓毒症共识会议对其做出了独立的描述,包括体温或白细胞的异常、呼吸频率及心率的异常[1]。炎性反应可能会进一步损害到肺、心肌、肾脏、肝脏、肠和大脑等器官的功能,最终导致多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)[2]。因此,尽早对SIRS作出诊断并及时给予治疗对降低患儿心脏术后并发症、改善预后至关重要[3]。目前,针对小儿SIRS早期诊断标志物的研究较少[4],常借鉴白细胞介素-6(IL-6)、C-反应蛋白(CRP)等相关指标的检测协助诊断,以至诊断不及时,且缺乏敏感性和特异性[5-6]。目前有研究显示,吲哚胺2, 3-双加氧酶(indoleamine 2, 3-dioxygenase, IDO)在炎性反应及免疫过程中扮演重要角色,敏感性强,特异性好[7]。然而其是否可以作为小儿心脏术后SIRS的早期诊断标记物尚无报道。本研究探讨IDO在小儿心脏术后的表达及其作为术后SIRS早期诊断标记物的可能性,现将结果报告如下。
1 资料与方法 1.1 研究对象2012年5月至2016年1月在我院行心脏手术的90例先天性心脏病(简称先心病)患儿为研究对象。患儿中位年龄60个月(范围:8~135个月)。其中男性41例,女性49例;体重20.3 kg(范围7.1~29.1 kg)。90例患儿中,房间隔缺损31例,室间隔缺损45例,房室间隔缺损14例。根据SIRS诊断标准[8]及患儿术后是否发生SIRS分为两组:SIRS组(43例)和对照组(47例)。对照组为同期与SIRS组年龄、体重、性别、心功能等相似的手术患儿但未发生SIRS者。两组患儿一般资料见表 1。
| 表 1 两组患儿的一般资料 |
|
|
病例纳入及排除标准:纳入心功能Ⅰ~Ⅱ级(NYHA标准),且术前常规检查均无异常及手术禁忌的患儿;SIRS诊断符合国际小儿脓毒症共识标准[8];排除术前感染及血清CRP升高的患儿。本研究经我院伦理委员会批准,患儿家属均知情同意。
1.2 标本收集及指标检测采集麻醉前、转机中(转机后15~30 min内)、术后24 h、术后72 h 4个时间点的外周血标本。取外周血5 mL,促凝管保存。血液标本采集后30 min内,离心10 min(3 000 r/min),分离血清,收集于冷冻管内,-70℃保存。采用酶联免疫吸附法(ELISA)测定IDO、IL-6浓度(上海酶联ELISA试剂盒)。采用全自动生化分析仪测定CRP浓度。
1.3 统计学分析数据结果采用SPSS 19.0软件进行统计学分析。正态分布的计量资料用均数±标准差(x±s)表示,组间比较采用两独立样本t检验;偏态分布的计量资料用中位数和四分位数间距[P50(P25,P75)]表示,组间比较采用Mann-Whitney U检验。绘制ROC曲线,计算曲线下面积(AUC),评估血浆IDO作为诊断标记物的特异性和敏感性。组间AUC的比较采用Z检验。P<0.05示有统计学意义。
2 结果 2.1 两组血清CRP、IL-6及IDO的比较SIRS组血清CRP水平在术后72 h明显高于对照组(表 2);SIRS组血清IL-6水平在转机中及术后72 h均明显高于对照组(表 3);SIRS组血清IDO在术后24 h及72 h的表达明显高于对照组(表 4)。
| 表 2 SIRS组和对照组CRP水平的比较 (x±s,mg/L) |
|
|
| 表 3 SIRS组和对照组IL-6水平的比较 (x±s,ng/L) |
|
|
| 表 4 SIRS组和对照组IDO水平的比较 (x±s,U/L) |
|
|
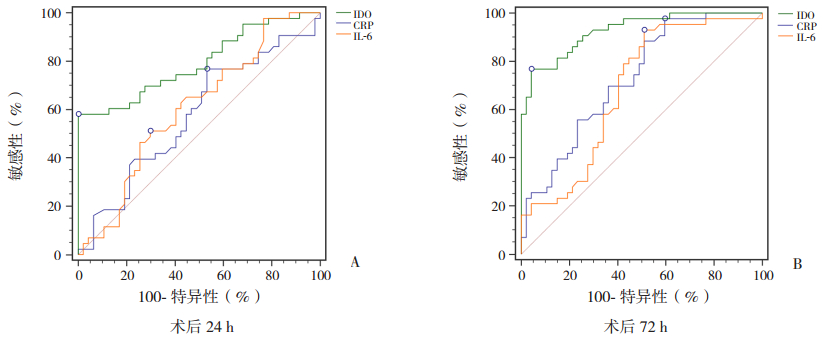
CRP、IL-6及IDO在不同时间点对SIRS的诊断效能不相同,其中IDO在术后24 h即显现出对SIRS的诊断优势(表 5、图 1A);在术后72 h,3种指标对SIRS诊断效能均有提高,其中IDO诊断价值最高(表 6、图 1B)。
| 表 5 术后24 h CRP、IL-6及IDO诊断效能的比较 |
|
|
|
图 1 术后24 h及72 h CRP、IDO、IL-6对SIRS诊断的ROC曲线 |
| 表 6 术后72 h CRP、IL-6及IDO诊断效能的比较 |
|
|
SIRS是小儿心脏术后最常见,且对患儿预后影响最大的并发症,其发生率约为8.9%~22.4%[4, 9]。患者发生SIRS后如果得不到及时诊治,往往会引起肺、心肌、肾、肝、小肠和脑等器官损害,增加患儿的病死率和住院时间[2]。目前,国内外对小儿心脏术后SIRS的临床特点和诊断指标的研究较少[10]。一项回顾性研究显示,小儿心脏术后SIRS多发生在术后72 h,与多种危险因素相关,特别是与体外循环时间和血浆使用量呈正相关[1]。而术后CRP、IL-6等炎性指标的增高往往预示着SIRS的发生,但是其敏感性和特异性差异较大,难以作为SIRS早期诊断的标志物[11]。目前,心脏术后SIRS的发病机制尚不清楚,可能涉及手术损伤、体外循环刺激及缺血再灌注损伤等导致炎性细胞的激活,炎性介质的释放,形成“瀑布效应”,使得炎性介质数量不断增加,炎症反应不断扩大,损伤组织细胞,形成SIRS[12]。因此,若能早期诊断SIRS,早期干预,阻断炎性因子大量释放,将SIRS控制在轻症阶段,势必可以减轻心脏术后严重并发症MODS的发生,改善预后。
IDO可以催化色氨酸代谢为犬尿氨酸,从而影响细胞功能,其在移植免疫、炎症反应方面发挥着重要的作用,在炎症或感染的过程中,其表达活性也会明显增高[7]。本研究中,SIRS组IDO表达水平于术后24 h开始高于对照组,同时其作为诊断指标,其ROC曲线下面积为0.793,Youden指数0.581,均明显高于IL-6和CRP。在术后72 h,CRP、IL-6及IDO在两组间的表达均有统计学意义,且均有一定的诊断效能,但IDO特异性和敏感性最高,表现出了更高的诊断价值。由此可见,IDO作为小儿心脏术后SIRS的早期诊断指标敏感性更高。在术后24 h,IDO对诊断SIRS的最佳阈值为128.5 U/L,随后持续升高,术后72 h最佳阈值为199.8 U/L,这两个时间点的诊断效能均高于IL-6和CRP,提示持续检测IDO有望更早判断SIRS的发生。
本研究作为前期探索性试验,纳入的病例数较少,有些结果结论可能会有偏倚,且本研究为单中心研究,缺乏地域差异,没有人种差别,但本研究为探讨IDO作为小儿先心病体外循环术后SIRS早期诊断标记物的可能性打下了一定基础。在未来的研究中,我们将进一步加大样本量,联合其他多种细胞因子进行研究,以进一步提高其诊断特异性及敏感性。
| [1] |
Boehne M, Sasse M, Karch A, et al. Systemic inflammatory response syndrome after pediatric congenital heart surgery:Incidence, risk factors, and clinical outcome[J]. J Card Surg, 2017, 32(2): 116-125. DOI:10.1111/jocs.v32.2 (  0) 0) |
| [2] |
Durandy Y. Minimizing systemic inflammation during cardiopulmonary bypass in the pediatric population[J]. Artif Organs, 2014, 38(1): 11-18. DOI:10.1111/aor.2014.38.issue-1 (  0) 0) |
| [3] |
Träger KK, Fritzler D, Fischer G, et al. Treatment of post-cardiopulmonary bypass SIRS by hemoadsorption:a case series[J]. Int J Artif Organs, 2016, 39(3): 141-146. DOI:10.5301/ijao.5000492 (  0) 0) |
| [4] |
Güvener M, Korun O, Demirtürk OS. Risk factors for systemic inflammatory response after congenital cardiac surgery[J]. J Card Surg, 2015, 30(1): 92-96. DOI:10.1111/jocs.v30.1 (  0) 0) |
| [5] |
Giannoudis PV, Harwood PJ, Loughenbury P, et al. Correlation between IL-6 levels and the systemic inflammatory response score:can an IL-6 cutoff predict a SIRS state?[J]. J Trauma, 2008, 65(3): 646-652. DOI:10.1097/TA.0b013e3181820d48 (  0) 0) |
| [6] |
Anderson IB, Sudhakar S, Keenan CR, et al. The elusive SIRS diagnosis[J]. J Gen Intern Med, 2013, 28(3): 470-474. DOI:10.1007/s11606-012-2203-5 (  0) 0) |
| [7] |
Munn DH, Mellor AL. IDO in the tumor microenvironment:inflammation, counter-regulation, and tolerance[J]. Trends Immunol, 2016, 37(3): 193-207. DOI:10.1016/j.it.2016.01.002 (  0) 0) |
| [8] |
Goldstein B, Giroir B, Randolph A, et al. International pediatric sepsis consensus conference:definitions for sepsis and organ dysfunction in pediatrics[J]. Pediatr Crit Care Med, 2005, 6(1): 2-8. DOI:10.1097/01.PCC.0000149131.72248.E6 (  0) 0) |
| [9] |
Soares LC, Ribas D, Spring R, et al. Clinical profile of systemic inflammatory response after pediatric cardiac surgery with cardiopulmonary bypass[J]. Arq Bras Cardiol, 2010, 94(1): 127-133. DOI:10.1590/S0066-782X2010000100019 (  0) 0) |
| [10] |
Balk RA. Systemic inflammatory response syndrome (SIRS):where did it come from and is it still relevant today?[J]. Virulence, 2014, 5(1): 20-26. DOI:10.4161/viru.27135 (  0) 0) |
| [11] |
Allan CK, Newburger JW, McGrath E, et al. The relationship between inflammatory activation and clinical outcome after infant cardiopulmonary bypass[J]. Anesth Analg, 2010, 111(5): 1244-1251. DOI:10.1213/ANE.0b013e3181f333aa (  0) 0) |
| [12] |
Punjabi PP, Taylor KM. The science and practice of cardiopulmonary bypass:From cross circulation to ECMO and SIRS[J]. Glob Cardiol Sci Pract, 2013(3): 249-260. (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


