2. 上海市儿童医院/上海交通大学附属儿童医院 泸定路院区呼吸科, 上海 200062
肺炎支原体(Mycoplasma pneunoniae, MP)是儿童社区获得性肺炎(community acquired pneumonia, CAP)最常见的病原体之一[1-2]。一般认为,肺炎支原体肺炎(Mycoplasma pneumoniae pneumonia, MPP)具有自限性,经大环内酯类药物治疗后病情可得到控制。然而,近年来随着MP耐药菌株的出现,造成了有效抗菌药物的失效[3-6],再加上混合感染等因素,最终导致MPP发展为难治性肺炎支原体肺炎(refractory mycoplasma pneumoniae pneumonia, RMPP)。研究表明,RMPP在各个年龄段儿童中均可发生[7],且发病率正在逐年增加[8]。RMPP患儿病情进展快,容易合并肺内外并发症,且病程迁延不愈,临床治疗上颇为困难。但是,如果能早期识别RMPP,及早给予糖皮质激素治疗,甚至进行纤维支气管镜肺泡灌洗术等,则可更快缓解患儿症状,控制病情[9-10]。由此可见,寻找一个快捷、有效的方法,帮助临床早期、准确识别RMPP,极具必要性。尽管近些年,有关儿童RMPP的早期识别以及临床特征的研究并不罕见,但均为小样本研究[9, 11-12]。本研究共纳入700余例MPP患儿,其中RMPP患儿达152例,样本量相对较大,故研究结果更科学、可靠。因此,本文通过比较RMPP和MPP患儿基本情况、临床表现、感染指标和心肌酶谱的差异,旨在一定程度上为儿童RMPP的早期识别和治疗提供指导和科学依据。
1 资料与方法 1.1 研究对象选取2015年10月至2016年12月期间在上海交通大学附属儿童医院普陀院区呼吸科确诊的MP感染CAP住院患儿703例为研究对象,根据诊断标准将患儿分为RMPP组(n=152)和MPP组(n=551)。本研究已获得医院伦理委员会批准和患儿家长知情同意书。
儿童CAP诊断标准参考《儿童社区获得性肺炎管理指南(2013修订)》[13],同时排除:(1)气管炎、支气管哮喘、支气管异物、肺结核、肺部真菌病、肺寄生虫病、间质性肺疾病、免疫异常性肺疾病、呼吸系统先天性肺疾病、肺部肿瘤、肺炎合并脑膜炎等其他系统疾病的病例;(2)无影像检查结果者;(3)病原学检测不完整者;(4)接种肺炎链球菌疫苗后5 d内患儿。
MPP诊断标准[13-14]:(1)单份血清肺炎支原体抗体MP-Ab>1 : 160;(2)血清肺炎支原体特异性IgM抗体阳性;(3)咽拭子、痰、肺泡灌洗液、胸腔积液中MP-DNA拷贝数>500;(4)除外病毒和细菌等病原体所致肺部感染。符合(1)~(3)项中任意一项加第(4)项可确诊为MPP病例。
RMPP诊断标准[11]:MPP病例正规应用大环内酯类抗生素5 d及以上,如出现如下情况之一:(1)患儿病情未见好转,如临床征象加重,仍持续发热;(2)肺部影像学表现加重,表现为单侧或双侧大叶高密度肺实变,和/或合并胸腔积液,弥漫性间质性肺浸润,肺不张改变。可确诊为RMPP病例。
1.2 标本采集方法血标本:于患儿入院4 h内采集。同时采集双份静脉血各2~3 mL,用于常规和生化检测,以及血清MP-IgM和MP-Ab检测。
痰标本:于患儿入院后第1天采集。由检验科专业技师使用无菌吸痰器采集患儿急性期痰液,置消毒试管内,并立即送检,用于MP-DNA检测。
咽拭子:于患儿入院后第1天采集。用压舌板轻压舌部,以轻快的动作,迅速擦拭咽及两侧腭弓部的分泌物后,将拭子插入试管中塞紧,并及时送检,用于MP-DNA检测。
肺泡灌洗液:留取行支气管肺泡灌洗患儿的灌洗液5~6 mL,用于MP-DNA检测。
1.3 MP检测方法及阳性判定同时采用间接免疫荧光法(IFA)(试剂盒由郑州安图生物工程股份有限公司提供)和被动凝集法(赛乐迪亚-麦可Ⅱ诊断试剂盒,富士瑞必欧株式会社)检测血清MP水平,实验步骤参照试剂盒说明书进行。若血清MP-IgM阳性和(或)急性期、恢复期双份血清MP-Ab呈4倍及以上升高或降低,则判断为MP阳性。
采用MP核酸定量检测试剂盒(广州中山大学达安基因股份有限公司),用PCR荧光探针法定量检测MP-DNA。取咽拭子、痰、肺泡灌洗液、胸腔积液标本,经震荡、离心、去上清,再加入裂解液提取DNA,进行PCR扩增。实验步骤按照试剂盒说明书进行。当MP-DNA拷贝数>500,则判断为MP阳性。
1.4 统计学分析采用SPSS 16.0统计软件对数据进行统计学分析。符合正态分布的计量资料以均数±标准差(x±s)表示,两组间比较采用t检验;不符合正态分布的计量资料以中位数(四分位间距)[M(P25, P75)]表示,两组间比较采用Mann-Whitney U检验。计数资料以百分比(%)表示,两组间比较采用χ2检验。多因素分析采用两分类logistic回归模型。通过受试者工作特征曲线(ROC)对指标进行诊断价值分析。P<0.05为差异有统计学意义。
2 结果 2.1 基本情况两组患儿性别构成比及平均年龄比较,差异均无统计学意义(P>0.05)。RMPP组患儿的住院时间长于MPP组(P<0.01)。见表 1。
| 表 1 两组患儿基本情况比较 |
|
|
RMPP组入院第1天的热峰高于MPP组(P<0.01);RMPP组听诊哮鸣音的比例则低于MPP组(P=0.009)。两组患儿在咳嗽、胸痛、呼吸困难及湿罗音等方面发生率的比较差异均无统计学意义(P>0.05)。见表 2。
| 表 2 两组患儿临床表现比较 |
|
|
RMPP组中性粒细胞百分比和降钙素原(PCT)水平明显高于MPP组(P<0.05),淋巴细胞百分比明显低于MPP组(P<0.05);而WBC和CRP水平在两组间比较差异无统计学意义(P>0.05)。心肌酶谱结果显示:RMPP组天门冬氨酸氨基转移酶(AST)和乳酸脱氢酶(LDH)水平明显高于MPP组(P<0.05),而肌酸激酶和肌酸激酶同工酶水平在两组间比较差异无统计学意义(P>0.05)。见表 3。
| 表 3 两组患儿的感染指标和心肌酶谱比较 |
|
|
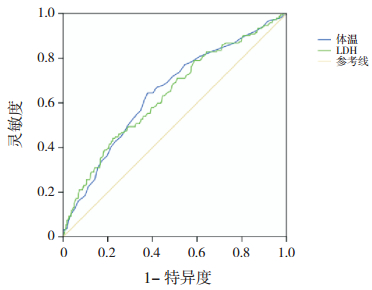
Logistic回归分析结果显示,热峰和LDH与儿童RMPP密切相关(P<0.05)(表 4)。ROC曲线分析显示,利用热峰和LDH诊断儿童RMPP的ROC曲线下面积(AUC)和95%CI分别为0.647(0.597~0.696)和0.637(0.586~0.687)。
| 表 4 多因素分析 (两分类logistic回归模型) |
|
|
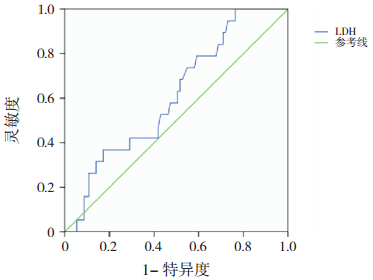
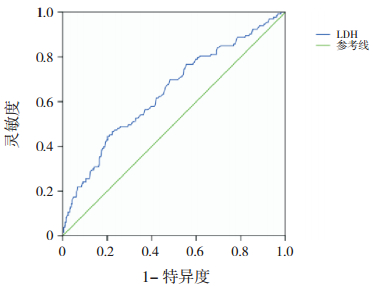
考虑到儿童的血清LDH水平正常范围在2岁之前和2岁后有所不同,因此,我们分别对≤2岁和>2岁患儿绘制了ROC。结果显示:≤2岁组,LDH诊断RMPP的AUC和95%CI为0.611(0.484~0.739);且当临界值取LDH为400 U/L时,诊断灵敏度为52.63%,特异度为54.84%,阳性和阴性预测值分别为19.23%和85.00%,阳性和阴性似然比分别为1.17和0.86。>2岁组,LDH诊断RMPP的AUC和95%CI为0.643(0.588~0.698);且当临界值取LDH为335 U/L时,诊断灵敏度为69.92%,特异度为51.55%,阳性和阴性预测值分别为29.81%和85.35%,阳性和阴性似然比分别为1.44和0.58。见图 1~3。
|
图 1 体温和LDH诊断RMPP患儿的ROC分析图 |
|
图 2 LDH诊断≤2岁RMPP患儿的ROC分析图 |
|
图 3 LDH诊断>2岁RMPP患儿的ROC分析图 |
目前认为RMPP的主要发病机制与“对大环内酯类抗生素耐药”、“过度的免疫与炎症反应参与”、“混合感染”和“治疗延迟”等有关[15]。有研究表明,相较于MPP,RMPP患儿热程更长,肺外并发症的比例更高[16]。本次研究结果也显示,RMPP患儿的热峰更高,病程更长。临床上如果对RMPP早期判断不足,延误治疗时机,会导致患儿病情迁延不愈,易遗留肺部后遗症,甚至危及患儿生命。因此,儿科医师对儿童RMPP的早诊断、早治疗,尤为重要。
本次研究发现,RMPP和MPP在咳嗽、呼吸困难等症状、体征上均无明显差别,甚至MPP患儿听诊喘鸣音的比例高于RMPP。说明对RMPP的早期识别,不能从一般的临床表现上判断。本研究还发现,RMPP患儿的中性粒细胞百分比和PCT水平明显升高。MP黏附于上皮细胞表面后,会反复持续损伤气道纤毛柱状上皮,造成纤毛数量减少,结构异常。而纤毛结构的异常,必然会引起黏液-纤毛系统清除功能受损,从而有利于致病菌的持续存在和繁殖,患儿易出现混合感染。因此,我们认为RMPP患儿中性粒细胞比例和PCT水平高于MPP组的原因可能与合并细菌感染有关。以往研究结果表明[17],心肌损害是儿童RMPP常见的肺外并发症。一方面,MP作为一种特异性变应原引发速发型及迟发型变态反应,进而使气道呈现高反应状态,导致气道乃至肺泡的慢性炎症,阻碍肺泡内气体交换,最终导致心肌缺氧受损;另一方面,心、肺、肾及平滑肌上皮有自身抗体存在,机体受到MP感染后可引发多种血清学反应,即MP导致的感染免疫反应,从而造成肺外组织损害,包括心肌损害。本次研究也发现,RMPP患儿的AST和LDH水平明显高于MPP组。这一结果提示了临床上对RMPP患儿进行诊治的同时,需关注其心肌损害情况。
然而,多因素分析结果显示,仅LDH升高是儿童RMPP的独立相关因素。LDH是一种糖酵解酶,存在于机体各个重要脏器。当细胞溶解或细胞膜受到破坏,LDH可释放到细胞外,引起血清中LDH的升高。RMPP的发病机制之一为宿主的过度免疫反应,而炎性细胞因子在机体的防御机制激活中发挥重要作用。研究显示[18],白细胞介素18(IL-18)与MPP的严重程度相关,且病情越严重,IL-18越呈现高表达。而血清IL-18的水平与LDH显著相关,却与白细胞计数、C反应蛋白、谷草转氨酶及谷丙转氨酶均无明显关联[19]。因此,尽管心肌酶谱的改变,可被用于临床早期识别儿童RMPP的参考,但其中最关键的指标则是LDH,可在一定程度上作为诊断儿童RMPP的生物标志物。本研究ROC分析也显示,利用LDH诊断儿童RMPP的AUC为0.637,具有诊断价值。尤其在2岁以上MPP患儿中,当LDH水平高于335 U/L时,诊断灵敏度可达到69.92%,特异度为51.55%,此时临床应高度警惕RMPP,并及时调整抗生素,使用糖皮质激素,甚至进行纤维支气管镜肺泡灌洗术等,以减轻患儿症状、控制病情。
| [1] |
Chen K, Jia R, Li L, et al. The aetiology of community associated pneumonia in children in Nanjing, China and aetiological patterns associated with age and season[J]. BMC Public Health, 2015, 15: 113-118. DOI:10.1186/s12889-015-1422-1 (  0) 0) |
| [2] |
Jain S, Williams DJ, Arnold SR, et al. Community-acquired pneumonia requiring hospitalization among U.S.children[J]. N Engl J Med, 2015, 372(9): 835-845. DOI:10.1056/NEJMoa1405870 (  0) 0) |
| [3] |
Hong KB, Choi EH, Lee HJ, et al. Macrolide resistance of Mycoplasma pneumonia, South Korea, 2000-2011[J]. Emerg Infect Dis, 2013, 19(8): 1281-1284. DOI:10.3201/eid1908.121455 (  0) 0) |
| [4] |
Komatsu H, Tsunod T, Inui A, et al. Characteristics of hospitalized children infected with macrolide-resistant Mycoplasma pneumonia[J]. Braz J Infect Dis, 2014, 18(3): 294-299. DOI:10.1016/j.bjid.2013.09.004 (  0) 0) |
| [5] |
Zhou Y, Zhang Y, Sheng Y, et al. More complications occur in macrolide-resistant than in macrolide-sensitive Mycoplasma pneumonia pneumonia[J]. Antimicrob Agents Chemother, 2014, 58(2): 1034-1038. DOI:10.1128/AAC.01806-13 (  0) 0) |
| [6] |
Ma Z, Zheng Y, Deng J, et al. Characterization of macrolide resistance of Mycoplasma pneumoniae in children in Shenzhen, China[J]. Pediatr Pulmonol, 2014, 49(7): 695-700. DOI:10.1002/ppul.22851 (  0) 0) |
| [7] |
王秀芳, 胡文洁, 宋丽, 等. 不同年龄段难治性肺炎支原体肺炎急性期患儿纤维支气管镜下气道改变特点[J]. 中国妇幼保健, 2017, 32(3): 504-506. (  0) 0) |
| [8] |
王亚林. 2005-2014年山东省泰安地区不同年龄段小儿肺炎支原体肺炎特点分析[J]. 泰山医学院学报, 2016, 37(8): 854-855. (  0) 0) |
| [9] |
邵新环, 李倩倩, 向治纬, 等. 儿童难治性肺炎支原体肺炎临床特征及治疗[J]. 临床儿科杂志, 2015, 33(11): 958-961. DOI:10.3969/j.issn.1000-3606.2015.11.010 (  0) 0) |
| [10] |
王莉, 夏万敏, 艾涛, 等. 支气管肺泡灌洗术在儿童难治性肺炎支原体肺炎诊治中的作用[J]. 四川医学, 2016, 37(11): 1250-1252. (  0) 0) |
| [11] |
刘金荣, 彭芸, 杨海明, 等. 难治性肺炎支原体肺炎的表现特征和判断指标探讨[J]. 中华儿科杂志, 2012, 50(12): 915-918. DOI:10.3760/cma.j.issn.0578-1310.2012.12.010 (  0) 0) |
| [12] |
王臻, 李雅春, 陈璐. 儿童难治性肺炎支原体肺炎的早期识别[J]. 中国当代儿科杂志, 2015, 17(11): 1189-1192. DOI:10.7499/j.issn.1008-8830.2015.11.008 (  0) 0) |
| [13] |
中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童社区获得性肺炎管理指南(2013修订)(上)[J]. 中华儿科杂志, 2013, 51(10): 745-752. DOI:10.3760/cma.j.issn.0578-1310.2013.10.006 (  0) 0) |
| [14] |
赵志伟, 宋曼莉. 儿童肺炎支原体感染三种实验诊断方法评价[J]. 中国医学创新, 2017, 14(25): 64-67. DOI:10.3969/j.issn.1674-4985.2017.25.017 (  0) 0) |
| [15] |
周朋, 周旭, 张葆青. 儿童难治性支原体肺炎发病机制研究进展[J]. 山东医药, 2016, 56(42): 103-105. DOI:10.3969/j.issn.1002-266X.2016.42.037 (  0) 0) |
| [16] |
梅玉霞, 蒋瑾瑾, 蔡斌, 等. 儿童难治性支原体肺炎临床危险因素分析[J]. 临床儿科杂志, 2014, 32(12): 1138-1140. DOI:10.3969/j.issn.1000-3606.2014.12.010 (  0) 0) |
| [17] |
王新佳. 难治性肺炎支原体肺炎的并发症[J]. 中国医刊, 2014, 49(7): 8-9. (  0) 0) |
| [18] |
金辉. IL-13、IL-18及TNF-α在支原体肺炎儿童血清中的表达及临床价值[J]. 国际检验医学杂志, 2017, 38(20): 2832-2834. DOI:10.3969/j.issn.1673-4130.2017.20.012 (  0) 0) |
| [19] |
Oishi T, Narita M, Matsui K, et al. Clinical implications of interleukin-18 levels in pediatric patients with Mycoplasma pneumoniae pneumonia[J]. J Infect Chemother, 2011, 17(6): 803-806. DOI:10.1007/s10156-011-0265-7 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


