毛细支气管炎是一种婴幼儿较常见的下呼吸道感染性疾病,本病好发于2周岁以下婴幼儿,其中患儿2~6月龄时为发病高峰,临床以喘憋、呼吸急促、三凹征为主要表现,可引起暴发流行,小于6月龄患儿和高危儿有较高的病死率[1-2],危害极大。有流行病学研究表明毛细支气管炎住院患儿日后反复喘息与哮喘的发生率分别为68%和30%[3],国内研究报道显示29.1%~40.9%毛细支气管炎会发展为哮喘[4],但其作用机制尚不明确。目前研究认为毛细支气管炎是感染后继发的免疫功能异常性疾病,多种细胞因子参与了毛细支气管炎的发病过程[5],近期研究发现,细胞黏附分子在气道上皮细胞上的正常表达对于保持气道微环境稳态至关重要,具有参与介导气道上皮细胞募集与激活免疫、炎症细胞的功能,是气道上皮反应的一个重要组成部分[6-7],气道上皮细胞间黏附分子-1(ICAM-1)的诱导性表达促进了白细胞与上皮的黏附,是各种肺和气道疾病中炎症及气道高反应等的重要发病机制[8-9]。多项研究表明病毒感染细支气管上皮细胞后继发了多种细胞因子参与的免疫反应,黏附分子参与了炎症的多种免疫应答,有关ICAM-1在毛细支气管炎发病过程中的作用成了研究的热点与重点[10-11],但具体发病机制未完全阐明,本研究旨在通过检测毛细支气管炎患儿外周血、诱导痰液中ICAM-1的表达,探讨ICAM-1在毛细支气管炎发病过程中的作用和意义。
1 资料与方法 1.1 临床资料选取2015年7月至2017年1月在江苏大学附属医院儿科住院的毛细支气管炎患儿67例为研究对象,其中男35例,女32例,年龄最小31 d,最大12个月,平均年龄8.0±4.4个月,具有明显咳嗽、喘憋等主要症状,体查及胸部X线检查符合毛细支气管炎诊断标准[12],同时排除先天性心肺疾病和免疫缺陷患儿。按指南标准[13]分为轻度组(n=22)、中度组(n=24)、重度组(n=21)。经7~14 d治疗后患儿无发热,咳嗽缓解,呼吸平稳,肺部无罗音,视为进入缓解期。收集同期在本院儿童保健科行健康体检的婴幼儿20例作为健康对照组,其中男11例,女9例,年龄最小42 d,最大13个月,平均年龄8.5±5.5个月。纳入本实验的所有儿童采血前1个月均无免疫药物治疗史。本研究已获得江苏大学附属医院医学伦理委员会批准,相关操作已与家属沟通并获得受试者家属知情同意。
1.2 检验方法健康对照组婴幼儿采取体检时免费给予血常规检查及痰液常规检查,经和家属沟通并知情同意后,于体检时直接采集外周血2 mL备用。痰液采集采用喉部轻压刺激法,刺激喉部后用压舌板向后压舌,将拭子伸入咽部,小儿经压舌刺激咳痰时会咳出少量痰液,用拭子尽量刮取痰液备用。
所有毛细支气管炎患儿入院确诊当天(急性期)及进入缓解期2 d后分别采集外周血2 mL备用。取痰液时,入院当天生理盐水口腔护理后,常规翻身、拍背、吸痰,获痰液量至少1.5 mL以上,如患儿痰液较少则予3%NaCl氧驱动雾化吸入10~20 min后重新吸痰。
采集的外周血待其凝固后,3 000 r/min离心5 min,取血清放入Eppendorf管,-70℃冰箱保存待检。参照文献[14]方法,取无唾液成分的痰液放入离心试管中,加2倍体积的0.1%二硫苏糖醇孵育,蜗旋震荡15 s,置于37℃恒温水浴振荡箱振荡15 min;3 500 r/min离心20 min,取上清液于-70℃冻存待测。收集的痰标本在每低倍视野下鳞状上皮细胞数 < 10个,白细胞数 > 25个,且无唾液成分的痰液量 > 1 mL视为合格的痰标本。
采用ELISA法检测各组婴幼儿血清和痰液中ICAM-1水平,实验操作步骤严格按说明书要求进行。ICAM-1 ELISA试剂盒购自武汉默沙克生物技术有限公司,其余所需试剂均为市售常规耗材。
1.3 统计学分析采用SPSS 19.0统计软件对数据进行统计学分析处理。计量资料以均数±标准差(x±s)表示,自身前后比较采用配对t检验;多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。采用Pearson直线相关分析评估血清与诱导痰液中ICAM-1水平的相关性。P < 0.05为差异有统计学意义。
2 结果 2.1 各组血清中ICAM-1水平的表达变化与健康对照组比较,急性期毛细支气管炎轻度组、中度组、重度组血清ICAM-1水平均显著升高(P < 0.01);与轻度组比较,急性期中度组、重度组血清ICAM-1水平均显著升高(P < 0.01);与中度组比较,急性期重度组血清ICAM-1水平显著升高(P < 0.01)。与毛细支气管炎各组患儿急性期比较,恢复期轻、中、重度组患儿血清ICAM-1水平均显著下降(P < 0.01)。恢复期各组间血清ICAM-1水平比较差异无统计学意义(P > 0.05)。见表 1。
| 表 1 各组血清中ICAM-1表达水平比较 |
|
|
与健康对照组比较,急性期毛细支气管炎轻度组、中度组、重度组痰液ICAM-1水平均显著升高(P < 0.01);与轻度组比较,急性期中度组、重度组痰液ICAM-1水平均显著升高(P < 0.01);与中度组比较,急性期重度组痰液ICAM-1水平显著升高(P < 0.01)。与毛细支气管炎各组患儿急性期比较,恢复期轻、中、重度组患儿痰液ICAM-1水平均显著下降(P < 0.01)。恢复期各组间痰液ICAM-1水平比较差异无统计学意义(P > 0.05)。见表 2。
| 表 2 各组诱导痰液中ICAM-1表达水平比较 |
|
|
Pearson直线相关分析显示,急性期毛细支气管炎患儿痰液与血清ICAM-1水平呈正相关(r=0.875,P < 0.001)(图 1);恢复期毛细支气管炎患儿痰液与血清ICAM-1水平无相关性(r=0.05,P=0.647)。
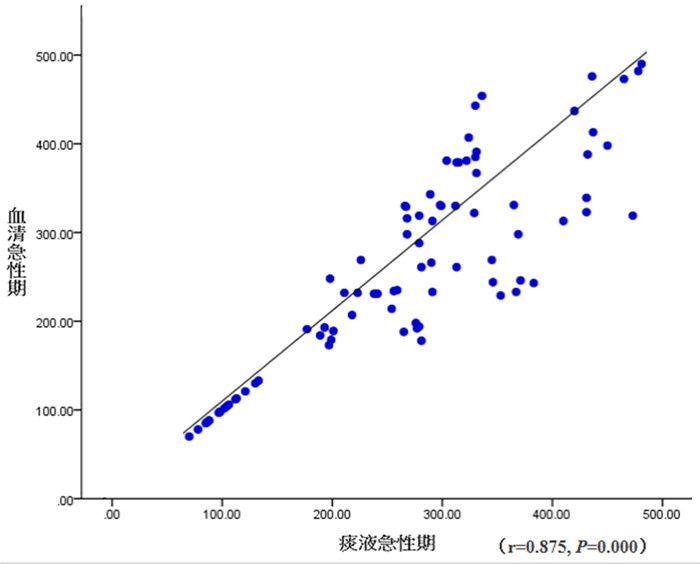
|
图 1 ICAM-1在急性期毛细支气管炎患儿痰液及血清中表达的相关性分析 |
毛细支气管炎的发病因素主要分为外源性因素与内源性因素两大类,其中外源性因素主要是由不同的病毒感染所致,而呼吸道合胞病毒(respiratory syncytial virus, RSV)是引起毛细支气管炎最常见的外源性病原体,占本病发病的70%以上[15]。研究表明,RSV感染可引起气道上皮细胞坏死、脱落,伴随大量的炎症介质释放,启动免疫和病理反应,使气道上皮结构遭到破坏和功能发生缺陷[16]。ICAM-1是免疫球蛋白基因超家族的一个分子成员,是气道上皮反应的一个重要组成部分,ICAM-1是诱导免疫反应和炎症病理机制的基本组分,它可通过与白细胞表面的相应配体如P2整合素家族成员淋巴细胞功能相关抗原-1和巨唾细胞分化抗原-1结合,介导白细胞跨气道上皮迁移至气道腔,参与宿主免疫反应和炎症性气道疾病[17-19]。气道上皮ICAM-1的诱导性表达促进了白细胞与上皮的黏附,是各种肺和气道疾病如哮喘中炎症及气道高反应等的重要发病机制。此外,ICAM-1也具有信号分子的功能,传递胞外至胞内信号,产生大量的生物学效应,如诱导胞内蛋白磷酸化,使蛋白激酶和转录因子活化,从而增加了细胞因子的产生、细胞膜蛋白的表达及氧自由基的生成[20]。在生理状态下ICAM-1表达量很少,但在IL-1、IFN-γ和内毒素等作用下,ICAM-1可广泛表达于淋巴细胞、血管内皮细胞等细胞表面,具有诱导免疫细胞发育和分化、参与免疫反应与调节、促进气道炎症反应等多种生物学作用[5]。ICAM-1在促进炎症部位的黏连性,以及调节机体免疫反应中起重要作用。它通过与其受体的特异性结合,使白细胞、炎症细胞等与内皮细胞间的黏附作用增强,促进内皮细胞活化,使它们更容易穿透内皮。内皮细胞上的ICAM介导细胞与细胞间或细胞与基质间相互接触和结合,从而参与细胞的信号转导与活化、细胞组织生长及分化、免疫应答、炎症反应、血管生成等生理病理过程[20]。对于毛细支气管炎而言,这一变化可能与呼吸道病毒侵入支气管,引起了病理损害,同时也引起气道炎症/免疫反应,使细胞因子分泌增加[21-22],诱导ICAM-1在内皮细胞表面的表达,促使白细胞和血管内皮细胞牢固黏附,激活内皮细胞的表型与功能,导致血管壁通透性增加,使白细胞从血管中侵入到炎症组织部位相关。ICAM-1在增生的血管内皮细胞上表达最强[23],在血清、痰液、支气管肺泡灌洗液中均可被检测到可溶性ICAM-1。
本次研究中ICAM-1在毛细支气管炎急性期患儿血清、诱导痰上清液中表达均有显著升高,且重度组明显高于中度组和轻度组,疾病越重,其表达量越高,而恢复期ICAM-1表达量则明显减少,这表明ICAM-1参与了毛细支气管炎的病理改变,并和疾病严重程度相关。通过将急性期各组ICAM-1在血清中与痰液中的表达进行相关分析,发现ICAM-1在血清和诱导痰液中的表达呈正相关,在临床上,诱导痰液检测对患儿损伤小,易反复检测,且容易被家长接受,更适用于临床。
目前研究认为,毛细支气管炎与哮喘无论在临床表现还是在发病机制等方面具有相似性[24],ICAM-1增加了气道炎症细胞的浸润,同时增强了气道的高反应性,在哮喘的发生发展中起着重要作用[24-25]。Traub等[26]研究证实抗人ICAM-1抗体(14C11)在哮喘急性发作期可减少Th2细胞因子和趋化因子的产生,降低气道炎症细胞浸润,对哮喘急性发作具有防治作用。目前临床上围绕ICAM-1的研究较少[5, 11, 24],诱导痰上清液中表达的研究尚未见报道,本研究初步揭示ICAM-1参与了毛细支气管炎的发病过程,且和病情严重程度相关,ICAM-1的增高可能和毛细支气管炎患儿日后的气道高反应性、反复喘息,甚至哮喘有关,但其明确机理尚需进一步的研究。本次研究发现毛细支气管炎患儿ICAM-1在血清和诱导痰中均明显增高,表明ICAM-1参与了毛细支气管炎的病理改变,早期阻断ICAM-1的表达可能成为治疗毛细支气管炎的一个重要途径,且诱导痰液检测对患儿损伤小,易反复检测,且容易被家长接受,更适用于临床,值得推广应用。
| [1] |
Ralston SL, Lieberthal AS, Meissner HC, et al. Clinical practice guideline:the diagnosis, management, and prevention of bronchiolitis[J]. Pediatrics, 2014, 134(5): e1474-e1502. DOI:10.1542/peds.2014-2742 (  0) 0) |
| [2] |
Schroeder AR, Mansbach JM. Recent evidence on the management of bronchiolitis[J]. Curr Opin Pediatr, 2014, 26(3): 328-333. DOI:10.1097/MOP.0000000000000090 (  0) 0) |
| [3] |
Sigurs N, Bjarnason R, Sigurbergsson F, et al. Respiratory syncytial virus bronchiolitis in infancy is an important risk factor for asthma and allergy at age 7[J]. Am J Respir Crit Care Med, 2000, 161(5): 1501-1507. DOI:10.1164/ajrccm.161.5.9906076 (  0) 0) |
| [4] |
刘雄诚, 李琴丽. 毛细支气管炎发展为支气管哮喘的相关因素分析[J]. 中华妇幼临床医学杂志(电子版), 2016, 12(2): 216-220. (  0) 0) |
| [5] |
邹丽萍, 张松林. 毛细支气管炎患儿ICAM-1和RANTES检测的意义[J]. 中国当代儿科杂志, 2010, 12(3): 181-183. (  0) 0) |
| [6] |
Williamson JD, Sadofsky LR, Crooks MG, et al. Bleomycin increases neutrophil adhesion to human vascular endothelial cells independently of upregulation of ICAM-1 and E-selectin[J]. Exp Lung Res, 2016, 42(8-10): 397-407. DOI:10.1080/01902148.2016.1243742 (  0) 0) |
| [7] |
Yang JX, Pan YY, Ge JH, et al. Tanshinone Ⅱ A attenuates TNF-α-induced expression of VCAM-1 and ICAM-1 in endothelial progenitor cells by blocking activation of NF-κB[J]. Cell Physiol Biochem, 2016, 40(1-2): 195-206. DOI:10.1159/000452537 (  0) 0) |
| [8] |
Kim H, Hwang JS, Woo CH, et al. TNF-alpha-induced up-regulation of intercellular adhesion molecule-1 is regulated by a Rac-ROS-dependent cascade in human airway epithelial cells[J]. Exp Mol Med, 2008, 40(2): 167-175. DOI:10.3858/emm.2008.40.2.167 (  0) 0) |
| [9] |
Benzaquen M, Lebowitz D, Belenotti P, et al. Acute pancreatitis and pneumonia due to Mycoplasma pneumoniae:a case report[J]. BMC Res Notes, 2016, 9: 397. DOI:10.1186/s13104-016-2196-y (  0) 0) |
| [10] |
Williamson PA, Short PM, Vaidyanathan S, et al. Inhaled and systemic corticosteroid response in severe asthma assessed by alveolar nitric oxide:a randomized crossover pilot study of add-on therapy[J]. Br J Clin Pharmacol, 2013, 75(1): 93-102. DOI:10.1111/bcp.2013.75.issue-1 (  0) 0) |
| [11] |
董琳, 李昌崇, 陈小芳, 等. 呼吸道合胞病毒性毛细支气管炎血清sICAM-1检测的意义[J]. 温州医学院学报, 2002, 32(2): 92-93. (  0) 0) |
| [12] |
江载芳. 呼吸系统疾病[M]//胡亚美, 江载芳. 诸福棠实用儿科学. 第7版. 北京: 人民卫生出版社, 2002: 1175-1201.
(  0) 0) |
| [13] |
《中华儿科杂志》编辑委员会, 中华医学会儿科学分会呼吸学组. 毛细支气管炎诊断、治疗与预防专家共识(2014年版)[J]. 中华儿科杂志, 2015, 53(3): 168-171.
(  0) 0) |
| [14] |
Nandan D, Kansal P, Patharia N, et al. Induced sputum nitrite levels correlate with clinical asthma parameters in children aged 7-18 years with mild to moderate persistent asthma[J]. J Lab Physicians, 2016, 8(2): 90-95. DOI:10.4103/0974-2727.180788 (  0) 0) |
| [15] |
白珺, 徐佩茹. 毛细支气管炎的诊治进展[J]. 中国实用儿科杂志, 2009, 24(4): 312-314. (  0) 0) |
| [16] |
Faber TE, Groen H, Welfing M, et al. Specific increase in local IL-17 production during recovery from primary RSV bronchiolitis[J]. J Med Virol, 2012, 84(7): 1084-1088. DOI:10.1002/jmv.v84.7 (  0) 0) |
| [17] |
Humlicek AL, Pang L, Look DC. Modulation of airway inflammation and bacterial clearance by epithelial cell ICAM-1[J]. Am J Physiol Lung Cell Mol Physiol, 2004, 287(3): L598-L607. DOI:10.1152/ajplung.00073.2004 (  0) 0) |
| [18] |
Gong JH, Shin D, Han SY, et al. Kaempferol suppresses eosionphil infiltration and airway inflammation in airway epithelial cells and in mice with allergic asthma[J]. J Nutr, 2012, 142(1): 47-56. DOI:10.3945/jn.111.150748 (  0) 0) |
| [19] |
Springer TA. Adhesion receptors of the immune system[J]. Nature, 1990, 346(6283): 425-434. DOI:10.1038/346425a0 (  0) 0) |
| [20] |
Tang HP, Sun LX, Han W. Endothelial cells on the proliferation and expression of intercellular adhesion molecule 1 and interleukin 8 of vascular smooth muscle cells[J]. Genet Mol Res, 2013, 12(4): 4363-4370. DOI:10.4238/2013.October.10.2 (  0) 0) |
| [21] |
Yen FL, Tsai MH, Yang CM, et al. Curcumin nanoparticles ameliorate ICAM-1 expression in TNF-α-treated lung epithelial cells through p47(phox) and MAPKs/AP-1 pathways[J]. PLoS One, 2013, 8(5): e63845. DOI:10.1371/journal.pone.0063845 (  0) 0) |
| [22] |
Rafiee L, Hajhashemi V, Javanmard SH. Maprotiline inhibits LPS-induced expression of adhesion molecules (ICAM-1 and VCAM-1) in human endothelial cells[J]. Res Pharm Sci, 2016, 11(2): 138-144. (  0) 0) |
| [23] |
Shcheglovitova ON, Skliankina NN, Babaiants AA, et al. Adhesion molecules expressed in vascular endothelial cells in natural immunity against viral infections[J]. Vestn Ross Akad Med Nauk, 2011(10): 54-60. (  0) 0) |
| [24] |
张松林, 邹丽萍. 毛细支气管炎患儿T细胞亚群、ICAM-1和RANTES检测的临床意义[J]. 山东医药, 2009, 49(45): 46-47. DOI:10.3969/j.issn.1002-266X.2009.45.019 (  0) 0) |
| [25] |
Ciebiada M, Gorska-Ciebiada M, Gorski P. sICAM-1 and TNF-α in asthma and rhinitis:relationship with the presence of atopy[J]. J Asthma, 2011, 48(7): 660-666. DOI:10.3109/02770903.2011.604886 (  0) 0) |
| [26] |
Traub S, Nikonova A, Carruthers A, et al. An anti-human ICAM-1 antibody inhibits rhinovirus-induced exacerbations of lung inflammation[J]. PLoS Pathog, 2013, 9(8): e1003520. DOI:10.1371/journal.ppat.1003520 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20

