杆状体肌病是一种少见的先天性肌病,因在患者肌肉纤维中发现大量杆状体结构而得名,由Shy等[1]于1963年首次报道。该病个体间临床表现差异较大,但主要表现为肌无力和肌张力下降。我国目前的十余例报道大多仅通过光镜病理诊断,罕见同时电镜和基因诊断资料齐全的病例报道。随着对杆状体肌病认识的不断提高,发现杆状体不仅见于杆状体肌病,还可见于其他累及肌肉的疾病如线粒体脑肌病、强直性肌营养不良、多发性肌炎及皮肌炎等肌肉组织中[2],故本病不能仅仅通过光镜进行诊断。本文报道二例幼儿期起病,经光镜、电镜检查和基因检测确诊的杆状体肌病患者,总结其临床、组织病理学及遗传学特点,以提高临床医师对本病的认识。
1 资料与方法 1.1 病例介绍例1,女,14岁,因四肢无力10余年就诊。患者2岁3个月时仍不能独走;6岁时家人发现其外表瘦弱,睡觉时眼睑不能完全闭合,下蹲、站立、上楼均费力,不能提重物,不能拧毛巾,文化成绩尚可。患者系第一胎,足月顺产出生,9个月能坐。其爷爷和奶奶为近亲结婚(姑舅亲结婚),父母非近亲婚配,患者父亲有脊柱前凸,睡觉时眼睑闭合不全,无明显肌无力和肌萎缩;母孕期胎动较少。体格检查:身高163 cm,体重41 kg。细长脸,闭目不能完全遮盖巩膜,高腭弓,脊柱侧弯。四肢及躯干肌肉未见明显萎缩,肌张力正常,四肢肌力4级,颈肌肌力2级。无感觉障碍。双侧腱反射对称引出,病理反射未引出。肌酸肌酶、乳酸脱氢酶、肌红蛋白正常,肌酸激酶同工酶26.5 U/L(正常值:< 24 U/L)。肌电图示肌源性损害。
例2,女性,22岁,因双下肢无力20年就诊。患者2岁左右方可独立行走,但上楼费力,下蹲后无法独自起立,跑跳欠佳。19岁时自觉小腿明显变细。病程中无肌肉疼痛及痉挛,无感觉障碍。患者足月顺产出生。出生后抬头、翻身、独坐等发育与同龄儿类似。否认家族史。父母非近亲结婚。体格检查:身高162 cm,体重40 kg。细长脸,高腭弓,舌肌萎缩。四肢及躯干肌肉未见明显萎缩, 肌张力正常,四肢肌力4级,颈肌肌力3级。无感觉障碍。双上肢腱反射正常,双下肢腱反射未引出。病理反射未引出。乳酸脱氢酶、肌酸肌酶、肌酸激酶同工酶、肌红蛋白、补体C3、甲功五项、性激素全套均正常,C12多肿瘤标志物全套均阴性。肌电图示右侧上下肢呈肌源性损害。
1.2 肌肉病理检查及神经肌肉病相关基因测序两例患者的肌活检标本均经开放活检手术的方法获得,活检部位均为左侧肱二头肌。将新鲜的肌活检标本分为两部分,一部分经液氮冷却的异戊烷速冻,制成8 μm冰冻切片,行苏木素-伊红(HE)、改良Gomori三色(MGT)、还原型烟酰胺腺嘌呤二核苷酸(NADH-TR)、琥珀酸脱氢酶(SDH)、细胞色素氧化酶(COX)、单磷酸腺苷脱氨酶染色(AMP)、非特异性酯酶(NSE)、过碘酸希夫(PAS)、油红O(ORO)、腺苷三磷酸环化酶(ATP酶)(pH 4.3、4.5、11.0)及酸性磷酸酶染色,光镜下观察。另一部分标本经固定包埋后,制成超薄切片,置透射电镜下观察。提取患者及其父母的外周血5 mL送北京迈基诺基因科技有限责任公司行神经肌肉病相关基因二代测序。并采用PolyPhen-2及SIFT数据库对新发突变进行功能预测。
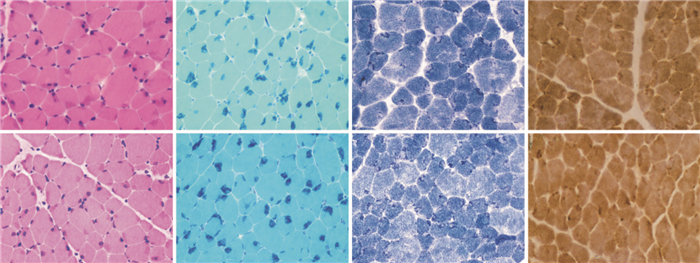
2 结果 2.1 光镜检查HE染色可见肌纤维胞浆内,尤其肌膜下存在大量深红色物质;Gomori染色可见大量肌纤维胞浆内,尤其肌膜下存在大量紫蓝色杆状体;NADH-TR、COX和SDH染色可见杆状体肌纤维内肌原纤维网状结构紊乱。见图 1。ATP酶染色可见1型肌纤维优势,萎缩肌纤维以1型纤维为主,且杆状体主要见于1型肌纤维。酸性磷酸酶染色未见异常。单磷酸腺苷脱氨酶活性未见异常。糖原和脂肪成分均未见异常。
|
图 1 2例患者的肌肉病理光镜检查(×200) HE染色(图A、E)见肌膜下大量深红色物质(箭头所示),Gomori染色(图B、F)见大量紫蓝色杆状体聚集在肌膜下(箭头所示),NADH-TR(图C、G)及COX染色(图D、H)示肌纤维内肌原纤维网状结构紊乱(箭头所示)。 |
电镜下病例1的肌纤维大小不一致,少量萎缩,部分肌纤维灶性溶解,肌纤维肌膜下或核周较多杆状体形成,肌纤维内少量脂滴散在沉积,少量线粒体固缩、致密变,少部分水肿空泡化,部分间质血管腔狭窄,间质未见明显异常。患者2肌纤维体积偏小,肌纤维内线粒体体积小或固缩,部分水肿空泡化,数目增多;部分肌纤维肌丝灶性溶解,坏死,肌丝束稀疏分布,间质血管未见异常。见图 2。

|
图 2 2例患者的肌肉病理电镜检查(×20 000) 病例1可见肌纤维肌膜下大量杆状体(箭头所示),病例2可见部分肌纤维肌丝灶性溶解、坏死(箭头所示)。 |
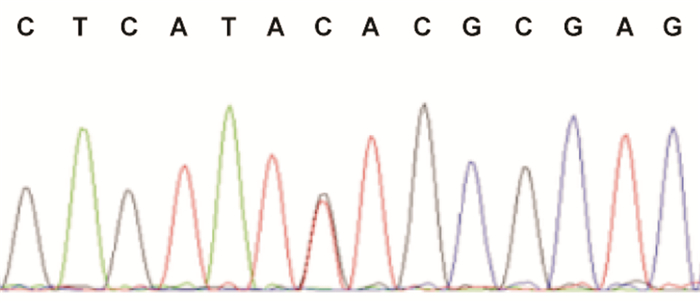
二代测序发现病例1的ACTA1基因存在杂合突变:c.1013A > C,致编码的蛋白肌动蛋白α1第338号氨基酸由赖氨酸变异为苏氨酸;其父母该位点正常。见图 3。病例2在NEB基因发现来自其父母的复合杂合突变:c.18676C > T及c.9812C > A,分别导致p.Q6226X和p.S3271Y氨基酸改变;c.18676C > T为已知致病突变,c.9812C > A尚未见报道。PolyPhen-2及SIFT数据库对新发突变c.9812C > A进行功能预测,PolyPhen-2预测评分1.000、SIFT预测评分0.003,提示该突变可能有害。
|
图 3 病例1的二代测序结果 ACTA1基因存在杂合突变:c.1013A > C,突变位点如箭头所示。 |
杆状体肌病是一种常色体显性或隐性遗传的少见肌病,多为散发。根据1999年欧洲神经肌肉病中心(ENMC)的分型标准[3],杆状体肌病主要分为6型:(1)重度先天性杆状体肌病型,占16.1%,出生时即有严重的肌无力,无法进行自主呼吸,常于出生后数小时死亡,死亡率极高;(2)轻症型,即经典型,占46.1%,婴儿期或儿童期起病,主要以面肌、躯干肌无力,伴肌张力低下,运动发育迟缓,病情相对稳定;(3)中间型(20.3%),较重度先天性杆状体肌病症状稍轻,通常无法独立行走,可以通过呼吸支持维持生命;(4)儿童或青少年起病型(13.3%),患者无面部肌肉无力,无足下垂,少有四肢无力或者肢体无力症状较轻;(5)成人起病型(4.2%),少见,任何成人起病的均属于此类分型;(6)其他类型杆状体肌病。杆状体肌病的临床表现异质性较大,起初表现为肢体肌肉和躯干肌无力,逐渐发展至全身无力,多伴有肌肉萎缩,亦有患者以肢体远端无力起病;患者中枢神经系统通常不受影响,智力正常,疾病后期常死于呼吸衰竭。本文2例患者均为幼儿期起病,首先累及肢体近端,表现为下蹲、起立及上楼费力,后于青少年期逐渐发展至弥漫性全身无力如眼睑闭合无力且四肢及颈肌肌力均下降,但病情相对稳定,属于ENMC分型标准中的轻症型。
杆状体肌病特征性肌肉病理改变为肌细胞胞浆中的杆状体,Gomori染色表现为蓝紫色粗颗粒样或杆状物质沉积,HE染色略红染。杆状体通常出现在胞浆尤其是肌膜下,少数如ACTA1相关杆状体肌病可于肌核中观察到杆状体。杆状体来源于Z盘,主要由α辅肌动蛋白(α-actinin)、肌动蛋白和细微丝组成[4]。与其他先天性肌病一样,杆状体肌病可见肌纤维直径大小不等,1型肌纤维选择性萎缩或发育不良,在肌纤维类型上呈1型肌纤维优势。本文中2例患者在Gomori染色及HE染色肌纤维胞浆内尤其肌膜下见明显的杆状物质沉积,是典型的杆状体肌病病理表现。电镜下杆状体呈短棒状致密结构,与肌纤维长轴平行,与Z盘分布一致[5]。本文中患者1电镜检查可见较多的致密的杆状体位于肌纤维肌膜下,与肌纤维长轴平行,患者2可见肌纤维内线粒体体积小或固缩,部分肌纤维肌丝灶性溶解,坏死。本文患者的电镜检查均为杆状体肌病典型的电镜表现。虽肌肉病理中杆状体的形成是杆状体肌病的特征性表现,但杆状体并非杆状体肌病患者特有,亦可出现在正常眼肌和正常老年人的肌肉组织,以及线粒体脑肌病、强直性肌营养不良、多发性肌炎、皮肌炎及HIV感染等肌肉组织中[2]。
目前已发现的可引起杆状体肌病的基因有十余种,包括ACTA1、TPM3、TPM2和KBTBD13等基因显性突变[6-9],NEB、ACTA1、TPM3、TPM2、TNNT1、CFL2、KLHL40、KLHL41、LMOD3、MYPN和MYO18B等基因隐性突变[10-20]。各基因突变引起的杆状体肌病临床表型无特异性[21]。NEB基因变异是杆状体肌病最常见的原因,该基因共有183个外显子,所编码的伴肌动蛋白为人类肌节中最大的蛋白之一,为细肌丝的重要组成部分。伴肌动蛋白具有高度重复序列结构,该重复序列结构有利于结合肌动蛋白。目前已发现100多个NEB突变,均呈常染色体隐性遗传且多为复合杂合突变。本研究病例2的NEB基因存在分别来自于其父母的c.18676C > T及c.9812C > A复合杂合突变,可导致氨基酸改变:p.Q6226X和p.S3271Y,其中c.18676C > T为已知致病突变,c.9812C > A未见报道。PolyPhen-2及SIFT数据库对新发突变c.9812C > A的功能预测提示该突变可能有害。ACTA1为杆状体肌病第二常见致病基因,也是目前唯一已知与核内杆状体相关的基因。ACTA1编码骨骼肌α-肌动蛋白,该蛋白可存在于1型和2型肌纤维中,约有15%~25%的杆状体肌病患者由ACTA1基因突变致病[22]。目前已发现200余种ACTA1突变,主要为错义突变,多为常染色体隐性遗传遗传,少数为常染色体显性遗传。本文病例1的ACTA1基因存在1个杂合突变:c.1013A > C,致编码蛋白肌动蛋白α第338号氨基酸由赖氨酸变异为苏氨酸。
杆状体肌病患者与其它肌病相比并无特殊临床表现与体征,常见的鉴别诊断包括多发性肌炎,皮肌炎,强直性肌营养不良,先天性肌强直,线粒体脑肌病等疾病。多发性肌炎和皮肌炎的肌酶显著增高,增高程度达数十倍以上,肌肉活检可见明显炎性细胞浸润,皮肌炎则伴有明显的皮损,使用激素治疗效果显著[23]。本研究两例患者的肌酶正常,肌肉病理中炎性细胞浸润较少,与炎症性肌病不符。强直性肌营养不良为成人最常见的先天性肌病,多为成人期起病[24],本研究病例均于幼儿期起病。先天性肌强直于幼儿期起病,肌肉收缩后可出现明显肌肉强直,肌电图可见肌强直样电位、插入电位延长、扬声器出现轰炸机俯冲般或蛙鸣样特征性声响[25]。而本文两例患者肌电图仅提示肌源性损害。线粒体脑肌病是一组线粒体结构和功能异常所致的以脑和肌肉受累为主的多系统疾病,临床表现以肌肉无力为主,运动后乳酸特征性升高[26]。杆状体肌病患者如本文中2例并无运动后乳酸增高等特征。临床对于有肌无力症状的患者,如能排除神经肌肉接头肌病如重症肌无力,考虑定位诊断位于肌肉时,因绝大部分肌病患者缺乏特征性临床表现,应选择合适的部位进行肌肉活检。杆状体肌病诊断的关键在于肌肉病理观察到大量的肌纤维出现成堆的杆状体时进行杆状体肌病相关基因如NEB,ACTA1,TPM3,TPM2,KBTBD13,TNNT1,CFL2,KBTBD13,KLHL40,KLHL41,LMOD3,MYPN和MYO18B等检测。本病尚无有效治疗方法,有研究[27]报道,采用马法兰或者免疫抑制剂如环磷酰胺和甲基强的松治疗能改善部分病人的临床症状,但尚未经过大规模试验。
综上所述,对于幼儿期起病且病程较长的肌无力患者,需考虑肌肉疾病尤其是先天性肌病可能,除了行常规的肌肉病理检查,还需根据肌肉病理结果,视情况行基因检测以明确诊断,并为优生优育做指导。病理检查和基因检测仍是诊断本病的金指标。
| [1] |
Shy GM, Engel WK, Somers JE, et al. Nemaline myopathy.A new congenital myopathy[J]. Brain, 1963, 86(4): 793-810. DOI:10.1093/brain/86.4.793 (  0) 0) |
| [2] |
Schnitzler LJ, Schreckenbach T, Nadaj-Pakleza A, et al. Sporadic late-onset nemaline myopathy:clinico-pathological characteristics and review of 76 cases[J]. Orphanet J Rare Dis, 2017, 12(1): 86. DOI:10.1186/s13023-017-0640-2 (  0) 0) |
| [3] |
Wallgren-Pettersson C, Laing NG. Report of the 70th ENMC International Workshop:nemaline myopathy, 11-13 June 1999, Naarden, The Netherlands[J]. Neuromuscul Disord, 2000, 10(4-5): 299-306. DOI:10.1016/S0960-8966(99)00129-7 (  0) 0) |
| [4] |
Monforte M, Primiano G, Silvestri G, et al. Sporadic late-onset nemaline myopathy:clinical, pathology and imaging findings in a single center cohort[J]. J Neurol, 2018, 265(3): 542-551. DOI:10.1007/s00415-018-8741-y (  0) 0) |
| [5] |
Lee JM, Lim JG, Shin JH, et al. Clinical and genetic diversity of nemaline myopathy from a single neuromuscular center in Korea[J]. J Neurol Sci, 2017, 383: 61-68. DOI:10.1016/j.jns.2017.10.020 (  0) 0) |
| [6] |
Joureau B, de Winter JM, Conijn S, et al. Dysfunctional sarcomere contractility contributes to muscle weakness in ACTA1-related nemaline myopathy (NEM3)[J]. Ann Neurol, 2018, 83(2): 269-282. DOI:10.1002/ana.25144 (  0) 0) |
| [7] |
Malfatti E, Schaeffer U, Chapon F, et al. Combined cap disease and nemaline myopathy in the same patient caused by an autosomal dominant mutation in the TPM3 gene[J]. Neuromuscul Disord, 2013, 23(12): 992-997. DOI:10.1016/j.nmd.2013.07.003 (  0) 0) |
| [8] |
Mroczek M, Kabzinska D, Chrzanowska KH, et al. A novel TPM2 gene splice-site mutation causes severe congenital myopathy with arthrogryposis and dysmorphic features[J]. J Appl Genet, 2017, 58(2): 199-203. DOI:10.1007/s13353-016-0368-z (  0) 0) |
| [9] |
Jungbluth H, Voermans NC. Congenital myopathies:not only a paediatric topic[J]. Curr Opin Neurol, 2016, 29(5): 642-650. DOI:10.1097/WCO.0000000000000372 (  0) 0) |
| [10] |
Park YE, Shin JH, Kang B, et al. NEB-related core-rod myopathy with distinct clinical and pathological features[J]. Muscle Nerve, 2016, 53(3): 479-484. DOI:10.1002/mus.v53.3 (  0) 0) |
| [11] |
Laing NG, Dye DE, Wallgren-Pettersson C, et al. Mutations and polymorphisms of the skeletal muscle alpha-actin gene (ACTA1)[J]. Hum Mutat, 2009, 30(9): 1267-1277. DOI:10.1002/humu.v30:9 (  0) 0) |
| [12] |
Lehtokari VL, Pelin K, Donner K, et al. Identification of a founder mutation in TPM3 in nemaline myopathy patients of Turkish origin[J]. Eur J Hum Genet, 2008, 16(9): 1055-1061. DOI:10.1038/ejhg.2008.60 (  0) 0) |
| [13] |
Monnier N, Lunardi J, Marty I, et al. Absence of betatropomyosin is a new cause of Escobar syndrome associated with nemaline myopathy[J]. Neuromuscul Disord, 2009, 19(2): 118-123. DOI:10.1016/j.nmd.2008.11.009 (  0) 0) |
| [14] |
Amarasinghe C, Hossain MM, Jin JP. Functional basis of three new recessive mutations of slow skeletal muscle troponin T found in non-Amish TNNT1 nemaline myopathies[J]. Biochemistry, 2016, 55(32): 4560-4567. DOI:10.1021/acs.biochem.6b00577 (  0) 0) |
| [15] |
Ockeloen CW, Gilhuis HJ, Pfundt R, et al. Congenital myopathy caused by a novel missense mutation in the CFL2 gene[J]. Neuromuscul Disord, 2012, 22(7): 632-639. DOI:10.1016/j.nmd.2012.03.008 (  0) 0) |
| [16] |
Seferian AM, Malfatti E, Bosson C, et al. Mild clinical presentation in KLHL40-related nemaline myopathy (NEM 8)[J]. Neuromuscul Disord, 2016, 26(10): 712-716. DOI:10.1016/j.nmd.2016.07.011 (  0) 0) |
| [17] |
Gupta VA, Ravenscroft G, Shaheen R, et al. Identification of KLHL41 mutations implicates BTB-Kelch-mediated ubiquitination as an alternate pathway to myofibrillar disruption in nemaline myopathy[J]. Am J Hum Genet, 2013, 93(6): 1108-1117. DOI:10.1016/j.ajhg.2013.10.020 (  0) 0) |
| [18] |
Yuen M, Sandaradura SA, Dowling JJ, et al. Leiomodin-3 dysfunction results in thin filament disorganization and nemaline myopathy[J]. J Clin Invest, 2015, 125(1): 456-457. DOI:10.1172/JCI80057 (  0) 0) |
| [19] |
Lornage X, Malfatti E, Cheraud C, et al. Recessive MYPN mutations cause cap myopathy with occasional nemaline rods[J]. Ann Neurol, 2017, 81(3): 467-473. DOI:10.1002/ana.v81.3 (  0) 0) |
| [20] |
Malfatti E, Bohm J, Lacene E, et al. A premature stop codon in MYO18B is associated with severe nemaline myopathy with cardiomyopathy[J]. J Neuromuscul Dis, 2015, 2(3): 219-227. DOI:10.3233/JND-150085 (  0) 0) |
| [21] |
Jungbluth H, Treves S, Zorzato F, et al. Congenital myopathies:disorders of excitation-contraction coupling and muscle contraction[J]. Nat Rev Neurol, 2018, 14(3): 151-167. DOI:10.1038/nrneurol.2017.191 (  0) 0) |
| [22] |
Agrawal PB, Strickland CD, Midgett C, et al. Heterogeneity of nemaline myopathy cases with skeletal muscle alpha-actin gene mutations[J]. Ann Neurol, 2004, 56(1): 86-96. DOI:10.1002/(ISSN)1531-8249 (  0) 0) |
| [23] |
Findlay AR, Goyal NA, Mozaffar T. An overview of polymyositis and dermatomyositis[J]. Muscle Nerve, 2015, 51(5): 638-656. DOI:10.1002/mus.24566 (  0) 0) |
| [24] |
Turner C, Hilton-Jones D. Myotonic dystrophy:diagnosis, management and new therapies[J]. Curr Opin Neurol, 2014, 27(5): 599-606. DOI:10.1097/WCO.0000000000000128 (  0) 0) |
| [25] |
Shah DU, Darras BT, Markowitz JA, et al. The spectrum of myotonic and myopathic disorders in a pediatric electromyography laboratory over 12 years[J]. Pediatr Neurol, 2012, 47(2): 97-100. DOI:10.1016/j.pediatrneurol.2012.05.003 (  0) 0) |
| [26] |
Scarpelli M, Todeschini A, Volonghi I, et al. Mitochondrial diseases:advances and issues[J]. Appl Clin Genet, 2017, 10: 21-26. DOI:10.2147/TACG (  0) 0) |
| [27] |
Voermans NC, Benveniste O, Minnema MC, et al. Sporadic late-onset nemaline myopathy with MGUS:long-term followup after melphalan and SCT[J]. Neurology, 2014, 83(23): 2133-2139. DOI:10.1212/WNL.0000000000001047 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


