骨髓增生异常综合征(myelodysplastic syndrome, MDS)是一组起源于造血干细胞的获得性克隆性疾患。临床特征是外周血细胞减少、骨髓一系或多系造血细胞发育异常,且向急性髓系白血病(acute myeloid leukemia, AML)转变的风险高[1-4]。寻找MDS血细胞发育异常的证据,除借助细胞形态学,还可结合流式细胞术行免疫表型分析。尤其当MDS缺乏特征性形态学和/或细胞遗传学依据时,流式细胞学检测的意义更加突出。儿童与成人MDS无论在病因、发病机制、临床表现,还是治疗及预后方面均有一定差异。目前关于多参数流式细胞术(multiparameter flow cytometry, MFC)及流式细胞术积分系统(flow cytometric scoring system, FCSS)在儿童MDS应用的研究较少,为明确其在儿童MDS诊断和预后评估中的作用,本研究对进行了MFC检测和FCSS评分的儿童初诊MDS患者的临床资料进行回顾性分析。
1 资料与方法 1.1 研究对象以中国医学科学院北京协和医学院血液病医院儿童血液病诊疗中心2014年5月至2017年5月期间诊治的42例儿童MDS初诊患者为研究对象。MDS诊断及分型依据2015年儿童骨髓增生异常综合征诊断与治疗中国专家共识[5],必须具有第1~4条中的至少2条,并满足第5条。①外周血细胞一系或一系以上不同程度持续下降3个月以上且原因不明;②至少两系骨髓细胞发育和形态异常;③出现特征性克隆性染色体核型异常;④外周血和/或骨髓原始细胞异常增多;⑤除外其他可导致血细胞减少和发育异常的疾患。纳入标准:①发病年龄0~14岁;②初诊时具有完整的骨髓细胞形态学及流式细胞学检测结果;③确诊前未接受免疫抑制治疗。排除标准:①具有先天性骨髓衰竭的体征和/或实验室检查结果;②既往有化疗药物使用史或/和放射线接触史;③继发于自身免疫疾病、感染等的血细胞减少。
42例患者中难治性血细胞减少症(refractory cytopenia of childhood, RCC)27例(64%),难治性贫血伴原始细胞增多(refractory anemia with excess blasts, RAEB)10例(24%),转化中RAEB(RAEB in transformation, RAEB-t)5例(12%)。42例中男23例、女19例,男女比例为1.3 : 1;中位年龄5.5(1~14)岁;中位中性粒细胞水平1.07(0.13~14.68)×109/L,中位血红蛋白水平85.5(42~130)g/L,中位血小板水平38(6~528)×109/L,中位红细胞体积94.6(81.3~114.9)fl。
1.2 MFC分析采用的单克隆抗体及相应标记的荧光素见表 1,主要为Becton Dickinson、Beckman Coulter、Biolegend/Dako三个公司产品。采用Becton Dickinson的Ootilyse溶解红细胞。多参数流式细胞仪采用Becton Dickinson公司的FACSCantoⅡ,数据分析采用FACSDiVa Version6.1.3软件。
| 表 1 单克隆抗体组合 |
|
|
目前尚没有建立独立的儿童MDS预后评估系统,本研究将FCSS评分试用于42例患者的预后分组,并与国际预后积分系统(International Prognostic Scoring System, IPSS)和修订国际预后积分系统(revised IPSS, IPSS-R)危险分组进行了比较。根据文献[6] FCSS评价标准见表 2,积分0~1分为低危,2~3分为中危;≥4分为高危。根据文献[7]IPSS评价标准见表 3,0分为低危组,0.5~1.0分为中危-1组,1.5~2.0分为中危-2组,≥2.5分为高危组。根据文献[8] IPSS-R评价标准见表 4,≤1.5分为极低危组,> 1.5~3分为低危组,> 3~4.5分为中危组,> 4.5~6分为高危组,> 6分为极高危组。
| 表 2 流式细胞术积分系统 |
|
|
| 表 3 国际预后积分系统 |
|
|
| 表 4 修订国际预后积分系统 |
|
|
生存情况随访方式主要为电话随访,随访终点为患者死亡或2018年4月20日。总体生存率定义为自诊断至死亡或末次随访日期的生存率。将转化为急性白血病定义为事件。
1.5 统计学分析采用SPSS 19.0进行数据处理。非正态分布计量资料采用中位数范围表示,多组间比较采用Kruskal-Wallis H检验。生存分析采用Kaplan-Meier法估算,其组间比较采用Log-Rank检验。变量相关性分析采用Spearman-Rank分析。P < 0.05为差异有统计学意义。
2 结果 2.1 MFC检测到的MDS异常免疫表型结果42例MDS患者中9例(21%)未发现免疫表型异常,其中RCC8例、RAEB1例。33例(79%)均有至少一种免疫表型异常:异常髓系原始细胞增多者共20例(48%),淋系/髓系比大于1者共19例(45%),淋系抗原在髓系细胞异常跨系表达者14例(33%),CD13/CD16分化抗原异常者8例(19%),CD56异常表达者5例(12%),粒系SSC减弱者3例(7%),有核红细胞CD36表达减弱者3例(7%),有核红细胞CD71表达减弱者2例(5%),粒系CD33表达缺失、粒系CD11b表达缺失、单核细胞表达CD56、单核细胞CD14表达缺失者各1例(2%)。其中RCC患者最常见的异常为淋系/髓系比大于1,RAEB和RAEB-t最多见的免疫表型异常则均为粒系跨系表达淋系抗原。见表 5。
| 表 5 MFC检测到的异常免疫表型[例(%)] |
|
|
FCSS评分低危组、中危组、高危组分别23例、4例、15例,中位随访28(5~47)个月。3例(7%)失访:低危组2例、高危组1例。随访的39例患者中死亡7例(1例为低危组RAEB,2例为中危组RCC,2例为高危组的RAEB-t,1例为高危组RCC,1例为高危组RAEB)。低危组随访的21例中5例(4例RCC、1例RAEB)因输血依赖行异基因造血干细胞移植(allo-HSCT);15例(14例RCC、1例RAEB)患者口服雄激素、免疫抑制剂等药物治疗;1例RAEB患者转化为AML,保守治疗无效后死亡。中危组4例RCC患者中1例因输血依赖接受化疗,后因脑出血死亡;1例进展为AML接受化疗,后因重度感染死亡;1例因输血依赖接受allo-HSCT;1例长期口服药物治疗。高危组随访的14例患者中3例(2例RAEB-t、1例RAEB)因进展为AML接受化疗,其中2例RAEB-t患者死亡;4例(3例RAEB-t、1例RCC)因进展为AML行allo-HSCT;5例(4例RAEB、1例RCC)因输血依赖行allo-HSCT;2例(RAEB、RCC各1例)接受口服药物治疗,分别死于脑出血、消化道出血。FCSS低危组、中危组、高危组总体生存时间分别为36.0(21.0~47.0)月、25.5(14.0~28.0)月、22.5(7.0~45.0)月,无事件生存时间分别为36.0(21.0~47.0)月、24.5(14.0~26.0)月、10.5(3.0~32.0)月,差异均有统计学意义(H=12.27、13.88,P < 0.05)。FCSS低危组、中危组、高危组3个组的2年总体生存率以低危组最高,中危组与高危组间的差异无统计学意义(χ2=7.36,P=0.813);3个组的2年无事件生存率依次95%、60%、46%,差异有统计学(χ2=12.72,P < 0.05)。见图 1、图 2。
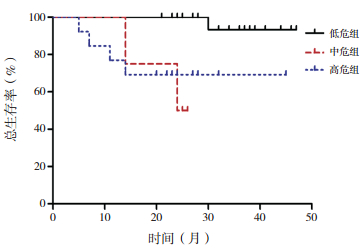
|
图 1 根据FCSS评分的各危险组总体生存率的比较[FCSS]流式细胞术积分系统。 |
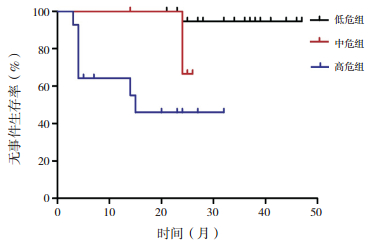
|
图 2 根据FCSS评分的各危险组无事件生存率的比较 [FCSS]流式细胞术积分系统。 |
27例RCC患者的中位FCSS评分为1.0分,10例RAEB的中位FCSS评分为5.0分,5例RAEB-t的中位FCSS评分为6.0分。随着疾病的发展,患者FCSS评分逐渐升高,FCSS评分与儿童MDS进展呈正相关(rs=0.674,P < 0.05)。见图 3。
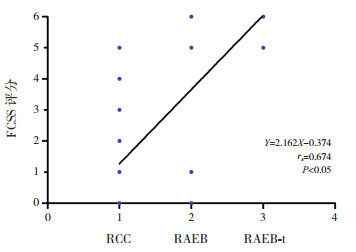
|
图 3 FCSS评分与儿童MDS分型之间的相关性 [FCSS]流式细胞术积分系统;[RCC]难治性血细胞减少症;[RAEB]难治性贫血伴原始细胞增多;[RAEB-t]转化中RAEB。 |
IPSS分组级别越高,其FCSS值越高,IPSS分组级别与FCSS预后积分具有高度相关性(rs=0.604,P < 0.05),见图 4。
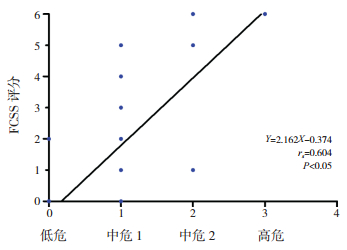
|
图 4 FCSS评分与IPSS预后分组之间的相关性 [FCSS]流式细胞术积分系统;[IPSS]国际预后积分系统。 |
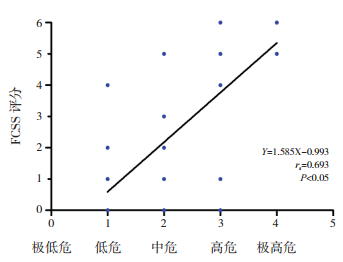
IPSS-R危险分组的级别升高,其FCSS值亦逐渐升高,IPSS-R分级与FCSS预后积分具有相关性(rs=0.693,P < 0.05)。见图 5。
|
图 5 FCSS评分与IPSS-R预后分组之间的相关性 [FCSS]流式细胞术积分系统;[IPSS-R]修订国际预后积分系统。 |
目前对MDS患者幼稚细胞群的研究主要集中在免疫表型异常的CD34+髓系原始细胞,包括CD38表达强度减弱、异常表达晚期阶段抗原、跨系表达淋系抗原以及CD34+幼稚细胞比例增加[6, 9]。但不推荐用MFC对MDS的原始细胞进行计数[5, 10]。MDS的髓系异常主要表现为粒细胞成熟障碍,其流式细胞学的相应表现为粒系的SSC和前散射角(forward scatter, FSC)异常、CD45表达强度改变以及早晚期分化抗原混杂表达。此外,还包括淋系抗原的跨系列表达,比如CD7、CD19、CD56[11]。本研究患儿的免疫表型异常与成人相似,45%的淋系/髓系比 > 1,这可能与大多数儿童MDS患者尤其是RCC患儿的骨髓增生程度减低有关[10]。本研究异常髓系原始细胞增多者共20例,淋系抗原跨系表达者14例,CD33表达减弱者1例,幼稚细胞群的特点与文献相符;但未检测到CD38表达减弱,可能与样本量较小有关。MDS患者单核细胞免疫表型异常的发生率相对较低,本文42例患者仅检测到2例单核细胞异常:1例表达CD56,1例CD14表达缺失。需要注意的是细胞免疫表型异常并非MDS患者所特有,但MDS的免疫表型异常累及两个以上细胞群体,并出现跨系列和/或跨阶段表达。成熟细胞群的次要免疫表型异常对MDS诊断不具特异性[12-13]。
国际联盟和ELN(European LeukemiaNet Working Group)MDS流式工作组提出红系的免疫表型异常包括以下四种:CD117+红系祖细胞比例增加、CD36、CD71抗原表达减低、CD71/CD235分化抗原表达规律异常[11]。2013年提出的Red-score是评估红系免疫表型异常的重要参考,结合Ogata评分,其灵敏度和特异度为87.9%和88.9%[14]。但国际联盟和ELN MDS流式工作组提出Ogata评分不适用于骨髓增生减低和/或儿童MDS[11]。而RED-score采用全髓细胞标本制备法,国内多采用溶解红细胞法。本研究采用MFC对42例MDS患者进行检测,有核红细胞CD36表达减弱者仅7%、CD71表达减弱者5%,而细胞形态学提示红系存在明确病态造血者占31%。因此采用MFC对红系免疫表型异常进行评定仍是难点。
有研究[15]报道,以FCSS积分≥2分作为MDS诊断标准时,敏感性为75%、特异性可达100%。但本研究42例儿童MDS中FCSS积分≥2分者仅19例。因此FCSS在儿童MDS的诊断界值仍需进一步研究。
FCSS是基于细胞表面抗原的一种预后评分系统,本研究中根据FCSS评分各危险组的总体生存时间及无事件生存时间的差异均有统计学意义,IPSS-R、IPSS的分组级别与FCSS评分成正相关,提示三者在MDS预后评估方面具有一致性。因此初步认为FCSS可以辅助评估儿童MDS患者的预后,但由于患者治疗方式不同、随访时间偏短等干扰,FCSS在儿童MDS预后评估中的应用仍需进一步观察。综上所述,免疫表型异常已被列为MDS的次要诊断标准,流式细胞检测术是判断免疫表型异常的重要辅助检查,可为儿童MDS的诊断和预后评估提供重要信息。
| [1] |
肖志坚. 骨髓增生异常综合征的精确诊断[J]. 中华血液学杂志, 2015, 36(05): 361-362. (  0) 0) |
| [2] |
Haslel H, Niemeyer CM. Advances in the prognostication and management of advanced MDS in children[J]. Br J Haemato1, 2011, 154(2): 185-195. DOI:10.1111/j.1365-2141.2011.08724.x (  0) 0) |
| [3] |
Glaubach T, Robinson LJ, Corey SJ. Pediatric myelodysplastic syndromes, they do exist![J]. J Pediatr Hematol Oncol, 2014, 36(1): 1-7. DOI:10.1097/MPH.0000000000000046 (  0) 0) |
| [4] |
Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J]. Blood, 2016, 127(20): 2391-2405. DOI:10.1182/blood-2016-03-643544 (  0) 0) |
| [5] |
中华医学会儿科学分会血液学组, 中华儿科杂志编辑委员会. 儿童骨髓增生异常综合征诊断与治疗中国专家共识(2015年版)[J]. 中华儿科杂志, 2015, 53(11): 804-809. DOI:10.3760/cma.j.issn.0578-1310.2015.11.002 (  0) 0) |
| [6] |
Wells DA, Benesch M, Loken MR, et al. Myeloid and monocytic dyspoiesis as determined by flow cytometric scoring in meylodysplastic syndrome correlates with the IPSS and with outcome after hematopoietic stem cell transplantation[J]. Blood, 2003, 102(1): 394-403. DOI:10.1182/blood-2002-09-2768 (  0) 0) |
| [7] |
Greenberg P, Cox C, LeBeau MM, et al. International scoring system for evaluating prognosis in myelodysplastic syndromes[J]. Blood, 1998, 91(3): 1100. (  0) 0) |
| [8] |
Geenberg PL, Tuechler H, Schanz J, et al. Revised international prognostic scoring system for myelodysplastic syndromes[J]. Blood, 2012, 120(12): 2454-2465. DOI:10.1182/blood-2012-03-420489 (  0) 0) |
| [9] |
Ogata K, Della Porta MG, Malcovati L, et al. Diagnostic utility of flow cytometry in low-grade myelodysplastic syndromes:A prospective validation study[J]. Haematologica, 2009, 94(8): 1066-1074. DOI:10.3324/haematol.2009.008532 (  0) 0) |
| [10] |
Baumann I, Niemeyer CM, Bennett JM, et al.Childhood myelodysplastic syndrome[M].//Steven H, Elias C, Nancy LH.WHO classification of tumors of haematopoietic and lymphoid tissues.4th ed.WHO Publications Center, 2008: 104-107.
(  0) 0) |
| [11] |
Porwit A, van de Loosdrecht AA, Bettelheim P, et al. Revisiting guidelines for integration of flow cytometry results in the WHO classification of myelodysplastic syndromes-proposal from the International/European LeukemiaNet Working Group for flow cytometry in MDS[J]. Leukemia, 2014, 28(9): 1793-1798. DOI:10.1038/leu.2014.191 (  0) 0) |
| [12] |
Craig FE, Foon KA. Flow cytometric immunophenotyping for hematologic neoplasms[J]. Blood, 2008, 111(8): 3941-3967. DOI:10.1182/blood-2007-11-120535 (  0) 0) |
| [13] |
Maynadié M, Picard F, Husson B, et al. 1mmunophenotypic clustering of myelodysplastic syndromes[J]. Blood, 2002, 100(7): 2349-2356. DOI:10.1182/blood-2002-01-0230 (  0) 0) |
| [14] |
Mathis S, Chapuis N, Debord C, et al. Flow cytometric detection of dyserythropoiesis:a sensitive and powerful diagnostic tool for myelodysplastic syndromes[J]. Leukemia, 2013, 27(10): 1981-1987. DOI:10.1038/leu.2013.178 (  0) 0) |
| [15] |
Chu SC, Wang TF, Li CC, et al. Flow cytometric scoring system as a diagnostic and prognostic tool in myelodysplastic syndromes[J]. Leuk Res, 2011, 35(7): 868-873. DOI:10.1016/j.leukres.2011.02.016 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


