新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis, NEC)是新生儿时期比较常见的消化系统危重症,严重者可出现呼吸循环衰竭、休克、DIC、消化道穿孔等重要脏器受累,甚至危及生命[1]。Niemarkt等[1]及Houben等[2]报道NEC的病死率高达15%~30%。NEC的发生受诸多因素影响,如早产儿肠道未成熟、严重细菌感染、缺血缺氧、肠道菌群失调,甚至出生后的母婴分离。在早产儿营养和喂养策略不断完善的今天,新生儿晚发性严重感染明显多于早发性感染,细菌感染已经成为NEC关注的重点[3-4],故探讨C-反应蛋白(C-reactive protein, CRP)、降钙素原(procalcitonin, PCT)及其他感染指标在NEC的变化有重要临床意义。夏仁鹏等[5]对206例胃肠穿孔新生儿研究发现,部分胃肠穿孔患儿静脉血CRP、PCT可在短时间内迅速升高,部分伴血小板(PLT)减少、白细胞(WBC)升高或下降以及贫血、凝血功能障碍,提示CRP、PCT及其他感染指标可能与消化道穿孔有关。Zhang等[6]的多中心随机对照研究显示,NEC患儿肠狭窄时CRP、PCT、WBC、血小板比积明显高于肠狭窄恢复期(P < 0.05)。意大利Duci等[7]单中心随机对照研究选取NEC保守治疗患儿(102例)及手术患儿(53例),单变量及多变量回归分析显示CRP增高是NEC患儿需要手术治疗的高危因素。目前国内尚无探讨NEC Bell分期中各期及不同治疗时期CRP、PCT及其他感染指标水平变化的研究。本研究对142例NEC患儿根据修正Bell分期分为Ⅰ、Ⅱ、Ⅲ期组,通过比较不同Bell分期、手术或非手术的NEC患儿治疗前、治疗后次日、恢复期等不同病期的CRP、PCT等指标变化,采用受试者工作曲线(receiver operating characteristic curve, ROC曲线)进一步分析CRP、PCT等对Ⅲ期NEC发生及是否需手术治疗的预测价值以及最佳cut-off值,探讨CRP、PCT等感染指标与重症NEC的关系。
1 资料与方法 1.1 研究对象选取2015年7月至2018年4月,在安徽医科大学第一附属医院新生儿科住院并诊断为NEC的142例患儿为研究对象。根据修正Bell评分标准[8]进行分期,Ⅰ期40例,其中男25例、女15例;Ⅱ期72例,男40例、女32例;Ⅲ期30例,男18例、女12例。NEC诊断参照《实用新生儿学》 (4版)有关标准[8]。排除标准:①合并其他感染性疾病的新生儿。②放弃治疗、自动出院或死亡的患儿。③外院诊断NEC后转入的新生儿。142例中手术治疗的18例均为Ⅲ期;保守治疗的124例中Ⅲ期12例,其余均为Ⅰ和Ⅱ期。根据文献[6-8],起病时日龄指患儿出现腹胀、呕吐、血便、腹泻任一症状时的日龄;恢复期指NEC好转,并达全肠内营养。起病时体重为确诊当天采用上海光正医疗仪器有限公司DY-1电子婴儿秤称重。Ⅰ、Ⅱ、Ⅲ期3组患儿在起病时日龄、出生胎龄、出生体重、起病时体重、娩出方式及性别构成比等方面的差异均无统计学意义(P > 0.05),见表 1。所有NEC患儿均予以美罗培南或头孢哌酮钠舒巴坦、甲硝唑联合氟康唑抗感染,辅以禁食、机械通气、静脉滴注丙种球蛋白或血浆、多巴胺或多巴酚丁胺改善循环、碱化血液、静脉营养补液等处理。记录各组机械通气、重要脏器受累及转归情况。
| 表 1 3组患儿一般资料比较 |
|
|
各组分别于治疗前、治疗后次日及恢复期抽取外周静脉血(促凝管2 mL、EDTA抗凝血2 mL),应用美国强生公司Vitros-5600全自动生化免疫分析仪检测CRP,应用美国梅里埃公司mini-VIDAS-1210全自动免疫荧光酶标仪检测PCT。
1.3 统计学分析采用SPSS 19.0软件进行数据处理。正态分布的计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验。非正态分布计量资料采用中位数四分位数[P50(P25,P75)]表示,多组间比较采用Kruskal-Wallis H检验;两两比较采用Nemenyi法检验。计数资料采用率表示,多组间比较采用卡方检验,组间两两比较采用卡方分割检验。并进行ROC曲线分析等。P < 0.05表示差异有统计学意义。
2 结果 2.1 不同Bell分期及治疗时段的坏死性小肠结肠炎患儿血清CRP、PCT水平变化Ⅲ期组治疗前、治疗后次日、恢复期的CRP均高于同一治疗时段的Ⅰ、Ⅱ期组,恢复期CRP较治疗前和治疗后次日降低,但治疗后次日的较治疗前升高,差异均有统计学意义(P < 0.05);Ⅱ期组恢复期的CRP低于治疗前和治疗后次日(P < 0.05),治疗前的CRP高于治疗同阶段的Ⅰ期组(P < 0.05),但治疗后次日的CRP较治疗前升高(P < 0.05)。Ⅲ期组恢复期的PCT低于治疗前和治疗后次日,而治疗后次日的PCT高于治疗前和治疗同阶段的Ⅰ、Ⅱ期组,治疗前的PCT高于治疗同阶段的Ⅰ期组;Ⅱ期组恢复期的PCT低于治疗前和治疗后次日,治疗前的PCT高于治疗同阶段的Ⅰ期组,差异均有统计学意义(P < 0.05)。见表 2。
| 表 2 不同Bell分期及治疗时段的坏死性小肠结肠炎患儿血清CRP、PCT水平变化[P50(P25,P75)] |
|
|
Ⅲ期组的呼吸衰竭发生率和机械通气使用率高于Ⅰ、Ⅱ期组(P < 0.05),Ⅲ期组的脓毒症发生率高于Ⅱ期组(P < 0.05);仅Ⅲ期患儿发生消化道穿孔(10例)和肠狭窄(8例),均行手术治疗,其中13例(43%)行肠造瘘术,5例(17%)行肠吻合术。见表 3。13例肠造瘘术患儿于3~6个月后行肠还纳术,142例NEC患儿随访1~2年生长发育基本正常。
| 表 3 不同Bell分期的NEC患儿并发症与合并症比较[例(%)] |
|
|
治疗前、治疗后次日及恢复期的CRP以手术组较高(P < 0.05);手术组或非手术组恢复期的CRP低于同组治疗前和治疗后次日,而治疗后次日CRP高于同组治疗前,差异均有统计学意义(P < 0.05)。治疗前和恢复期,手术组、非手术组的PCT差异无统计学意义(P > 0.05);治疗后次日,以手术组的PCT较高(P < 0.05);手术组或非手术组恢复期的PCT低于同组治疗前和治疗后次日,差异均有统计学意义(P < 0.05)。见表 4。
| 表 4 手术和非手术NEC患儿不同治疗时间点的CRP、PCT比较[P50(P25,P75)] |
|
|
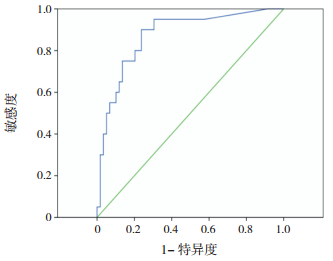
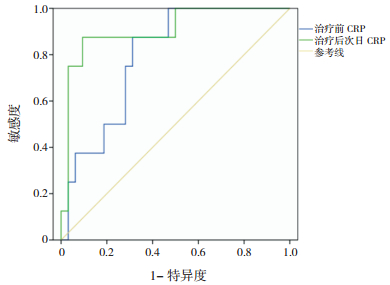
NEC患儿不同治疗阶段的CRP、PCT,仅治疗后次日CRP对Ⅲ期NEC发生的预测价值有统计学意义(P < 0.05),最佳cut-off值为19.1 mg/L,灵敏度和特异度分别为90.0%和76.3%,见表 5、图 1。NEC患儿不同治疗阶段的CRP、PCT,仅治疗前和治疗后次日CRP对NEC手术的预测价值有统计学意义(P < 0.05),最佳cut-off值为14.6 mg/L、42.9 mg/L,灵敏度和特异度分别为87.5%、75.0%和72.7%、86.4%,见表 6、图 2。
| 表 5 不同治疗时间点的CRP、PCT对Ⅲ期NEC发生的预测价值 |
|
|
| 表 6 不同治疗时间点的CRP、PCT对NEC手术的预测价值 |
|
|
|
图 1 治疗后次日CRP对于Ⅲ期NEC预测的ROC曲线 |
|
图 2 治疗前和治疗后次日CRP对于NEC手术预测的ROC曲线 |
NEC是一种严重的新生儿肠道炎性疾病。Niemarkt等[1]和Zhang等[4]报道NEC在新生儿重症监护室占1%~5%,其中20%~40%需要手术治疗,NEC手术患儿的死亡率高达45%。而现阶段对于NEC的早期诊断和预后评估缺乏有效手段[1]。有研究认为感染和肠壁炎症是NEC的最主要病因,炎症介质如内毒素、前列腺素、白三烯、多种白细胞介素、血小板活化因子、肿瘤坏死因子等参与了NEC的发病过程[1, 4, 8]。CRP是肝脏在细胞因子IL-6作用下合成的急性时相反应蛋白,在炎症反应6~8 h开始升高,48~72 h达高峰,CRP的增高程度能反映机体炎症反应的程度[9-10]。PCT由甲状腺合成,在机体严重感染时可快速升高,最早可在感染后2 h内检测到,6 h是上升速度最快的时段,8~24 h可稳定保持高水平状态[9-10]。本研究根据CRP、PCT上升速度特点,选择治疗前、治疗后次日及恢复期等不同时段的CRP、PCT进行比较、分析,结果显示:手术组和非手术组恢复期的CRP、PCT均低于同组治疗前和治疗后次日(P < 0.05),提示CRP、PCT参与NEC的发生、发展,证实细菌感染是NEC的主要病因。
本研究中Ⅱ、Ⅲ期NEC患儿恢复期的CRP、PCT低于Bell同期的治疗前、治疗后次日,而Ⅰ期组不同治疗阶段的CRP、PCT差异无统计学意义,提示CRP、PCT主要参与Ⅱ、Ⅲ期NEC发生、发展,细菌感染是Ⅱ、Ⅲ期NEC的主要致病病因。Zhang等[6]研究也发现NEC肠狭窄患儿恢复期CRP、PCT低于治疗前和治疗后次日。本研究还发现,Ⅲ期组治疗前、治疗后次日、恢复期的CRP均高于同一治疗时段的Ⅰ、Ⅱ期组,Ⅲ期组的PCT在治疗前高于Ⅰ期组,在治疗后次日高于Ⅰ、Ⅱ期组,Ⅱ期组治疗前的CRP、PCT高于治疗同阶段的Ⅰ期组,进一步提示CRP、PCT参与Ⅱ、Ⅲ期NEC的发生、发展,严重细菌感染是Ⅱ、Ⅲ期NEC的主要致病病因。结果还显示,手术组或非手术组以及Ⅱ、Ⅲ期组治疗后次日CRP、PCT高于治疗前,可能与NEC细菌感染产生的炎症级联反应导致CRP、PCT继续上升有关[4, 6, 8]。
目前NEC的临床分期主要参考Bell分期标准,Ⅲ期NEC为重症NEC,进展快,预后差[6-8]。本研究中,Ⅲ期组的呼吸衰竭发生率和机械通气使用率高于Ⅰ、Ⅱ期组,Ⅲ期组的脓毒症发生率也较高;消化道穿孔和肠狭窄仅见于Ⅲ期患儿。Ⅲ期NEC的诊断仍主要依靠临床表现,腹部X线片是确诊及判断手术指征的重要条件,如一次腹部平片无阳性发现,可在发病48~72 h之内每6~8 h复查。至今国内外尚无预测Ⅲ期NEC发生或手术的生物标记物[2, 6-7, 11]。Heida等[11]研究显示,NEC肠狭窄(Bell分期Ⅱb以上)患儿血清CRP水平上升的速度与肠狭窄程度呈正相关。Houben等[2]报道,67例NEC肠狭窄行手术治疗患儿的CRP为73.1(23.2~232)mg/L。本研究显示,治疗后次日的CRP水平对Ⅲ期NEC发生有很好的预测价值,最佳cut-off值为19.1 mg/L;治疗前和治疗后次日的CRP对NEC手术有预测价值,最佳cut-off值分别为14.6 mg/L、42.9 mg/L。提示CRP可能作为Ⅲ期NEC发生及手术预测的血清学指标,与文献一致。
综上所述,CRP、PCT水平及变化有助于Ⅱ、Ⅲ期NEC的早期诊断,CRP可能作为预测Ⅲ期NEC发生及手术的辅助指标。
| [1] |
Niemarkt HJ, de Meij TG, van de Velde ME, et al. Necrotizing enterocolitis:a clinical review on diagnostic biomarkers and the role of the intestinal microbiota[J]. Inflamm Bowel Dis, 2015, 21(2): 436-444. DOI:10.1097/MIB.0000000000000184 (  0) 0) |
| [2] |
Houben CH, Chan KW, Mou JW, et al. Management of intestinal strictures post conservative treatment of necrotizing enterocolitis:The long term outcome[J]. J Neonatal Surg, 2016, 5(3): 28. DOI:10.21699/jns.v5i3.379 (  0) 0) |
| [3] |
Lean WL, Kamlin CO, Garland SM, et al. Stable rates of neonatal sepsis in a tertiary neonatal unit[J]. J Paediatr Child Health, 2015, 51(3): 294-299. DOI:10.1111/jpc.2015.51.issue-3 (  0) 0) |
| [4] |
Zhang HY, Wang F, Feng JX. Intestinal microcirculatory dysfunction and neonatal necrotizing enterocolitis[J]. Chin Med J(Engl), 2013, 126(9): 1771-1778. (  0) 0) |
| [5] |
夏仁鹏, 李碧香, 周崇高, 等. 新生儿胃肠穿孔206例病因分析及临床转归[J]. 中国新生儿科杂志, 2017, 32(1): 31-34. (  0) 0) |
| [6] |
Zhang H, Chen J, Wang Y, et al. Predictive factors and clinical practice profile for strictures post-necrotising enterocolitis[J]. Medicine(Baltimore), 2017, 96(10): e6273. (  0) 0) |
| [7] |
Duci M, Fascetti-Leon F, Erculiani M, et al. Neonatal independent predictors of severe NEC[J]. Pediatr Surg Int, 2018, 34(6): 663-669. DOI:10.1007/s00383-018-4261-1 (  0) 0) |
| [8] |
邵肖梅, 叶鸿瑁, 邱小汕. 实用新生儿学[M]. 第4版. 北京: 人民卫生出版社, 2011: 477-482.
(  0) 0) |
| [9] |
Gilfillan M, Bhandari V. Biomarkers for the diagnosis of neonatal sepsis and necrotizing enterocolitis:Clinical practice guidelines[J]. Early Hum Dev, 2017, 105(2017): 25-33. (  0) 0) |
| [10] |
Chernyshov S, Alexeev M, Rybakov E, et al. Risk factors and inflammatory predictors for anastomotic leakage following total mesorectal excision with defunctioning stoma[J]. Pol Przegl Chir, 2018, 90(3): 31-36. DOI:10.5604/0032373X (  0) 0) |
| [11] |
Heida FH, Loos MH, Stolwijk L, et al. Risk factors associated with postnecrotizing enterocolitis stricures in infants[J]. J Pediatr Surg, 2016, 51(7): 1126-1130. DOI:10.1016/j.jpedsurg.2015.09.015 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


