过敏性紫癜(Henoch-Schönlein, HSP)是一种由免疫复合物介导的小血管炎,儿童较常见,常表现为皮肤对称性紫癜,部分伴有腹痛、消化道出血、关节疼痛、肾脏损害等,其中紫癜性肾炎(Henoch-Schönlein purpura nephritis, HSPN)是最常见的一种继发性肾脏病,影响过敏性紫癜的发展及预后。HSP的血管损伤机制尚不完全清楚,近年研究发现,内皮细胞损伤在HSP的发病机制中起重要作用[1]。内皮细胞微粒(endothelial microparticles, EMPs)是一种直径为0.1~1 µm的小囊泡,由内皮细胞在激活、凋亡或代谢时释放,与动脉硬化、肿瘤及糖尿病等多种疾病的发生发展密切相关[2]。EMPs作为内皮细胞损伤的标志物,目前已成为研究热点,但其与过敏性紫癜的关系却鲜有报道。本研究将健康儿童与HSP患儿的EMPs水平进行比较,探讨EMPs与HSP内皮细胞损伤的相关性,进一步研究HSP内皮细胞损伤的机制,为HSP及HSPN的诊断提供理论依据。
1 资料与方法 1.1 研究对象选取2016年1月至2017年12月在河南省儿童医院初诊并治疗的100例HSP患儿为研究对象,其中尿检异常、经肾穿刺活检符合HSPN诊断的40例,非HSPN的60例。过敏性紫癜诊断参照2006年欧洲风湿病联盟(EULAR)和欧洲儿科风湿病学会(PRES)新标准[3]。HSPN诊断参照2009年中华医学会儿科学分会肾脏病学组制定的紫癜性肾炎诊断标准[4]。并以同年龄段我院门诊体检的健康儿童30例为对照组。100例HSP患儿的平均年龄4.9±2.1岁。对照组平均年龄4.6±1.8岁。HSPN、非HSPN及对照组三组间的年龄差异均无统计学意义(F=0.834,P > 0.05)。
研究获得医院医学伦理委员会批准以及患儿家长知情同意。
1.2 EMPs测定所有研究对象在治疗前取空腹静脉血5 mL(枸櫞酸钠抗凝),160 rpm离心10 min,取上清180 rpm离心10 min,取上清得到贫血小板血浆(platelets-free plasma, PFP),分装后-80℃冰箱保存。
EMPs测定参照文献[5]:37℃水浴箱中溶解PFP样本,4℃下1 500 rpm离心30 min,弃去上清,取50 μL沉淀,加入特异性荧光标记抗体(抗CD31-藻红蛋白、抗CD42b-FITC抗体,购自美国BD公司)10 μL,室温避光孵育30 min,加入1 mL PBS待流式细胞仪检测。标本上机前用直径1.0 μm的标准微球进行前向角设门,使门内的微颗粒直径 < 1.0 μm,然后将标本混匀上机检测,收集门内微颗粒进一步行FITC和PE荧光强度分析。EMPs定义为直径 < 1.0 μm且CD31+/CD42b-。每个样本收集10 000个微粒,获得CD31+/CD42b-EMPs的含量。
1.3 Th17细胞含量及血清IL-17水平测定所有研究对象在治疗前采集空腹静脉血2 mL(肝素钠抗凝),采用流式细胞术三色荧光标记法检测Th17细胞(CD3+CD8-IL-17+细胞)含量,CD3-FITC、CD8-PerCP、IL-17-PE抗体来自美国BD Bioscience公司。采用ELISA方法检测血清IL-17水平,试剂盒购自德国QIAGen公司。
1.4 统计学分析应用SPSS 22.0进行数据处理。正态分布的计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,多组间两两比较采用SNK-q检验。两个变量的相关性分析采用Perason直线相关性分析。P < 0.05为差异有统计学意义。
2 结果 2.1 3组间Th17、IL-17及EMPs水平比较Th17、IL-17在HSPN及非HSPN组均高于对照组,以HSPN组最高,差异有统计学意义(P < 0.05);HSPN及非HSPN患儿的EMPs水平较健康对照组升高,以HSPN组最高,差异有统计学意义(P < 0.05)。见表 1。
| 表 1 3组间Th17、IL-17及内皮细胞微粒水平比较(x±s) |
|
|
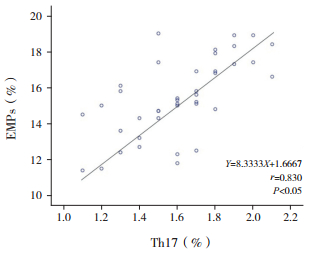
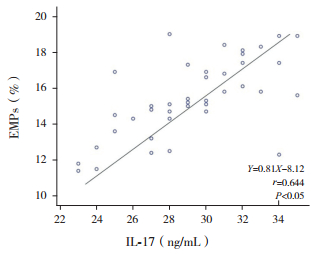
HSPN患儿的Th17、IL-17水平与EMPs水平呈正相关(r=0.830、0.644,P < 0.05),见图 1、2。
|
图 1 紫癜性肾炎患儿的Th17水平与内皮细胞微粒水平的相关性分析 |
|
图 2 紫癜性肾炎患儿的IL-17水平与内皮细胞微粒水平的相关性分析 |
中性粒细胞浸润、内皮细胞损伤是过敏性紫癜的重要病理生理基础[6]。内皮细胞损伤可释放大量促炎因子、内皮细胞微粒(EMPs)及黏附分子等,进一步诱导内皮损伤、促进炎症反应。
内皮细胞微粒(EMPs)是由活化或凋亡的血管内皮细胞释放的小囊泡,EMPs促进IL-6及IL-17释放,而炎性因子又诱导EMPs产生[7]。EMPs损伤血管内皮细胞的机制包括:(1)一氧化氮(nitric oxide, NO)是内皮细胞性血管舒张因子,而EMPs可抑制内皮细胞释放NO,降低由乙酰胆碱介导的血管舒张功能,导致内皮细胞功能损伤[8]。(2)EMPs促进内皮细胞损伤处的血小板聚集形成微血栓,促进血管内皮细胞损伤;(3)EMPs影响T淋巴细胞活化及其功能。有研究[9]发现,高浓度EMPs干预组的CD69表达水平较高,而CD69是T细胞活化早期表达的蛋白。EMPs还可诱导TH1型细胞因子分泌如IFN-γ和IL-2,而IFN-γ和IL-2的表达增加又可促进Th细胞的增殖及分化[10]。Th细胞的过度活化进一步激活B淋巴细胞,导致免疫功能紊乱。
有研究[11]表明,EMPs在白塞病、脑血管疾病、急性冠脉损伤综合征、慢性肾病等均有明显升高。这些疾病均有不同程度的血管内皮细胞损伤,而血管内皮细胞损伤也是过敏性紫癜的重要病理生理基础。EMPs在过敏性紫癜患儿中的表达及其意义尚不清楚。本研究发现,EMPs在HSP的肾炎和非肾炎患儿中均明显升高,提示EMPs在过敏性紫癜的发病机制中可能起一定作用。而且HSP患儿的IL-17较对照组升高,提示EMPs可以促进IL-6、IL-17等炎性因子释放,与文献研究一致。结果还表明,过敏性紫癜有肾损伤患儿的EMPs、IL-17更高,提示升高的EMPs可能是过敏性紫癜患儿肾脏受累的原因之一。
免疫机制紊乱在HSP发生发展中占重要地位。本研究HSPN组的EMPs与Th17及IL-17表达均呈正相关,提示EMPs可能诱导Th17活化,刺激机体产生IL-17。与文献报道一致。另有研究[12]表明,Th17细胞及其分泌的IL-17在HSPN的表达高于无肾脏受累的HSP患儿。本研究的Th17、IL-17水平也是以HSPN组最高。
综上所述,EMPs在过敏性紫癜的发病机制中起一定作用,升高的EMPs可能是过敏性紫癜患儿肾脏受累的原因之一。
| [1] |
陈静思, 孙晨, 阳海平, 等. 过敏性紫癜患者中性粒细胞及其IgA Fc受体对血管内皮细胞凋亡的影响及机制[J]. 中华皮肤科杂志, 2017, 50(11): 795-799. DOI:10.3760/cma.j.issn.0412-4030.2017.11.005 (  0) 0) |
| [2] |
刘成海, 胡厚源. 细胞衍生微粒与疾病[J]. 中国动脉硬化杂志, 2016, 24(11): 1179-1182. (  0) 0) |
| [3] |
Ozen S, Ruperto N, Dillon MJ, et al. EULAR/PReS endorsed consensus criteria for the classification of childhood vasculitides[J]. Ann Rheum Dis, 2006, 65(7): 936-941. (  0) 0) |
| [4] |
中华医学会儿科学分会肾脏病学组. 紫癜性肾炎的诊治循证指南(试行)[J]. 中华儿科杂志, 2009, 47(12): 911-912. DOI:10.3760/cma.j.issn.0578-1310.2009.12.007 (  0) 0) |
| [5] |
姜敏, 王晶, 张洪平, 等. 频繁急性加重型慢性阻塞性肺病患者血浆血管内皮微粒水平分析[J]. 临床检验杂志, 2017, 35(7): 514-517. (  0) 0) |
| [6] |
李成荣, 周玉峰, 付劲蓉. 粘附分子在过敏性紫癜患者血管内皮细胞中的作用探讨[J]. 中华微生物学和免疫学杂志, 2002, 22(5): 563-565. DOI:10.3760/j:issn:0254-5101.2002.05.030 (  0) 0) |
| [7] |
Nazari A, Zahmatkesh M, Mortaz E, et al. Effect of methamphetamine exposure on the plasma levels of endothelialderived microparticles[J]. Drug Alcohol Depend, 2018, 186: 219-225. DOI:10.1016/j.drugalcdep.2018.02.015 (  0) 0) |
| [8] |
Mezentsev A, Merks RM, O'Riordan E, et al. Endothelial microparticles affect angiogenesis in vitro:role of oxidative stress[J]. Am J Physiol Heart Circ Physiol, 2005, 289(3): H1106-H1114. DOI:10.1152/ajpheart.00265.2005 (  0) 0) |
| [9] |
Alari-Pahissa E, Notario L, Lorente E, et al. CD69 does not affect the extent of T cell priming[J]. PLoS One, 2012, 7(10): e48593. DOI:10.1371/journal.pone.0048593 (  0) 0) |
| [10] |
刘长营, 孙奕. 内皮细胞微粒诱导T细胞活化并产生Th1型细胞因子[J]. 检验医学, 2014, 29(4): 357-362. DOI:10.3969/j.issn.1673-8640.2014.04.014 (  0) 0) |
| [11] |
范秋玉, 许珂, 张莉芸, 等. 白塞病血循环内皮微粒的检测及临床意义分析[J]. 中华风湿病学杂志, 2017, 21(12): 824-828. DOI:10.3760/cma.j.issn.1007-7480.2017.12.007 (  0) 0) |
| [12] |
张建江, 史佩佩, 王淼, 等. Th17/Treg失衡及IL-17、TGF-β1水平在儿童过敏性紫癜和紫癜性肾炎中的研究[J]. 中华肾脏病杂志, 2014, 30(9): 702-703. DOI:10.3760/cma.j.issn.1001-7097.2014.09.011 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


