2. 临安区人民医院儿科, 浙江 杭州 311300
Kallmann综合征(Kallmann syndrome, KS)是一种伴有嗅觉缺失或减退的低促性腺激素性腺功能减退综合征,具有很强的临床及遗传异质性[1]。KS发病率男性为1 : 8 000,女性1 : 40 000,呈家族性或散发性。KS的遗传方式多样,包括常染色体显性遗传、常染色体隐性遗传、X染色体连锁遗传,也可能呈多基因遗传[2]。具有典型的青春期性发育延迟或不发育、嗅觉减退和阳性家族史者临床容易诊断,但临床表现不典型者以及婴幼儿患者容易漏诊。随着基因测序的发展,越来越多的患者得以早期确诊。本研究回顾性分析5例诊断为KS患者的临床资料,总结其临床及基因突变特点,并对KS相关文献进行复习,有助于提高儿科医生对KS的认识。
1 资料与方法 1.1 研究对象以2015年7月至2017年7月浙江大学医学院附属第一医院儿科诊断的5例KS患者为研究对象,就诊年龄为6个月至19岁,男4例、女1例。诊断参照KS主要的诊断标准[3]:(1)有性腺功能减退症的临床表现;(2)促黄体生成素(LH)、卵泡刺激素(FSH)、睾酮(T)水平均低下;(3)甲状腺轴功能、肾上腺轴功能、生长激素轴功能及泌乳素正常;(4)鞍区MRI未见下丘脑及垂体器质性异常;(5)伴或不伴嗅球/嗅束发育异常;(6)骨龄落后;(7)GnRH兴奋试验表现为反应延迟;(8)染色体核型正常。
收集患儿的临床资料,包括一般资料以及激素测定、影像学检查结果。
1.2 性腺与生殖异常相关基因的高通量测序提取外周血DNA行性腺与生殖异常相关基因检测(北京智因东方转化医学研究中心),包括KAL1、FGFR1、PROKR2、PROK2、CHD7、FGF8等KS常见的致病基因。基因检测获得患儿或监护人的知情同意。
1.3 生物信息学分析应用Swiss-Model在线软件(https://swissmodel.expasy.org/interactive)对突变基因编码的蛋白进行结构预测。
2 结果 2.1 临床特点除6月龄患儿(病例4)外,余均表现为低促性腺激素性腺功能减退,其中3例患儿伴嗅觉功能缺陷、2例MRI发现嗅球发育不良(图 1、图 2);1例伴唇腭裂;例4婴儿期表现为小阴茎、隐睾、右肾缺如。5例患者的染色体核型均正常,其父母均无症状,病例5的伯父自幼有第二性征发育不全伴嗅觉障碍。5例患者垂体激素:甲状腺功能、皮质醇、泌乳素均正常,LH和FSH基础值低。5例患者均行GnRH试验,其中4例男性的LH峰值均 < 3.3 U/L,提示低促性腺激素性腺功能减退;女性患者LH峰值5.1 IU/L、出现在给药后120 min,提示性腺功能反应延迟。病例1、3、5的hCG激发试验提示睾丸功能正常。见表 1。
|
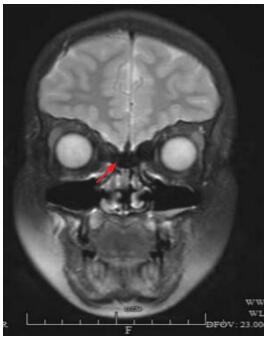
图 1 病例1冠状位MRI(T2加权相) 嗅沟显示变窄(箭头所示),嗅束未显示。 |
|
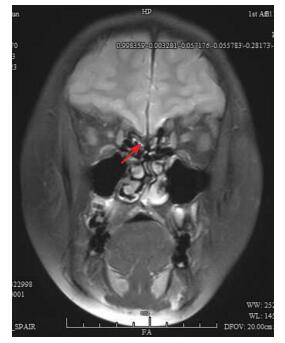
图 2 病例3冠状位MRI(T2加权相) 嗅沟明显变窄,嗅束未显示(箭头所示)。 |
| 表 1 5例KS患者的临床特点及实验室检查结果 |
|
|
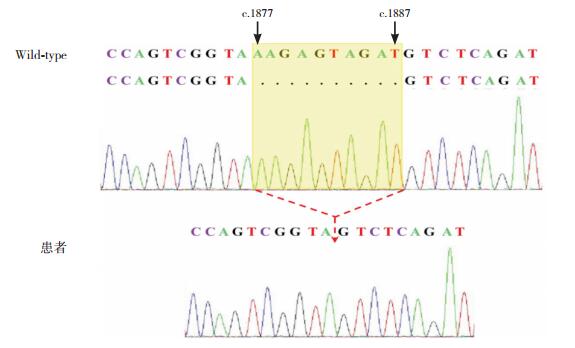
高通量测序发现病例3、4、5存在基因突变。病例3发现FGFR1基因c.1097C > T/p.P366L(杂合),其父亲携带相同的杂合突变,母亲为野生型;病例5发现FGFR1基因c.809G > C/p.G270A(杂合),其父亲携带相同的杂合突变,其母亲为野生型。这两个突变均为已报道的致病性突变[4-5]。病例4发现X染色体上KAL1基因缺失突变:c.1877_1887del/p.S627Tfs*6,来自于其母亲(杂合),其父亲为野生型,见图 3。经检索该突变未见报道,为新发突变。
|
图 3 病例4的基因测序结果 患者KAL1基因存在c.1877_1887del突变,导致KAL1基因在1877至1887碱基处产生10 bp的缺失并发生移码。 |
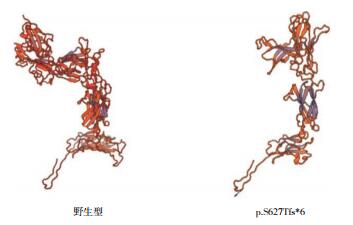
应用Swiss-Model(https://swissmodel.expasy.org/interactive)对KAL1基因突变c.1877_1887del编码蛋白进行结构预测。KAL1 c.1877_1887del突变导致第627位丝氨酸变为色氨酸,移码后在633位氨基酸提前终止。野生型与突变后的蛋白结构见图 4。
|
图 4 KAL1基因c.1877_1887del突变前后的蛋白结构预测 突变导致蛋白在633位氨基酸提前终止,纤连蛋白Ⅲ型结构域-4缺失。 |
KS的临床特征主要包括低促性腺激素性腺功能减退和嗅觉功能缺陷,发病机制不完全清楚,可能与起源于嗅基板的GnRH神经元定位于下丘脑,不能正常迁徙有关,表现出青春期发育延迟[6]。
经中国知网、万方数据库、维普数据库、PubMed数据库检索,检索到KS相关文献106篇,共报道KS 953例(其中女性46例,4.8%),27篇文献报道的382例进行了基因检测,占所有KS患者的40.0%,基因突变阳性率约22.7%,前三位基因分别是KAL1(约43.7%)、FGFR1(约26.4%)、PROKR2(约19.5%);其中因第二性征发育不良就诊的占95%以上,嗅觉减退的占85%,合并其他畸形的占15%;在其他畸形中,隐睾约24%、智力异常约14.5%、唇腭裂约10%、色盲或色弱约10%、肾发育畸形约7.5%、听力异常约6%。在非生殖系统症状、非嗅觉症状的表型中,KAL1突变患者的单侧肾发育不良发生率约30%,FGFR1突变所致患者的唇腭裂发生率约30%[7]。本研究报道的5例患儿中3例检出基因异常,分别是KAL1基因和FGFR1基因突变,与文献一致。
KAL1基因,又称ANOS1基因,编码的anosmin 1-蛋白作为细胞粘附蛋白在大脑、脊髓和肾脏表达,并且对神经细胞的迁移起重要作用。KAL1基因突变与X连锁KS表型相关,其表型似乎比其他分子缺陷所致更为严重,可致嗅觉和GnRH神经元迁移异常,表现为泌尿生殖系统异常(30%~40%为肾发育不良)和联带运动(80%~85%),但不导致其他发育缺陷如中线异常、腭裂[8-12]。5%~10%的KS患者与KAL1基因突变有关,家族性发生率较高[13]。anosmin-1蛋白的第186~287位氨基酸、292~440位氨基酸、425~523位氨基酸以及550~658位氨基酸构成纤连蛋白Ⅲ型1~4结构域,这些氨基酸构成β折叠,在进化上高度保守。本研究的1例6月龄患儿,表现为小阴茎、隐睾伴右肾缺如,基因检测证实患儿存在新发KAL1基因c.1877_1887del突变,与文献报道的30%~40%的KAL1基因突变患者发生肾发育不良相符,该突变使KAL1基因在1877~1887碱基产生10 bp缺失并发生移码,导致蛋白截短,纤连蛋白Ⅲ型功能结构域缺失;蛋白三维结构分析亦显示突变体的结构明显改变,因此该突变可能具有高度致病性,肾发育不良与KAL1基因突变可能相关。
FGFR1基因参与神经元迁移、胚胎发生过程中的分化和增殖以及嗅球的正常发育,其突变引起的KS是常染色体显性遗传。FGFR1突变所致的KS占10%,可致唇裂/腭裂、高腭弓、骨骼异常、眼征、听力损伤[14-15]。本研究例3的FGFR1基因p.P366L突变来自于其父亲。Trarbach等[4]曾报道FGFR1基因p.P366L突变病例,患者表现为嗅觉缺失伴肥胖、睡眠障碍,其两个姑姑均有性腺功能减退、嗅觉缺失。例5的FGFR1基因p.G270D突变同样来自于其父亲。Dodé等[5]在1例女性患者检测到FGFR1基因c.809G > A(p.G270D),表现为性发育不良伴嗅觉异常,但其父亲无性发育不良或嗅觉异常、腭裂等临床表现,这可能与FGFR1基因不完全外显有关。病例5的伯父自幼有第二性征发育不全伴嗅觉障碍,推测可能存在相同突变(因拒绝基因检测而未证实)。家族性FGFR1基因突变,呈现“不完全外显性”的较多。Pitteloud等[16]在一家系成员中检测到FGFR1基因R622X突变,患者表现为可逆的性腺功能减退,其母仅有青春期发育延迟,其外祖父仅表现为嗅觉丧失。同一家系的患者出现不同的外显性,推测与发育期FGFR1在GnRH神经元的迁徙中表达广泛有关[17]。
KS早期诊断非常困难。男婴的“小青春期”是早期诊断的最佳“窗口”时机[18]。如病例4因发现小阴茎、小睾丸行激素水平检测而得以早期确诊。女孩则缺乏早期诊断线索,诊断KS更为困难,如病例2直到青春期发育延迟方就诊。嗅觉异常是发现儿童KS的一个重要线索,但往往不能第一时间被发现或被归因于“鼻炎”。嗅觉识别试验与MRI表现具有一致性,特别是对于嗅球未发育及嗅觉缺失的一致性很高[19]。MRI可以清晰显示KS患者嗅球、嗅束、嗅沟的未发育或发育不良,有助于KS诊断和排除其他引起性腺功能减退或嗅觉功能障碍的疾病,尤其当伴有垂体前叶小、垂体柄纤细时[20]。儿童KS还可表现出中线颅骨异常(唇裂、腭裂和不完全融合)、牙缺失(牙齿发育不全)、视力问题(色盲或视神经萎缩)、听力异常、联带运动、肾发育异常等;骨骼肌肉畸形、眼球运动异常、心脏缺损也被报道是KS的一些少见症状相关[21]。因此,对于存在小阴茎、隐睾等表现的青春前期患儿,应仔细查体,积极完善听力检查、肾脏B超等,为早期诊断提供机会。
KS发病机制不明,临床和遗传的异质性大,临床医生需提高对此病的认识,结合基因检测,做到早期诊断。
| [1] |
Kim SH. Congenital hypogonadotropic hypogonadism and Kallmann syndrome:Past, present, and future[J]. Endocrinol Metab (Seoul), 2015, 30(4): 456-466. DOI:10.3803/EnM.2015.30.4.456 (  0) 0) |
| [2] |
Boehm U, Bouloux PM, Dattani MT, et al. Expert consensus document:European consensus statement on congenital hypogonadotropic hypogonadism-pathogenesis, diagnosis and treatment[J]. Nat Rev Endocrinol, 2015, 11(9): 547-564. DOI:10.1038/nrendo.2015.112 (  0) 0) |
| [3] |
Pitteloud N, Meysing A, Quinton R, et al. Mutations in fibroblast growth factor receptor 1 cause Kallmann syndrome with a wide spectrum of reproductive phenotypes[J]. Mol Cell Endocrinol, 2006, 254-255: 60-69. DOI:10.1016/j.mce.2006.04.021 (  0) 0) |
| [4] |
Trarbach EB, Costa EM, Versiani B, et al. Novel fibroblast growth factor receptor 1 mutations in patients with congenital hypogonadotropic hypogonadism with and without anosmia[J]. J Clin Endocrinol Metab, 2006, 91(10): 4006-4012. DOI:10.1210/jc.2005-2793 (  0) 0) |
| [5] |
Dodé C, Fouveaut C, Mortier G, et al. Novel FGFR1 sequence variants in Kallmann syndrome, and genetic evidence that the FGFR1c isoform is required in olfactory bulb and palate morphogenesis[J]. Hum Mutat, 2007, 28(1): 97-98. (  0) 0) |
| [6] |
Teixeira L, Guimiot F, Dodé C, et al. Defective migration of neuroendocrine GnRH cells in human arrhinencephalic conditions[J]. J Clin Invest, 2010, 120(10): 3668-3672. DOI:10.1172/JCI43699 (  0) 0) |
| [7] |
Dodé C, Hardelin JP. Kallmann syndrome[J]. Eur J Hum Genet, 2009, 17(2): 139-146. DOI:10.1038/ejhg.2008.206 (  0) 0) |
| [8] |
de Castro F, Esteban PF, Bribián A, et al. The adhesion molecule anosmin-1 in neurology:Kallmann syndrome and beyond[J]. Adv Neurobiol, 2014, 8: 273-292. DOI:10.1007/978-1-4614-8090-7 (  0) 0) |
| [9] |
Franco B, Guioli S, Pragliola A, et al. A gene deleted in Kallmann's syndrome shares homology with neural cell adhesion and axonal path-finding molecules[J]. Nature, 1991, 353(6344): 529-536. DOI:10.1038/353529a0 (  0) 0) |
| [10] |
Costa-Barbosa FA, Balasubramanian R, Keefe KW, et al. Prioritizing genetic testing in patients with Kallmann syndrome using clinical phenotypes[J]. J Clin Endocrinol Metab, 2013, 98(5): E943-E953. DOI:10.1210/jc.2012-4116 (  0) 0) |
| [11] |
Quinton R, Duke VM, Robertson A, et al. Idiopathic gonadotrophin deficiency:genetic questions addressed through phenotypic characterization[J]. Clin Endocrinol(Oxf), 2001, 55(2): 163-174. DOI:10.1046/j.1365-2265.2001.01277.x (  0) 0) |
| [12] |
Salenave S, Chanson P, Bry H, et al. Kallmann's syndrome:a comparison of the reproductive phenotypes in men carrying KAL1 and FGFR1/KAL2 mutations[J]. J Clin Endocrinol Metab, 2008, 93(3): 758-763. DOI:10.1210/jc.2007-1168 (  0) 0) |
| [13] |
Nie M, Xu H, Chen R, et al. Analysis of genetic and clinical characteristics of a Chinese Kallmann syndrome cohort with ANOS1 mutations[J]. Eur J Endocrinol, 2017, 177(4): 389-398. DOI:10.1530/EJE-17-0335 (  0) 0) |
| [14] |
Hu Y, Bouloux PM. Novel insights in FGFR1 regulation:lessons from Kallmann syndrome[J]. Trends Endocrinol Metab, 2010, 21(6): 385-393. DOI:10.1016/j.tem.2010.01.004 (  0) 0) |
| [15] |
Miraoui H, Dwyer AA, Sykiotis GP, et al. Mutations in FGF17, IL17RD, DUSP6, SPRY4, and FLRT3 are identified in individuals with congenital hypogonadotropic hypogonadism[J]. Am J Hum Genet, 2013, 92(5): 725-743. DOI:10.1016/j.ajhg.2013.04.008 (  0) 0) |
| [16] |
Pitteloud N, Acierno JS Jr, Meysing AU, et al. Reversible Kallmann syndrome, delayed puberty, and isolated anosmia occurring in a single family with a mutation in the fibroblast growth factor receptor 1 gene[J]. J Clin Endocrinol Metab, 2005, 90(3): 1317-1322. DOI:10.1210/jc.2004-1361 (  0) 0) |
| [17] |
Pitteloud N, Meysing A, Quinton R, et al. Mutations in fibroblast growth factor receptor l cause Kallmann syndrome with a wide spectrum of reproductive phenotypes[J]. Mol Cell Endocrinol, 2006, 254-255: 60-69. DOI:10.1016/j.mce.2006.04.021 (  0) 0) |
| [18] |
王伟. Kallmann综合征研究进展及儿科早期诊断[J]. 临床儿科杂志, 2008, 26(12): 1010-1012. DOI:10.3969/j.issn.1000-3606.2008.12.003 (  0) 0) |
| [19] |
Koenigkam-Santos M, Santos AC, Versiani BR, et al. Quantitative magnetic l-esonance imaging evaluation of the olfactory system in Kallmann syndrome:correlation with a clinical smell test[J]. Neuroendocrinology, 2011, 94(3): 209-217. DOI:10.1159/000328437 (  0) 0) |
| [20] |
Zhang Z1, Sun X, Wang C, et al. Magnetic resonance imaging findings in Kallmann syndrome:14 cases and review of the literature[J]. J Comput Assist Tomogr, 2016, 40(1): 39-42. DOI:10.1097/RCT.0000000000000334 (  0) 0) |
| [21] |
Kaplan JD, Bernstein JA, Kwan A, et al. Clues to an early diagnosis of Kallmann syndrome[J]. Am J Med Genet A, 2010, 152A(11): 2796-2801. DOI:10.1002/ajmg.a.v152a:11 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


