2. 北京大学第三医院超声科, 北京 100191;
3. 北京大学第三医院生殖医学中心, 北京 100191
患儿,男,2个月,因咳嗽2 d、呼吸困难4 h就诊。入院前2天无明显诱因出现阵发性咳嗽,1天前出现反应差,4 h前出现呻吟、喘息样呼吸。门诊查体发现呼吸节律不整、青紫,即刻予气管插管呼吸机辅助通气,并发现眼神欠灵活、四肢强直,予地西泮静脉推注,2~3 min后缓解。患儿近1天的奶量390 mL、近9 h无尿。立即收入重症监护病房。
患儿生后10 min曾因呼吸困难收入NICU。予无创吸机辅助通气,血气分析提示Ⅱ型呼吸衰竭。胸片提示肺纹理增多、心影增大。超声心动图提示:右心增大,三尖瓣中量返流,动脉导管未闭4 mm,双向分流,肺动脉压70 mm Hg。诊断考虑湿肺、肺动脉高压,给予米力农、多巴胺治疗,氧合逐渐改善,生后40 h撤机。住院期间(生后第3天)发现血压增高,波动在100~120/40~70 mm Hg,哭闹时明显,安静时血压在正常高限。实验室检查发现:ACTH及皮质醇减低,肾素-血管紧张素-醛固酮均升高,尿蛋白++,肾脏及肾血管超声未见异常。头颅超声提示脑水肿、脑室内少量出血。给予卡托普利降压及其他对症治疗,血压稳定在70~80/40~50 mm Hg。出院时尿蛋白+。出院后患儿未口服卡托普利,未监测血压,时有哭闹不安、伴皮肤花纹。生后1个月复查超声心动图示动脉导管未闭、左室壁增厚、左房增大、二尖瓣返流(轻度)、LVEF 55%;腹腔CT提示左侧肾上腺较大,左侧肾脏体积较小,增强后肾皮质强化弱,腹主动脉及其分支见环形及条状高密度影,血管壁钙化,管腔略狭窄。因未明确病因,未予治疗。患儿系第3胎第1产,出生胎龄36周,出生体重3 310 g,因“可疑宫内窘迫”剖宫产出生。Apgar评分1 min、5 min、10 min分别为7分、9分、10分。患儿出生时羊水、脐带未见异常,胎盘可见钙化。其母孕期合并糖尿病、甲状腺功能减低。否认家族遗传病史。
入院查体:体温36℃,心率184次/min、呼吸60次/min、血压103/19 mm Hg,平均动脉压34 mm Hg,反应差,前囟张力略高,全身皮肤苍黄、花纹,三凹征,双肺闻及粗湿罗音,心音低钝,律齐,未及杂音;腹软,肝肋下2 cm、质软边锐,脾肋下未及,肠鸣音4次/min;四肢肌张力减低,毛细血管充盈时间4~5 s。
实验室检查:血常规正常。血气分析:pH 6.95,PCO2 31 mm Hg,PO2 116 mm Hg,BE- 24.1。肌酸激酶同工酶88 U/L(参考值:< 24 U/L),肌钙蛋白T 3.2 ng/mL(参考值:0~0.1 ng/mL)。尿常规:蛋白+~+++。血尿素氮11.6 mmol/L(参考值:2.9~7.5 mmol/L)、肌酐93 μmol/L(参考值:24.969.7 μmol/L)。尿β2微球蛋白5.9 mg/L(参考值:0.8~1.8 mg/L),尿NAG 16.9 U/L(参考值:15~27 U/L)。24 h尿蛋白1245 mg/L(参考值:< 150 mg)、24 h尿肌酐1 568 μmol/L(参考值:7 100~17 700 μmol/L),尿总蛋白/肌酐7 020.6 mg/g·Cr(参考值:< 200 mg/g·Cr),尿微量白蛋白/肌酐3 349.6 mg/g·Cr(参考值:≤30 mg/g.Cr),NAG/Cr 95.3 U/g·Cr(参考值:1.0~6.3 U/g.Cr)。24 h尿钙0.32 mmol/L(参考值:2.5~10 mmol/L)。肝功能:谷丙酸氨基转移酶198 U/L(参考值:9~50 U/L),天冬氨酸氨基转移酶581 U/L(参考值:15~40 U/L)。全段甲状旁腺素243.9 pg/mL(参考值:10~50 pg/mL)。血25-羟维生素D 26.9 ng/mL(参考值:8.0~30.5 ng/mL)血钙1.6 mmol/L(参考值:2.11~2.52 mmol/L),血磷2.27 mmol/L(参考值:0.85~1.51 mmol/L)。甲状腺功能:总三碘甲状腺原氨酸0.32 ng/mL(0.6~1.81 ng/mL),总甲状腺素2.6 μg/dL(参考值:4.50~10.9 μg/dL),游离三碘甲状腺原氨酸1.97 pg/mL(参考值:2.3~4.2 pg/mL),游离甲状腺素0.71 ng/dL(参考值:0.89~1.80 ng/dL),促甲状腺素0.41 μIU/mL(参考值:1.7~9.1 μIU/mL)。胸片:双肺少许渗出病变,心影增大。甲状旁腺B超无异常。超声心动图:左室壁显著增厚,左房、左室增大,动脉导管未闭(左向右少量分流),LVEF 50%。脑电图:持续多导尖波。振幅整合脑电图:背景活动为不连续图形,无睡眠周期,频发锯齿样改变,提示惊厥持续状态。大动脉血管B超:双侧颈总动脉、双侧股动脉、颈动脉、椎动脉、颈内动脉壁广泛钙化;腹主动脉管壁广泛钙化,腹主动脉钙化处局部管腔变窄伴血流速度增快;双肾动脉血流速度增快,右肾动脉局部管壁钙化伴狭窄。头颅MRI:双侧额叶、顶叶、颞叶萎缩,脑室扩张。头颅MRA:双侧颈内动脉管腔狭窄,左侧椎动脉纤细及左侧大脑前动脉,左大脑中动脉管腔狭窄,双侧大脑后动脉狭窄。头颅超声显示双侧豆纹动脉血管钙化。
2 诊断思维2个月男婴,以咳嗽、呼吸困难就诊,入院查体发现高血压、脉压差大,既往在新生儿期出现过高血压、蛋白尿,因此高血压是该患儿的核心表现。新生儿期起病的高血压多为继发性,患儿有蛋白尿,影像学发现左肾体积较小,提示肾脏发育不良,需排除遗传性肾脏疾病所致的高血压,行遗传性肾脏疾病相关基因检测有助于诊断。另外,本病例在新生儿期影像学检查提示腹主动脉及其分支管腔略狭窄,进而行大动脉B超检查,发现广泛动脉钙化及腹主动脉、右肾动脉管腔变窄。该患儿在新生儿期即出现全身多发大动脉钙化、右肾动脉狭窄,考虑动脉钙化可能是病因,导致肾血管狭窄、肾发育不良,继发高血压。进一步文献检索发现婴儿期以高血压为主要症状并有广泛动脉钙化表现的疾病已有报道,即特发性婴儿动脉钙化症(idiopathic infantile arterial calcification, IIAC),发现外核苷酸焦磷酸酶/磷酸二酯酶1(ectonucleotide pyrophosphatase/phosphodiesterase 1, ENPP1)基因致病性突变有助确诊[1-2]。
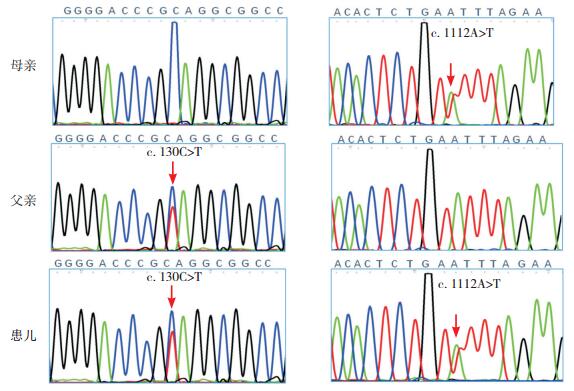
3 进一步检查全外显子组高通量测序未发现患儿遗传性肾脏疾病相关基因异常,但患儿ENPP1基因存在分别来自于其父母的c.130C > T和c.1112A > T的复合杂合突变(见图 1)。
|
图 1 患儿及其父母的ENPP1基因突变Sanger测序验证 患儿ENPP1基因存在遗传自其父母的c. 130C>T和c. 1112A>T复合杂合突变,突变位点如箭头所示。 |
诊断:特发性婴儿动脉钙化症(IIAC),依据:(1)新生儿期出现高血压;(2)影像学可见主动脉及分支广泛钙化,腹主动脉、右肾动脉管腔狭窄;(3)ENPP1基因存在2个复合杂合突变。
5 临床经过入院后给予硝普钠和速尿降血压,继之改为苯磺酸氨氯地平片、氯沙坦降压以及氢氯噻嗪利尿,血压从最高170/120 mm Hg逐步降至120/60 mm Hg左右,并辅以有创通气、强心、扩血管、镇静、止惊等对症治疗,心力衰竭、呼吸衰竭及惊厥均得以控制。确诊IIAC后给予唑唻膦酸静脉滴注(每次0.02 mg/kg,隔周一次,共3次),血压维持在100~110/60~70 mm Hg(同龄儿血压正常值的95百分位左右),血钙、磷正常。出院后口服依替膦酸,并予以苯磺酸氨氯地平、氯沙坦降压药,以及氯硝基安定、托吡酯片控制惊厥发作,患儿血压维持在90~110/60~70 mm Hg(正常高限),未再惊厥发作。现已随访至2.5岁,智力运动发育落后于健康同龄儿。
6 讨论特发性婴儿动脉钙化症(IIAC)是一种罕见的常染色体隐性遗传疾病,又称婴儿期广泛动脉钙化症。IIAC首次由Bryant[3]于1901年报道,迄今已报道约200例,国内报道的6例中4例经尸检病理确诊,发病机制为外核苷酸焦磷酸酶/磷酸二酯酶1(ENPP1)基因突变和失活导致广泛动脉血管内膜钙质沉积,继发血管狭窄造成严重高血压[4-6]。ENPP1基因定位于6q22~q23染色体,其产物ENPP1使血管平滑肌细胞、软骨细胞和成骨细胞产生无机焦磷酸(inorganic pyrophosphate, PPi)。PPi有许多生物活性,包括调节血管平滑肌细胞分化和抑制软组织钙化。ENPP1基因突变可导致PPi水平下降,产生羟磷灰石结晶,沉积在动脉血管内膜,导致大中动脉不同程度的钙化和内膜纤维化[9-12]。
本研究患儿基因检测发现其ENPP1基因有2个源自父母的复合杂合突变:c.130C > T(编码区第130号核苷酸由胞嘧啶变异为胸腺嘧啶),该变异不属于多态性位点,在人群中发生频率极低,导致氨基酸改变p.Q44X,造成蛋白质从44个氨基酸之后的部分缺失,为一级致病性突变形式;错义突变c.1112A > T(编码区第1112号核苷酸由腺嘌呤变异为胸腺嘧啶)导致氨基酸改变p.Y371F(第371号氨基酸由酪氨酸变异为苯丙氨酸),而且为已报道[13]的与IIAC相关的致病性突变。
IIAC临床形式多样,可在儿童不同时期出现不同症状。约48%的IIAC病例在胎儿期即出现症状,包括心律失常、心力衰竭、胎儿水肿甚至死亡。52%左右在新生儿期或婴儿期发病,出现呼吸衰竭、心力衰竭,惊厥、肾功能衰竭、高血压、心律失常和肠梗阻等,也可出现非特异性症状如易激惹、喂养困难和体重不增等[14-18]。IIAC的影像学表现具有特征性,主动脉及其分支包括主动脉弓、无名动脉、腹主动脉、股动脉等大血管内壁粗糙,伴大小不等的钙化斑块附着,合并管腔狭窄、血流速度增快[19-20]。本病例新生儿期起病的高血压为重要诊断线索,出院后随访影像学检查发现主动脉及其分支广泛钙化以及腹主动脉、右肾动脉局部管腔变窄伴血流速度增快,具备IIAC典型的影像学特点;并在可能的持续高血压(第一次出院后未监测血压)基础上,以呼吸道感染为诱因,迅速出现呼衰、心衰、惊厥,以及肾损伤和肾素-血管紧张素-醛固酮异常等。动脉活检发现羟基磷灰石沉积在大、中型动脉血管内膜是目前临床诊断IIAC的金标准[21]。但动脉活检属有创性检查,临床应用受到限制。因此根据临床及影像学特点、ENPP1基因的突变或失活确诊IIAC。
膦酸盐类制剂为IIAC治疗的一线用药[22-23]。机制与降低骨代谢速度,抑制已有钙化损伤部位的进一步钙沉积,提供可影响钙沉积的无机焦磷酸盐类似物,干扰羟基磷灰石晶体的形成有关。具体方案参照文献[24],静脉注射唑唻膦酸盐3周(每周一次,第1、2、3周剂量分别为0.25 mg/kg、0.5 mg/kg、0.5 mg/kg),3周后改为依替膦酸口服(每日20 mg/kg),逐步减量至50 mg/d口服维持。磷酸盐制剂中以双磷酸盐类药物首选。唑来膦酸为三代磷酸盐制剂,依替膦酸为第一代磷酸盐制剂。本病例确诊后持续口服依替膦酸、苯磺酸氨氯地平片、氯沙坦,血压维持在110/70 mm Hg左右(正常同龄儿血压第95百分位左右),动脉钙化未进展。长期应用膦酸盐制剂最常见的副作用为严重骨骼病变,类似佝偻病表现[25-26],须注意监测血钙、磷、碱性磷酸酶及骨密度。本例患儿动态监测血钙、血磷、碱性磷酸酶基本正常。
IIAC预后不佳,合并冠状动脉钙化是预后差的主要危险因素[14]。6个月以内起病的婴儿常常死于心力衰竭,个别可因心肌梗死猝死,因此对于诊断为婴儿猝死综合征的病例应注意排除IIAC;少数存活者可有顽固高血压、反复心肺功能衰竭、肾损害等并发症,需要予以降压及改善心功能等治疗,有条件者可行心脏移植;合并严重肾功能损害者可能需要腹膜透析[27]。目前仅有2例IIAC患者存活22年和25年的报道;11例存活大于6个月的报道中3例在儿童期确诊[28-30]。本病例2月龄即确诊,随访期间注意维护血压和心功能,避免感染诱因,口服依替膦酸延缓大血管进一步钙化,现已2.5岁。
7 结语本例患儿新生儿期即出现高血压、蛋白尿,生后一个月影像学发现腹主动脉及其分支环形及条状高密度影、血管壁钙化,管腔略狭窄,但思路被呼吸困难的表现所局限,未能将动脉钙化与第一次住院即发现的高血压联系起来,因此诊疗过程中应注意各种临床线索之间的联系,提高诊断思维能力。
| [1] |
Rutsch F, Ruf N, Vaingankar S, et al. Mutations in ENPP1 are associated with 'idiopathic' infantile arterial calcification[J]. Nat Genet, 2003, 34(4): 379-381. DOI:10.1038/ng1221 (  0) 0) |
| [2] |
Ruf N, Uhlenberg B, Terkeltaub R, et al. The mutational spectrum of ENPP1 as arising after the analysis of 23 unrelated patients with generalized arterial calcification of infancy (GACI)[J]. Hum Mutat, 2005, 25(1): 98. (  0) 0) |
| [3] |
Bryant JH, Hale-White WA. A case of calcification of the arteries and obliterative endarteritis associated with hydronephrosis in a child aged six months[J]. Guys Hosp Rep, 1901, 55: 17-28. (  0) 0) |
| [4] |
Guimarães S, Lopes JM, Oliveira JB, et al. Idiopathic infantile arterial calcification:a rare cause of sudden unexpected death in childhood[J]. Patholog Res Int, 2010, 2010: 185314. DOI:10.4061/2010/185314 (  0) 0) |
| [5] |
程蓉, 许伟青, 汪洁云. 新生儿特发性动脉钙化症伴腔内血栓形成一例[J]. 中华围产医学杂志, 2007, 10(1): 63. DOI:10.3760/cma.j.issn.1007-9408.2007.01.020 (  0) 0) |
| [6] |
范松青, 付汐, 李朵. 特发性婴儿动脉钙化症一例[J]. 中华医学杂志, 2008, 88(5): 358-359. DOI:10.3321/j.issn:0376-2491.2008.05.020 (  0) 0) |
| [7] |
高凤兰, 刘春灵, 张印坡, 等. 婴儿特发性动脉钙化尸检一例[J]. 中华病理学杂志, 2013, 42(11): 771-772. DOI:10.3760/cma.j.issn.0529-5807.2013.11.015 (  0) 0) |
| [8] |
宋莉莉, 邢轶维, 张芳, 等. 婴儿泛发性动脉钙化一例[J]. 天津医药, 2013, 41(2): 175-176. DOI:10.3969/j.issn.0253-9896.2013.02.025 (  0) 0) |
| [9] |
李晓卿, 王丽靖, 顾艳敏, 等. 二磷酸盐治疗婴儿特发性动脉钙化症[J]. 中国小儿急救医学, 2014, 21(1): 54-55. DOI:10.3760/cma.j.issn.1673-4912.2014.01.021 (  0) 0) |
| [10] |
梁小碧, 曾少颖, 李渝芬, 等. 特发性婴儿动脉钙化症二例[J]. 中华儿科杂志, 2014, 52(11): 874-876. DOI:10.3760/cma.j.issn.0578-1310.2014.11.019 (  0) 0) |
| [11] |
Li Q, Brodsky JL, Conlin LK, et al. Mutations in the ABCC6 gene as a cause of generalized arterial calcification of infancy:genotypic overlap with pseudoxanthoma elasticum[J]. J Invest Dermatol, 2014, 134(3): 658-665. DOI:10.1038/jid.2013.370 (  0) 0) |
| [12] |
Numakura C, Yamada M, Ariyasu D, et al. Genetic and enzymatic analysis for two Japanese patients with idiopathic infantile arterial calcification[J]. J Bone Miner Metab, 2006, 24(1): 48-52. (  0) 0) |
| [13] |
Cheng KS, Chen MR, Ruf N, et al. Generalized arterial calcification of infancy:different clinical courses in two affected siblings[J]. Am J Med Genet A, 2005, 136(2): 210-213. (  0) 0) |
| [14] |
Chong CR, Hutchins GM. Idiopathic infantile arterial calcification:the spectrum of clinical presentations[J]. Pediatr Dev Pathol, 2008, 11(5): 405-415. DOI:10.2350/07-06-0297.1 (  0) 0) |
| [15] |
van der Sluis IM, Boot AM, Vernooij M, et al. Idiopathic infantile arterial calcification:clinical presentation, therapy and long-term follow-up[J]. Eur J Pediatr, 2006, 165(9): 590-593. DOI:10.1007/s00431-006-0146-8 (  0) 0) |
| [16] |
Shaireen H, Howlett A, Amin H, et al. The mystery of persistent pulmonary hypertension:an idiopathic infantile arterial calcification[J]. BMC Pediatr, 2013, 13: 107. DOI:10.1186/1471-2431-13-107 (  0) 0) |
| [17] |
Rani H, Rao R, Rao U, et al. Idiopathic infantile arterial calcification with thrombotic microangiopathy——a unique case[J]. Fetal Pediatr Pathol, 2010, 29(6): 413-418. DOI:10.3109/15513815.2010.505625 (  0) 0) |
| [18] |
Zhang E, Owen R, Bruce G, et al. Idiopathic infantile arterial calcification in a 12-year-old girl presenting as chronic mesenteric ischemia:imaging findings and angioplasty results[J]. Pediatr Radiol, 2011, 41(11): 1476-1480. DOI:10.1007/s00247-011-2030-6 (  0) 0) |
| [19] |
Tran KH, Boechat MI. Idiopathic infantile arterial calcification:imaging evaluation and the usefulness of MR angiography[J]. Pediatr Radiol, 2006, 36(3): 247-253. DOI:10.1007/s00247-005-0044-7 (  0) 0) |
| [20] |
Whitehall J, Smith M, Altamirano L, et al. Idiopathic infantile arterial calcification:sonographic findings[J]. J Clin Ultrasound, 2003, 31(9): 497-501. DOI:10.1002/(ISSN)1097-0096 (  0) 0) |
| [21] |
Bolster F, Ali Z, Southall P, et al. Generalized arterial calcification of infancy——findings at post-mortem computed tomography and autopsy[J]. Forensic Sci Int, 2015, 254: e7-e12. DOI:10.1016/j.forsciint.2015.06.017 (  0) 0) |
| [22] |
Rutsch F, Böyer P, Nitschke Y, et al. Hypophosphatemia, hyperphosphaturia, and bisphosphonate treatment are associated with survival beyond infancy in generalized arterial calcification of infancy[J]. Circ Cardiovasc Genet, 2008, 1: 133-140. DOI:10.1161/CIRCGENETICS.108.797704 (  0) 0) |
| [23] |
Ramjan KA, Roscioli T, Rutsch F, et al. Generalized arterial calcification of infancy:treatment with bisphosphonates[J]. Nat Clin Pract Endocrinol Metab, 2009, 5(3): 167-172. (  0) 0) |
| [24] |
Edouard T, Chabot G, Miro J, et al. Efficacy and safety of 2-year etidronate treatment in a child with generalized arterial calcification of infancy[J]. Eur J Pediatr, 2011, 170(12): 1585-1590. DOI:10.1007/s00431-011-1572-9 (  0) 0) |
| [25] |
Otero JE, Gottesman GS, McAlister WH, et al. Severe skeletal toxicity from protracted etidronate therapy for generalized arterial calcification of infancy[J]. J Bone Miner Res, 2013, 28(2): 419-430. DOI:10.1002/jbmr.1752 (  0) 0) |
| [26] |
Ferreira CR, Ziegler SG, Gupta A, et al. Treatment of hypophosphatemic rickets in generalized arterial calcification of infancy (GACI) without worsening of vascular calcification[J]. Am J Med Genet A, 2016, 170A(5): 1308-1311. (  0) 0) |
| [27] |
Nael A, Siaghani PJ, Chen D, et al. Idiopathic infantile arterial calcification:a possible cause of refractory cardiopulmonary failure in infancy[J]. Case Rep Pathol, 2014, 2014: 189850. DOI:10.1155/2014/189850 (  0) 0) |
| [28] |
Stojanovic V, Doronjski A, Milak G, et al. Idiopathic arterial calcification of infancy——peritoneal dialysis for treatment of hypertension[J]. Fetal Pediatr Pathol, 2013, 32(6): 443-447. DOI:10.3109/15513815.2013.802399 (  0) 0) |
| [29] |
Giovannoni I, Callea F, Travaglini L, et al. Heart transplant and 2-year follow up in a child with generalized arterial calcification of infancy[J]. Eur J Pediatr, 2014, 173(12): 1735-1740. DOI:10.1007/s00431-014-2447-7 (  0) 0) |
| [30] |
Glatz AC, Pawel BR, Hsu DT, et al. Idiopathic infantile arterial calcification:two case reports, a review of the literature and a role for cardiac transplantation[J]. Pediatr Transplant, 2006, 10(2): 225-233. DOI:10.1111/ptr.2006.10.issue-2 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


