患儿,女,11个月,哈萨克族,因发热、咳嗽、发现血糖高15 d入院。患儿因发热、咳嗽就诊发现随机血糖16.0 mmol/L,给予抗感染治疗,并监测随机血糖:波动在5.7~26 mmol/L。患儿自患病以来,精神、饮食及睡眠可,无多饮、多食、多尿,大便未见异常,体重无明显变化。患儿为第3胎第3产,足月顺产出生,出生体重3.6 kg、身长69 cm,否认窒息、产伤史;生后母乳喂养,6个月添加辅食,3个月可抬头,6个月能独坐。父母体健,为表兄妹结婚,患儿的哥哥、姐姐均体健,家族无遗传病史及传染病史可寻。入院体查:体重8 kg,身长72 cm,神清,皮肤无黄染,全身浅表淋巴结未触及肿大,双肺呼吸音粗糙,未闻及干湿罗音,心音有力,心率118次/min,各瓣膜区未闻及杂音。腹平软,肝脾肋下未触及,病理反射未引出。辅助检查:尿常规:尿糖3+、酮体阴性。糖化血红蛋白9.20%(参考值:4.5~6.0%)。胰岛素2.50 μIU/mL(参考值:空腹2.6~24.9 μIU/mL),C-肽0.38 ng/mL(参考值:空腹0.78~5.198 ng/mL)。β2微球蛋白1.37 mg/L(参考值:0~0.3 mg/L)。25-维生素D 14.61 nmol/L(参考值:> 50 nmol/L)。胸片:符合支气管肺炎。血常规、生化、血气分析、炎症因子(降钙素原、白细胞介素6、超敏C反应蛋白)、粪便常规、甲状腺功能、凝血功能、血沉、体液免疫检测组合(IgG、IgA、Ig M、总IgE)、糖尿病抗体系列(抗胰岛细胞抗体40 KD、抗胰岛细胞抗体60 KD、抗胰岛细胞抗体IA-2A、抗胰岛素抗体IAA、抗谷氨酸脱羧酶抗体)、心脏超声均无异常。
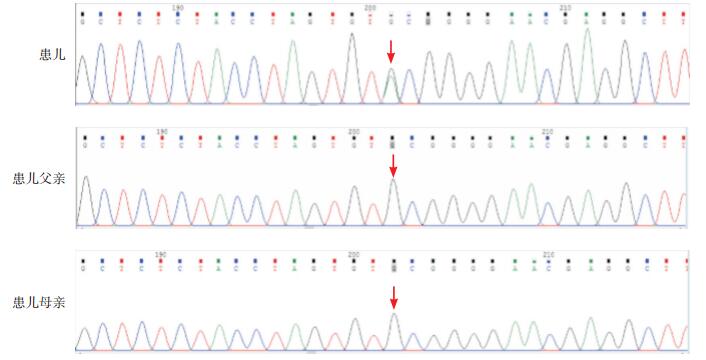
新生儿糖尿病多在出生后6个月内发病,但也有报道单基因突变引起的新生儿糖尿病于6个月至1岁发病[1],故行新生儿糖尿病相关的基因检测。采集患儿及其父母静脉血2 mL(EDTA抗凝),提取基因组DNA,构建基因组文库,检测与新生儿糖尿病相关的19个基因,测序平均深度不小于160.89X。结果发现,患儿INS基因存在c.128G > A(p.C43Y)杂合突变。对患儿及其父母DNA标本进行INS基因的Sanger测序验证(图 1),患儿父母INS基因的该位点正常。INS基因c.128G > A突变目前未见文献报道,SIFT、PolyPhen2和Mutation Taster三个生物信息软件预测均提示有害,为可疑致病性突变,且有文献报道[2-5]该氨基酸位点发生的其他突变(p.C43G和p.C43S)具有致病性,故上述突变很可能有害。
|
图 1 患儿及其父母INS基因Sanger测序验证 患儿INS基因存在c.128G>A(p.C43Y)杂合突变,患儿父母该位点正常。突变部位如箭头所示。 |
入院后患儿空腹血糖波动在5.5~11.7 mmol/L,餐后血糖波动在8.2~12.3 mmol/L,给予抗感染、口服格列本脲(早餐前12.5 mg、晚餐前12.5 mg),治疗后空腹血糖波动在6.7~12.8 mmol/L,餐后血糖波动在11.6~12.8 mmol/L。出院后继续原剂量格列本脲治疗,治疗8个月后(1岁7个月)随访,身高82 cm、体重11.0 kg,均 < 1 SD,随机血糖波动在8.3~10.7 mmol/L,HbA1c 9.5%,提示血糖控制欠佳,再次建议使用胰岛素治疗,家属拒绝。
讨论:新生儿糖尿病(neonatal diabetes mellitus, NDM)是一种少见的特殊类型糖尿病,发病率极低,占活产婴儿的1/80万~1/40万[6]。根据转归分为暂时性新生儿糖尿病(transient neonatal diabetes mellitus, TNDM)和永久性新生儿糖尿病(permanent neonatal diabetes mellitus, PNDM),约各占50%[1]。根据文献[7],NDM诊断需要符合以下标准:发病年龄 < 6个月,空腹血糖≥ 7.0 mmol/L(新生儿期空腹4 h、婴儿期空腹8 h以上),持续2周以上,C肽降低或正常低值,糖尿病抗体(抗胰岛细胞抗体40 KD、抗胰岛细胞抗体60 KD、抗胰岛细胞抗体IA-2A、抗胰岛素抗体IAA、抗谷氨酸脱羧酶抗体)阴性,需要胰岛素治疗以维持正常血糖。TNDM一般在生后5 d至6周发病,患儿常为小于胎龄儿、伴有体重不增、宫内发育迟缓等,所需胰岛素用量小,约50%在青春期复发[1, 6]。PNDM临床表现谱广泛,从新生儿期发生的严重胰岛素缺乏型糖尿病到迟发的轻型糖尿病,最晚发病年龄为1岁,就诊时可伴有酮症酸中毒、脱水等[1]。本例患儿11个月发现血糖增高,伴糖化血红蛋白增高,胰岛素、C-肽偏低,糖尿病抗体(抗胰岛细胞抗体40 KD、抗胰岛细胞抗体60 KD、抗胰岛细胞抗体IA-2A、抗胰岛素抗体IAA、抗谷氨酸脱羧酶抗体)阴性,无严重感染、应激、医源性及药物等诱因,符合PNDM临床特点。
NDM为单基因遗传病,由于基因突变导致胰腺发育不全、β细胞破坏,主要与染色体6P24区基因突变(占2/3)有关,PLAGL1和MYMA1是最常见的致病基因,其次是KATP通道基因突变,基中内向整流性钾离子通道J家族11因子(KCNJ11)、ATP结合C家族8因子(ABCC8)突变均可导致NDM [8];INS基因突变所致占20%[6]。INS基因编码前胰岛素原,INS显性突变引起胰岛素原错误折叠并聚集在内质网,引起内质网应激,最终导致β细胞功能障碍和凋亡,导致PNDM、青少年发病的成人型糖尿病和自身抗体阴性的1型糖尿病;INS隐性突变可引起胰岛素生物合成减少而导致PNDM,临床症状较显性突变更为严重,高血糖出现早、出生体质量低[9]。2007年Stoy[2]首先报道10个INS基因突变导致的新生儿糖尿病,至今共报道有51种INS基因突变[10]。本例患儿INS基因的新生突变c.128G > A未见报道,但c.128G > A致使43位氨基酸由半胱氨酸变为酪氨酸,阻断半胱氨酸残基天然二硫键的形成,导致胰岛素原在内质网的加工过程受阻,影响胰岛素的生成,生物信息软件预测也提示为有害突变。NDM可于婴儿期发病,临床表现具有隐匿性,因此对于婴儿期发现的血糖增高,需要注意此病,完善糖尿病相关基因检测有助于确诊。
PNDM需长期胰岛素治疗,但对于Km通道基因变异导致的PNDM,磺脲类药物治疗有效。本例患儿INS基因c.128G > A(p.C43Y)杂合突变,拟使用胰岛素治疗,但家属拒绝,给予口服格列苯脲,血糖控制欠佳。
本文报道1例11个月龄的NDM患儿,发现INS基因的1个新发突变c.128G > A,扩展了INS基因突变谱,为NDM病因诊断提供了新的依据。
| [1] |
巩纯秀, 曹冰燕. 新生儿糖尿病分子遗传学机制研究进展[J]. 中华实用儿科临床杂志, 2015, 30(20): 1521-1524. DOI:10.3760/cma.j.issn.2095-428X.2015.20.001 (  0) 0) |
| [2] |
Støy J, Edghill EL, Flanagan SE, et al. Insulin gene mutations as a cause of permanent neonatal diabetes[J]. Proc Natl Acad Sci U S A, 2007, 104(38): 15040-15044. DOI:10.1073/pnas.0707291104 (  0) 0) |
| [3] |
Park SY, Ye H, Steiner DF, et al. Mutant proinsulin proteins associated with neonatal diabetes are retained in the endoplasmic reticulum and not efficiently secreted[J]. Biochem Biophys Res Commun, 2010, 391(3): 1449-1454. DOI:10.1016/j.bbrc.2009.12.090 (  0) 0) |
| [4] |
Rajan S, Eames SC, Park SY, et al. In vitro processing and secretion of mutant insulin proteins that cause permanent neonatal diabetes[J]. Am J Physiol Endocrinol Metab, 2010, 298(3): E403-E410. DOI:10.1152/ajpendo.00592.2009 (  0) 0) |
| [5] |
Nour MA, Pacaud D. Height augmentation in 11β-hydroxylase deficiency congenital adrenal hyperplasia[J]. Int J Pediatr Endocrinol, 2015, 2015(1): 12. DOI:10.1186/s13633-015-0008-0 (  0) 0) |
| [6] |
许瑶, 王静. 新生儿糖尿病[J]. 浙江临床医学, 2016, 18(2): 378-380. (  0) 0) |
| [7] |
刘颖, 陶于洪. 新生儿糖尿病研究进展[J]. 国际儿科学杂志, 2011, 38(6): 606-608. DOI:10.3760/cma.j.issn.1673-4408.2011.06.024 (  0) 0) |
| [8] |
李灿, 刘丽梅. 胰岛素基因突变与糖尿病关系的研究进展[J]. 上海交通大学学报(医学版), 2013, 33(3): 354-358. DOI:10.3969/j.issn.1674-8115.2013.03.020 (  0) 0) |
| [9] |
于淼, 刘一静, 李明敏, 等. 永久性新生儿糖尿病30例临床特点及治疗反应分析[J]. 中国糖尿病杂志, 2013, 5(4): 209-211. (  0) 0) |
| [10] |
Liu M, Sun JH, Cui JQ, 等.胰岛素基因突变: 从遗传学和β细胞生物学到临床疾病[J].崔景秋, 刘铭, 译.国际内分泌代谢杂志, 2016, 36(2): 128-134. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=gwyx-nfmx201602013
(  0) 0) |
 2018, Vol. 20
2018, Vol. 20
