肢带型肌营养不良(limb-girdle muscular dystrophy, LGMD)表现为肩胛带肌及盆骨带肌等肢带肌进行性萎缩和无力,发病率1/20 000[1-2]。根据遗传方式的不同。分为常染色体显性遗传的LGMD1型和常染色体隐性遗传的LGMD2型,基因组测序技术使得超过30个亚型的肢带型肌营养不良被发现[3]。LGMD1B的发病机制与位于常染色体1q22的LMNA基因突变有关,导致其编码的Lamin A/C蛋白异常表达和稳定性改变,从而引发炎症反应、肌肉纤维化等,临床表现为迟发性近端肌肉受累以及与年龄相关的房室传导阻滞和扩张性心肌病[4]。LMNA基因突变也可引起多种其他临床表型如外周神经源性疾病、脂肪营养不良和早衰综合症[5]。迄今为止有超过400种LMNA基因突变形式被报道( http://www.umd.be/LMNA/),现报道1例由LMNA基因新发杂合突变c.810+2T>C所致的LGMD1B型患者。
1 资料与方法 1.1 研究对象患儿,男,4岁半,行走乏力2年。患儿2岁半开始出现行走乏力且进行性加重,步态呈鸭步,跑步不协调,不会跳和爬楼,起蹲困难。既往史无特殊。患儿系第一胎第一产,足月顺产出生,出生无窒息史。出生体重3 kg、身长48 cm。2个月会抬头,6个月能独坐,9个月会爬,13个月能够独立行走。家族中无类似患者。入院查体:一般情况可,神清,肩胛带肌和下肢近端肌肉无萎缩,无关节挛缩,上肢肌力4级、下肢肌力4级,四肢肌张力正常,Gower征(+),腹壁反射、提睾反射、膝腱反射、跟腱反射均正常,巴彬斯基征、戈登征未引出。实验室检查:肌酸激酶(CK)779 U/L(参考值:10~174 U/L),肌酸激酶同工酶(CK-MB)59 U/L(参考值:0~25 U/L);丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)均正常;肌电图未提示肌源性损害;心脏彩超未见异常。
1.2 基因检测及生物信息学分析取得知情同意后,采集患儿及其父母外周静脉血各2 mL,采用Qiagen FlexiGene DNA Kit的方法提取基因组DNA。应用二代测序(Illumina Hiseq 2000)对先证者进行包括258个肌营养不良相关致病基因的全部外显子及相邻内含子10 bp区域的检测,使用软件CASAVA将原始数据转化为可识别的碱基序列,行Align分析、SNP分析和DIP分析,获得靶向区域突变位点信息。所有的候选突变都经过SNP数据库(https://www.ncbi.nlm.nih.gov/snp/)和千人基因组计划(http://www.internationalgenome.org/)过滤掉多态性位点。对于在正常人群中出现率低但没有致病性报道的突变采用SIFT、PolyPhen-2、Mutation Taster软件预测致病意义。SIFT分值≤0.5说明突变可能有害(Deleterious),分值> 0.5提示可容忍变异(Tolerated)。PolyPhen-2分值≥0.909为很可能致病突变(Probably damaging),分值0.447~0.908为可能致病突变(Possibly damaging),分值≤0.446为良性突变(Benign)。Mutation Taster的结果分为polymorphism(多态性),polymorphism_automatic(突变在HapMap数据库中存在3种基因型AA、Aa、aa,或在1000 genomes数据库中纯合突变频数 > 4),disease_causing(致病突变)和disease_causing_automatic(突变在ClinVar数据库中标记为致病性或该变异是无义突变)。对于以上任一软件预测提示致病或可能致病且与临床表型相匹配的突变位点在先证者及其父母中应用Sanger测序进行验证。以上由北京康旭医学检验所有限公司提供技术支持。
采用Human Splice Finder(http://www.umd.be/HSF3/)、Spliceman(http://fairbrother.biomed.brown.edu/spliceman/)对筛选出的突变位点进行剪接预测分析。Human Splice Finder预测分值> 65提示可剪接。Spliceman预测分值越接近1,提示剪接改变的可能性越大[6]。采用GERP++RS软件对突变位点行序列保守性分析,根据文献[7],分值> 2提示该位点具有保守性。
1.3 肌肉活检患儿家长签署肌肉活检知情同意书。取患儿腓肠肌置于10%中性福尔马林固定,脱水后浸蜡包埋、切片,进行苏木素-伊红(HE)染色和抗Lamin A免疫组织化学染色。一抗为抗Lamin A鼠抗人单克隆抗体(Abcam公司,ab8980);二抗为HRP(辣根过氧化物酶)标记的Supervision TM鼠/兔通用检测系统(上海长岛抗体诊断试剂有限公司,D-3004)。具体步骤:(1)常规脱蜡:4 μm厚的切片65℃烘烤过夜(75℃烘烤2 h),环保脱蜡剂脱蜡,100%、100%、95%、85%、75%、50%的梯度酒精脱蜡至水,自来水冲洗。(2)抗原修复:胰蛋白酶37℃消化15 min。(3)阻断内源性过氧化物酶:置于蒸馏水新鲜配置的3% H2O2室温15 min,蒸馏水冲洗后PBS浸洗。(4)抗原抗体反应:滴加50 μL抗Lamin A(1 : 100稀释),37℃湿盒中孵育90 min,PBS充分浸洗3×3 min。滴加Supervision TM鼠/兔通用二抗检测系统,室温孵育20 min,PBS充分浸洗。(5)显色:新鲜配置DAB显色剂(1 : 20稀释),显微镜下观察显色效果,蒸馏水冲洗终止反应。(6)复染:苏木素复染30 s,自来水冲洗,1%盐酸酒精分化,自来水冲洗两次,饱和碳酸锂溶液返蓝,自来水冲洗。(7)脱水、透明、封片:切片分别于75%、85%、95%、100%、100%的酒精脱水,二甲苯透明,中性树胶封片。
1.4 转录组测序将活检的腓肠肌组织浸入RNA保存液,使用AxyPrep总RNA小量制备试剂盒提取总RNA,放置干冰送检。转录组测序由深圳承启生物科技有限公司协助完成。采用ExPASy(https://web.expasy.org/translate/)软件预测异常剪接变体氨基酸序列,根据与正常氨基酸序列的比对判定结果。
2 结果 2.1 基因检测及生物信息学分析结果在先证者外显子和剪接区共发现了424个突变位点,过滤掉399个SNP位点,排除4个同义突变位点,经PolyPhen-2、SIFT和Mutation Taster软件排除12个非致病性的突变位点,并根据临床表现排除8个基因突变位点,最终锁定1个LMNA基因的杂合突变c.810+2T > C,其父母该位点无异常。见图 1。该位点测序深度为57;该批次二代测序数据量:254M,覆盖度:1X,99.9%;10X:99.4%,30X:96.9%,Q30:93%,测序平台:NEXTSEQ500。

|
图 1 LMNA基因突变c.810+2T > C的Sanger测序验证 患儿LMNA基因存在c.810+2T > C剪接杂合突变,其父母该位点正常。突变位点如箭头所示。 |
GERP++RS软件对LMNA基因杂合突变c.810+2T > C保守性分析的分值为5.34,提示该位点具有高度保守性;Human Splicer Finder预测分值为65.25,提示突变导致该位点的剪接供体位点消失,其4号内含子5' 出现替代性剪接供体位点。Spliceman预测该突变位点发生剪接改变的可能性为71%。
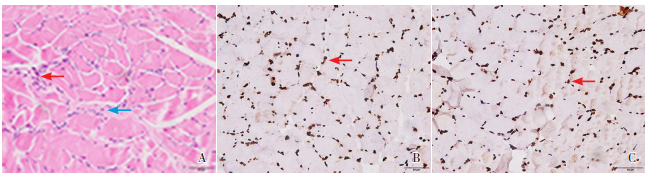
2.2 腓肠肌病理及抗Lamin A免疫组化先证者腓肠肌HE染色(图 2A)可见肌纤维直径大小不一,肌细胞核数量增多,结缔组织增生,符合肌营养不良改变。Lamin A蛋白免疫组织化学染色显示患者腓肠肌细胞核膜的Lamin A蛋白表达较正常人无明显差异,见图 2B、2C。
|
图 2 腓肠肌活检HE染色及抗Lamin A免疫组化(×400) 患儿腓肠肌HE染色(图A)示肌纤维大小不等,肌细胞核数量增加(红色箭头所示)、结缔组织增生(蓝色箭头所指),呈轻度肌营养不良表现。Lamin A蛋白在正常对照(图B)和患者(图C)肌细胞核膜的表达(红色箭头所示)无明显差异。 |
因Human Splicer Finder软件预测LMNA基因剪接位点突变可能导致mRNA的改变,使用整合基因组浏览器对患者及健康对照的腓肠肌组织标本进行转录组测序reads展示,结果提示患者肌肉mRNA存在两种序列:一种为正常序列,占92.2%;另一种为部分4号内含子保留,占7.8%,即存在异常剪接变体。见表 1。其4号内含子5' 端的145 bp保留序列为:gcgcttgctctcgattggttccctcactgcctctgcccttggcagccctacccttacccacgctgggctatgccttctggggatcaggcagatggtggcagggagctcagggtggcccaggacctggggctgtagcagtgatgcc。ExPASy预测提示:4号内含子保留的145 bp片段表达后,mRNA翻译至271位氨基酸时产生阅读框移码,至314位时终止翻译,产生比正常蛋白少350个氨基酸的截短蛋白。
| 表 1 正常对照及患者肌肉组织的转录组测序结果 |
|
|
肢带型肌营养不良1B型(LGMD1B)是由位于染色体1q22的LMNA基因突变所致的常染色体显性遗传性疾病,多在5~25岁起病,约半数在儿童期起病,多以对称的双下肢近端肌无力为首发表现,可出现鸭步和Gower征,CK正常或增高至正常水平的20倍,心功能异常在本型发生率较高,应注意LGMD1B患者突发心源性死亡的风险[8]。文献[9]报道最早出现心脏受累的LGMD1B患儿为8岁。Seong等[10]报道的1~7岁起病的6例LGMD1B患者均无心功能异常症状。本研究患者2岁半开始出现进行性加重的下肢近端肌无力,伴鸭步和轻度Gower征,CK达779 U/L,临床特点与文献相符。而且患儿腓肠肌病理HE染色显示肌纤维直径大小不一、肌纤维内细胞核数量增加,伴结缔组织增生,符合肌营养不良病理改变[11]。该患儿目前无心功能异常,应注意追踪。
LMNA基因编码Lamin A和Lamin C蛋白,它们互为异构蛋白组成A型核纤层蛋白,主要在细胞核膜表达,起着修复核膜、调节信号转导、基因调控等多种作用[2, 12]。基因突变形式、突变位点不同程度地影响Lamin A/C蛋白合成的数量或质量及其稳定性,导致肌肉结构破坏,引起不尽相同的临床表型。如LMNA基因c.777T > A(p.Y259X)纯合突变导致肌肉组织Lamin A/C蛋白表达缺失,LGMD1B患者在出生时即可因呼吸衰竭而死亡[13]。Geiger等[14]研究发现,存在LMNA基因c.963C > T(p.R321X)杂合突变的扩张型心肌病患者心肌组织和皮肤成纤维细胞的Lamin A/C蛋白表达无明显减少,但该突变导致mRNA异常(正常和异常mRNA比为304 : 1),异常mRNA在翻译过程中过早终止,产生的截短蛋白不具备正常功能,而且还可能干扰正常蛋白质的功能。提示Lamin A/C蛋白表达与突变类型有关,基因突变是否致病取决于突变是否引起蛋白的功能和结构异常。本研究患者也发现LMNA基因杂合突变,Lamin A蛋白表达虽无明显减少,但患者肌肉的mRNA存在异常剪接变体,因此致病,与文献相符。
迄今为止有超过400种的LMNA基因突变形式被报道。本研究患者LMNA基因存在新发突变:c.810+2T > C,GERP++RS软件分析提示该位点具有高度保守性;Spliceman预测该位点突变可能发生剪接改变,ExPASy预测新的剪接变体氨基酸序列变短;同时Human Splicer Finder软件预测提示该位点突变影响正常mRNA剪接;患者肌肉组织RNA转录组测序提示92.2%为正常序列,7.8%为内含子保留。证实了该突变可能具有致病性。
LMNA基因突变除了与肢带型肌营养不良1B型发病有关,也是Emery-Dreifuss肌营养不良2型、心手综合征Slovenian型、家族性部分性脂肪代谢障碍2型、Malouf综合征、先天性肌营养不良症、扩张型心肌病1A型、腓骨肌萎缩症2B1型、Emery-Dreifuss肌营养不良3型等疾病的致病基因[15]。而且不同类型的LMNA基因突变也可产生相似的临床表型,如Rogozhina等[16]报道的LGMD1B患者LMNA基因存在c.513+45 T > G杂合突变,临床表现为下肢和骨盆带肢肌无力伴有进行性心脏和神经肌肉传导障碍;Todorova等[17]报道的LGMD1B患者临床特点相似,但LMNA基因存在c.513G > A杂合突变。因此要结合患者临床资料进行基因型与表型的综合分析。
综上所述,LGMD1B是由位于常染色体1q22的LMNA基因突变所致的常染色体显性遗传性肌病,本研究报道的LMNA基因新发剪接杂合突变扩展了LMNA基因突变谱,为LGMD1B诊断提供了帮助。
| [1] |
Wicklund MP, Kissel JT. The limb-girdle muscular dystrophies[J]. Neurol Clin, 2014, 32(3): 729-749. DOI:10.1016/j.ncl.2014.04.005 (  0) 0) |
| [2] |
杨钊, 董继宏. 常染色体显性遗传性肢带型肌营养不良症研究进展[J]. 中国临床神经科学, 2016, 24(1): 84-88. (  0) 0) |
| [3] |
Thompson R, Straub V. Limb-girdle muscular dystrophies-international collaborations for translational research[J]. Nat Rev Neurol, 2016, 12(5): 294-309. DOI:10.1038/nrneurol.2016.35 (  0) 0) |
| [4] |
Muchir A, Bonne G, van der Kooi AJ, et al. Identification of mutations in the gene encoding lamins A/C in autosomal dominant limb girdle muscular dystrophy with atrioventricular conduction disturbances (LGMD1B)[J]. Hum Mol Genet, 2000, 9(9): 1453-1459. DOI:10.1093/hmg/9.9.1453 (  0) 0) |
| [5] |
Janin A, Bauer D, Ratti F, et al. SMAD6 overexpression leads to accelerated myogenic differentiation of LMNA mutated cells[J]. Sci Rep, 2018, 8(1): 5618. DOI:10.1038/s41598-018-23918-x (  0) 0) |
| [6] |
Lim KH, Fairbrother WG. Spliceman--a computational web server that predicts sequence variations in pre-mRNA splicing[J]. Bioinformatics, 2012, 28(7): 1031-1032. DOI:10.1093/bioinformatics/bts074 (  0) 0) |
| [7] |
Davydov EV, Goode DL, Sirota M, et al. Identifying a high fraction of the human genome to be under selective constraint using GERP++[J]. PLoS Comput Biol, 2010, 6(12): 1-13. (  0) 0) |
| [8] |
Worman HJ. Nuclear lamins and laminopathies[J]. J Pathol, 2011, 226(2): 316-325. (  0) 0) |
| [9] |
Mercuri E, Brown SC, Nihoyannopoulos P, et al. Extreme variability of skeletal and cardiac muscle involvement in patients with mutations in exon 11 of the lamin A/C gene[J]. Muscle Nerve, 2005, 31(5): 602-609. DOI:10.1002/(ISSN)1097-4598 (  0) 0) |
| [10] |
Seong MW, Cho A, Park HW, et al. Clinical applications of next-generation sequencing-based gene panel in patients with muscular dystrophy:Korean experience[J]. Clin Genet, 2016, 89(4): 484-488. DOI:10.1111/cge.2016.89.issue-4 (  0) 0) |
| [11] |
何展文, 曾乐翔, 刘木金, 等. 肌肉活检病理检查在小儿神经肌肉疾病中的应用[J]. 实用医学杂志, 2015, 31(23): 3918-3920. DOI:10.3969/j.issn.1006-5725.2015.23.033 (  0) 0) |
| [12] |
Maraldi NM, Capanni C, Cenni V, et al. Laminopathies and lamin-associated signaling pathways[J]. J Cell Biochem, 2011, 112(4): 979-992. DOI:10.1002/jcb.v112.4 (  0) 0) |
| [13] |
van Engelen BG, Muchir A, Hutchison CJ, et al. The lethal phenotype of a homozygous nonsense mutation in the lamin A/C gene[J]. Neurology, 2005, 64(2): 374-376. DOI:10.1212/01.WNL.0000149763.15180.00 (  0) 0) |
| [14] |
Geiger SK, Bar H, Ehlermann P, et al. Incomplete nonsense-mediated decay of mutant lamin A/C mRNA provokes dilated cardiomyopathy and ventricular tachycardia[J]. J Mol Med (Berl), 2008, 86(3): 281-289. DOI:10.1007/s00109-007-0275-1 (  0) 0) |
| [15] |
Rankin J, Ellard S. The laminopathies:a clinical review[J]. Clin Genet, 2006, 70(4): 261-274. DOI:10.1111/j.1399-0004.2006.00677.x (  0) 0) |
| [16] |
Rogozhina Y, Mironovich S, Shestak A, et al. New intronic splicing mutation in the LMNA gene causing progressive cardiac conduction defects and variable myopathy[J]. Gene, 2016, 595(2): 202-206. (  0) 0) |
| [17] |
Todorova A, Halliger-Keller B, Walter MC, et al. A synonymous codon change in the LMNA gene alters mRNA splicing and causes limb girdle muscular dystrophy type 1B[J]. J Med Genet, 2003, 40(10): e115. DOI:10.1136/jmg.40.10.e115 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


