急性肾损伤(acute kidney injury, AKI)是目前临床上最常见的疾病之一,发生率和病死率高,并有逐年增高的趋势,缺血再灌注损伤是其主要的发病原因之一[1-5]。目前研究发现肾小管上皮细胞紧密连接的破坏导致细胞凋亡、坏死、脱落,从而堵塞管腔,是AKI发生发展的重要机制[6-7]。紧密连接蛋白claudin-2、-10、-17是肾小管上皮细胞间紧密连接的重要组成部分,均在近端肾小管上皮细胞中表达丰富,对维持肾小管上皮细胞极性及调节离子渗透性发挥着重要的作用[8-10]。少量研究发现claudin-2与内毒素、重金属、环孢素A诱导的AKI密切相关[6, 11],本课题组前期研究发现在儿童AKI患者中,claudin-2蛋白质的表达水平与肾损伤程度呈负相关[12]。claudin-10虽在肾脏中的研究尚无文献报道,但Ohta等[13]在博来霉素诱导AKI研究中,发现claudin-10与肺损伤及修复有关,Laukoetter等[14]也发现肠壁功能的稳态和炎症程度与claudin-10的表达有密切的关系。目前关于claudin-17的研究鲜有报导,体外研究发现claudin-17能增加氯离子、碳酸氢根离子的通透性[15],是肾小管上皮细胞的阴离子通道[10]。但是,关于claudin-2、-10、-17是否参与AKI的发生、发展还有待研究。本课题通过夹闭小鼠双侧肾蒂30 min的方法建立缺血再灌注肾损伤模型,并采用RT-PCR和免疫组化方法分别检测小鼠肾组织中claudin-2、-10、-17 mRNA及蛋白质表达水平,旨在探讨紧密连接蛋白claudin-2、-10、-17在缺血再灌注肾损伤模型小鼠肾脏中的表达变化及意义。
1 材料与方法 1.1 实验动物及分组SPF级6~8周成年雄性C57BL/6J小鼠,体重20~25 g,许可编号为SCXK(湘)2009-0004,由湖南斯莱克景达实验动物有限公司提供。小鼠在正常实验室条件下饲养,自由饮水、进食,相对湿度50%~70%,室温20~22℃,采用功率为40 W定时照明设备,12 h/12 h昼夜循环。定期检查小鼠健康状况。采用随机数字表法将152只小鼠随机分为对照组(n=8)、假手术组(n=72)和模型组(n=72)。除对照组外,其余两组依据再灌注时间点分为9个亚组(0、3、6、12、24、48、72 h,以及5 d、7 d),每个亚组8只小鼠。
1.2 主要试剂免疫组化检测试剂盒、DAB显色试剂盒购自北京中杉金桥生物技术有限公司;claudin-2、-10、-17抗体由巴傲得生物科技有限公司(南京)生产;逆转录试剂盒由宝生物工程(大连)有限公司提供;所有引物由上海生物工程技术有限责任公司合成。
1.3 动物模型缺血再灌注肾损伤模型的建立参考文献[16]:模型组小鼠麻醉后,腹部正中切口,游离双侧肾蒂,用无损伤动脉夹持续夹闭双侧肾蒂30 min后,松开动脉夹,恢复灌注,关腹。假手术组按上述方法暴露双侧肾蒂,但不夹闭肾蒂。对照组不进行任何处理。所有动物实验操作均严格遵循科技部《关于善待实验动物的指导性意见》。
1.4 血尿素氮、血肌酐及肾脏病理检测经腹主动脉取血0.5 mL,标本经3 000 r/min离心5 min,留血清,-70℃保存。全自动生化仪酶法检测血尿素氮和肌酐。肾组织经4%多聚甲醛固定、石蜡包埋、切片、苏木精-伊红(HE)染色,光镜下观察肾组织病理变化,采用盲法,由两名有经验的肾脏病理医师评估肾损伤程度,每张切片在200倍光镜下随机选取皮髓质交接部10个不重叠视野观察肾脏病理损害并评分,评分越高,肾脏损伤越重。
1.5 免疫组化法检测肾组织claudin-2、-10、-17蛋白表达采用免疫组化二步法,参考免疫组化检测试剂盒说明书操作,所用一抗为兔抗鼠claudin-2或claudin-10或claudin-17多克隆抗体工作液,以PBS缓冲液代替抗体为空白对照,经二氨基联苯胺(DAB)显色,苏木素复染,脱水,透明,中性树胶封片,镜下观察(阳性表达呈黄色或棕黄色)。应用Image-proplus 6.0医学图像分析系统(美国Media Cybemetics公司)计算平均光密度值(average optical density, AOD)。
1.6 RT-PCR法检测肾组织claudin-2、-10、-17 mRNA的表达按TRIzol试剂说明书抽提肾组织总RNA,用紫外线分光光度仪鉴定mRNA浓度和纯度,根据所测浓度加入DEPC水稀释成0.5 g/L质量浓度,保存于-80℃中。应用TaKaRa公司RT-PCR扩增试剂盒扩增目的基因。各基因引物序列见表 1。PCR反应体系(25 μL):cDNA模板2 μL,10×PCR Buffer 2.5 μL(Mg2+Free),dNTP Mixture 2 μL,Taq酶0.125 μL,Mg2+ 1.5 μL,上、下游引物各0.5 μL,dH2O 15.875 μL。在梯度PCR仪(Veriti 96,美国ABI公司)上进行PCR反应,PCR反应条件:94℃预变性5 min;然后按94℃ 30 s,55℃ 30 s,72℃ 2 min,共35个循环;最后74℃延伸10 min。反应产物4℃保存。PCR产物进行电泳、摄像,DRAFT-alphaview软件分析图像中的条带灰度。将各组目的基因条带灰度值分别与相应组内参基因GAPDH条带灰度值相比较,得到的比值即为各组目的基因mRNA的相对表达量。
| 表 1 claudin-2、-10、-17及GAPDH引物的正反义序列 |
|
|
采用SPSS 18.0统计软件对数据进行统计学分析。计量资料采用均数±标准差(x±s)表示,两组数据比较采用t检验,多组资料的比较采用单因素方差分析,组间两两比较采用SNK-q法。P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠肾组织病理损伤及肾功能变化模型组小鼠肾组织病理损伤随缺血再灌注时间的推移逐渐加重,至24 h达高峰,见肾小管上皮细胞肿胀、变性,部分肾小管上皮细胞刷状缘脱落,管腔扩张,部分肾小管上皮细胞坏死、脱落,肾小管基膜裸露(图 1);再灌注5 d、7 d,小鼠肾组织病理改变明显减轻(表 2)。模型组小鼠血尿素氮、肌酐水平在缺血再灌注后逐渐升高,于再灌注后24 h达到峰值,之后逐渐降低,见表 3~4。
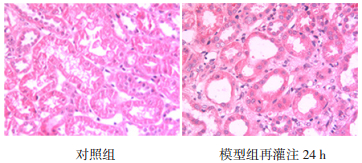
|
图 1 缺血再灌注肾损伤病理变化 对照组小鼠肾小管上皮细胞呈单层柱状上皮细胞排列,间质无水肿、无炎性细胞浸润。模型组小鼠肾脏缺血再灌注24 h时,发生肾间质水肿,散在炎性细胞浸润,肾小管上皮细胞脱落,管腔扩张。 |
| 表 2 各组小鼠肾组织损伤病理评分比较 (n=8,x±s) |
|
|
| 表 3 各组小鼠血尿素氮水平比较 (n=8,x±s,mmol/L) |
|
|
| 表 4 各组小鼠血肌酐水平比较 (n=8,x±s,mmol/L) |
|
|
Claudin-2蛋白表达于近端肾小管上皮细胞,分布于细胞胞膜顶端及相邻细胞侧,呈规则的栅栏样均匀连续排列,在细胞胞浆中少量表达。模型组小鼠肾组织claudin-2在肾小管上皮细胞胞膜上的分布较稀疏且排列紊乱,在胞浆中的表达增加;claudin-2的阳性表达信号在再灌注3 h时上调,可能是对早期缺血再灌注的应激反应所致;随后逐渐下降,至再灌注24 h时达最低值,随后表达水平逐渐回升(P < 0.05)。见图 2,表 5。

|
图 2 各组小鼠肾组织claudin-2蛋白表达(免疫组化,×400) 对照组claudin-2表达于近端肾小管上皮细胞胞膜,呈规则的栅栏样均匀连续排列,细胞胞浆中少量表达;模型组claudin-2在肾小管上皮细胞胞膜上表达降低且排列紊乱,以再灌注24 h最为显著。claudin-2蛋白阳性表达呈棕色。 |
| 表 5 各组小鼠肾组织claudin-2蛋白表达水平比较 (n=8,x±s) |
|
|
模型组小鼠肾组织claudin-2 mRNA表达水平随着再灌注时间的推移其表达水平逐渐减弱,再灌注24 h时达到最低水平,随后表达水平逐渐回升(P < 0.05)。见图 3,表 6。

|
图 3 RT-PCR法检测各组小鼠肾组织claudin-2 mRNA表达 M:Marker;1~9分别为再灌注0、3、6、12、24、48、72 h,以及5 d、7 d。 |
| 表 6 各组小鼠肾组织claudin-2 mRNA表达水平比较 (n=8,x±s) |
|
|
Claudin-10蛋白在小鼠近端肾小管上皮细胞呈阳性表达,主要表达于细胞胞膜顶端及相邻细胞侧,在细胞胞浆内少许表达。模型组小鼠肾组织claudin-10蛋白分布发生改变,在细胞胞浆中分布增多,细胞胞膜中分布减少。claudin-10的阳性表达信号随着再灌注时间的推移其表达水平逐渐减弱,再灌注24 h时达到最低水平,随后表达水平逐渐回升(P < 0.05)。见图 4,表 7。
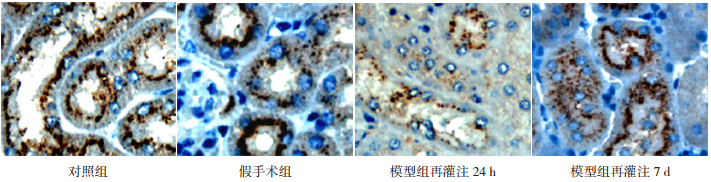
|
图 4 各组小鼠肾组织claudin-10蛋白表达(免疫组化,×400) 对照组和假手术组claudin-10主要表达于细胞胞膜,在细胞胞浆内少量表达。模型组claudin-10在细胞胞浆中分布增多,细胞胞膜分布减少,再灌注24 h时,claudin-10阳性表达最弱。claudin-10蛋白阳性表达呈棕色。 |
| 表 7 各组小鼠肾组织claudin-10蛋白表达水平比较 (n=8,x±s) |
|
|
模型组小鼠肾组织claudin-10 mRNA表达水平从再灌注后3 h开始逐渐下调,至12 h时表达最低(P < 0.05),与24 h比较差异无统计学意义(P < 0.05),随后表达水平逐渐回升(P < 0.05)。见图 5,表 8。
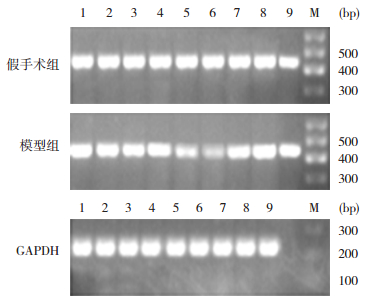
|
图 5 RT-PCR法检测各组小鼠肾组织claudin-10 mRNA表达 M:Marker;1~9分别为再灌注0、3、6、12、24、48、72 h,以及5 d、7 d。 |
| 表 8 各组小鼠肾组织claudin-10 mRNA表达水平比较 (n=8,x±s) |
|
|
Claudin-17蛋白在小鼠近端肾小管上皮细胞表达丰富,在肾小球及髓袢有少量的表达,在远曲小管没有发现其阳性表达。模型组小鼠肾组织claudin-17蛋白从再灌注3 h开始其表达水平逐渐上调,至再灌注24 h时达到最高值,随后表达水平逐渐下调(P < 0.05)。见图 6,表 9。
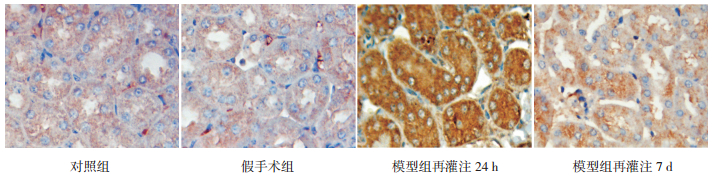
|
图 6 各组小鼠肾组织claudin-17蛋白表达(免疫组化,×400) 对照组和假手术组claudin-17在近端肾小管上皮细胞表达丰富。模型组claudin-17在缺血再灌注后肾小管上皮细胞表达增强,再灌注24 h时,claudin-17阳性表达最强。claudin-17蛋白阳性表达呈棕色。 |
| 表 9 各组小鼠肾组织claudin-17蛋白表达水平比较 (n=8,x±s) |
|
|
模型组小鼠肾组织claudin-17 mRNA表达水平从再灌注3 h开始逐渐上调,至再灌注12 h时达到最高值,之后逐渐回落(P < 0.05),见图 7,表 10。
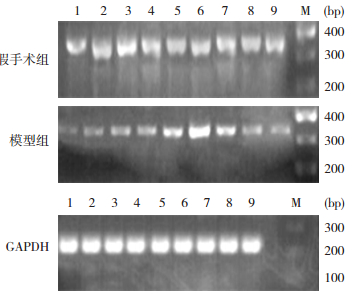
|
图 7 RT-PCR检测各组小鼠肾组织claudin-17 mRNA表达 M:Marker;1~9分别为再灌注0、3、6、12、24、48、72 h,以及5 d、7 d。 |
| 表 10 各组小鼠肾组织claudin-17 mRNA表达水平比较 (n=8,x±s) |
|
|
Claudins蛋白作为紧密连接的骨架,表达异常可使细胞功能出现障碍,从而导致疾病的发生,如家族型高尿钙、低血镁性肾钙质沉着病,多囊肾等[8-9, 17-19]。但目前关于紧密连接蛋白与AKI的关系尚不清楚,因此,本研究选择了在近端肾小管上皮细胞中表达丰富的claudin-2、-10、-17进行研究。本研究通过建立小鼠缺血再灌注肾损伤模型,观察再灌注后肾组织claudin-2、-10、-17蛋白及其mRNA水平的变化。
Claudin-2是近端肾小管紧密连接蛋白的主要组成部分,对维持细胞内环境的稳定起着重要的作用[9, 12, 20]。Kieran等[21]夹闭小鼠双侧肾蒂30 min,然后再灌注24 h取小鼠肾组织,进行微阵列基因芯片分析显示claudin-2显著下调。本课题组前期研究发现[12],在儿童急性肾损伤肾组织中,claudin-2蛋白质水平不仅表达异常,且发现与肾损伤程度呈负相关。本研究进一步证实了随肾脏病理损伤逐渐加重,claudin-2的蛋白及其mRNA水平逐渐下调,至再灌注后24 h,肾脏病理损伤最重时,claudin-2表达水平最低,随后肾脏病理损伤逐渐减轻,claudin-2逐渐回升。同时,本研究还发现,正常肾组织中claudin-2呈规则的栅栏样均匀连续排列,缺血再灌注后,栅栏样结构逐渐遭到破坏,至24 h栅栏样结构消失,提示在缺血再灌注后claudin-2的分布发生了改变,可能会导致细胞功能的失调。
Claudin-10在肾组织中表达丰富,对调节离子渗透性起着重要的作用[22]。近期研究发现claudin-10与多种疾病有着密切的关系,Gao等[22]发现claudin-10与胃癌密切相关,Ohta等[13]在博来霉素诱导的肺损伤小鼠模型中发现claudin-10蛋白表达显著下调,证明了肺脏病理损伤的严重程度与claudin-10表达水平相关。本研究发现肾脏缺血再灌注后,随着肾脏病理损伤逐渐加重,claudin-10蛋白及其mRNA水平均逐渐下调,至再灌注后24 h,肾脏病理损伤最重时,claudin-10表达水平最低,随后肾脏病理损伤逐渐减轻,claudin-10逐渐回升。
近期研究发现claudin-17在肾脏表达丰富,尤其在近端肾小管,能形成阴离子通道[10, 15]。但目前还没有文献报道claudin-17与肾脏疾病相关。本研究从蛋白质和基因水平分析了claudin-17在肾缺血再灌注中的表达变化,结果表明,claudin-17蛋白及其mRNA表达在再灌注后逐渐上调,再灌注后其蛋白在24 h及其mRNA在12 h表达最高,随后逐渐下调。由此可见,claudin-17在mRNA水平与在蛋白水平的表达趋势基本上是一致的。
综上所述,claudin-2、-10、-17与缺血再灌注AKI密切相关,但是其与AKI的关系尚需进一步研究,紧密连接蛋白claudin-2、-10、-17有可能成为研究AKI的新的亮点,也可能为将来AKI的治疗提供新的靶点。
| [1] |
Mehta RL, Cerdá J, Burdmann EA, et al. International Society of Nephrology's 0 by 25 initiative for acute kidney injury (zero preventable deaths by 2025):a human rights case for nephrology[J]. Lancet, 2015, 385(9987): 2616-2643. DOI:10.1016/S0140-6736(15)60126-X (  0) 0) |
| [2] |
Selby NM, Fluck RJ, Kolhe NV, et al. International criteria for acute kidney injury:advantages and remaining challenges[J]. PLoS Med, 2016, 13(9): e1002122. DOI:10.1371/journal.pmed.1002122 (  0) 0) |
| [3] |
Yang L, Xing G, Wang L, et al. Acute kidney injury in China:a cross-sectional survey[J]. Lancet, 2015, 386(10002): 1465-1471. (  0) 0) |
| [4] |
Pressly JD, Park F. DNA repair in ischemic acute kidney injury[J]. Am J Physiol Renal Physiol, 2017, 312(4): F551-F555. DOI:10.1152/ajprenal.00492.2016 (  0) 0) |
| [5] |
Zuk A, Bonventre JV. Acute kidney injury[J]. Annu Rev Med, 2016, 67: 293-307. DOI:10.1146/annurev-med-050214-013407 (  0) 0) |
| [6] |
Eadon MT, Hack BK, Xu C, et al. Endotoxemia alters tight junction gene and protein expression in the kidney[J]. Am J Physiol Renal Physiol, 2012, 303(6): F821-F830. DOI:10.1152/ajprenal.00023.2012 (  0) 0) |
| [7] |
Hou J. The kidney tight junction[J]. Int J Mol Med, 2014, 34(6): 1451-1457. DOI:10.3892/ijmm.2014.1955 (  0) 0) |
| [8] |
Krug SM, Schulzke JD, Fromm M. Tight junction, selective permeability, and related diseases[J]. Semin Cell Dev Biol, 2014, 36: 166-176. DOI:10.1016/j.semcdb.2014.09.002 (  0) 0) |
| [9] |
Krug SM, Günzel D, Conrad MP, et al. Claudin-17 forms tight junction channels with distinct anion selectivity[J]. Cell Mol Life Sci, 2012, 69(16): 2765-2778. DOI:10.1007/s00018-012-0949-x (  0) 0) |
| [10] |
Reyes JL, Molina-Jijón E, Rodríguez-Muñoz R, et al. Tight junction proteins and oxidative stress in heavy metals-induced nephrotoxicity[J]. Biomed Res Int, 2013, 2013: 730-789. (  0) 0) |
| [11] |
Trujillo J, Molina-Jijón E, Medina-Campos ON, et al. Renal tight junction proteins are decreased in cisplatin-induced nephrotoxicity in rats[J]. Toxicol Mech Methods, 2014, 24(7): 520-528. DOI:10.3109/15376516.2014.948248 (  0) 0) |
| [12] |
张良, 李志辉, 邓旭, 等. 紧密连接蛋白claudin-2在急性肾损伤患儿肾组织中的表达及意义[J]. 中国当代儿科杂志, 2014, 16(4): 361-365. (  0) 0) |
| [13] |
Ohta H, Chiba S, Ebina M, et al. Altered expression of tight junction molecules in alveolar septa in lung injury and fibrosis[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 302(2): L193-L205. DOI:10.1152/ajplung.00349.2010 (  0) 0) |
| [14] |
Laukoetter MG, Nava P, Lee WY, et al. JAM-A regulates permeability and inflammation in the intestine in vivo[J]. J Exp Med, 2007, 204(13): 3067-3076. DOI:10.1084/jem.20071416 (  0) 0) |
| [15] |
Krug SM, Günzel D, Conrad MP, et al. Claudin-17 forms tight junction channels with distinct anion selectivity[J]. Cell Mol Life Sci, 2012, 69(16): 2765-2778. DOI:10.1007/s00018-012-0949-x (  0) 0) |
| [16] |
Li Z, Deng X, Kang Z, et al. Elevation of miR-21, through targeting MKK3, may be involved in ischemia pretreatment protection from ischemia-reperfusion induced kidney injury[J]. J Nephrol, 2016, 29(1): 27-36. DOI:10.1007/s40620-015-0217-x (  0) 0) |
| [17] |
Yamaguti PM, Dos Santos PA, Leal BS, et al. Identification of the first large deletion in the CLDN16 gene in a patient with FHHNC and late-onset of chronic kidney disease:case report[J]. BMC Nephrol, 2015, 16(1): 92. DOI:10.1186/s12882-015-0079-4 (  0) 0) |
| [18] |
Krug SM, Schulzke JD, Fromm M. Tight junction, selective permeability, and related diseases[J]. Semin Cell Dev Biol, 2014, 36: 166-176. DOI:10.1016/j.semcdb.2014.09.002 (  0) 0) |
| [19] |
Gong Y, Yu M, Yang J, et al. The Cap1-claudin-4 regulatory pathway is important for renal chloride reabsorption and blood pressure regulation[J]. Proc Natl Acad Sci U S A, 2014, 111(36): E3766-E3774. DOI:10.1073/pnas.1406741111 (  0) 0) |
| [20] |
Schnermann J, Huang Y, Mizel D. Fluid reabsorption in proximal convoluted tubules of mice with gene deletions of claudin-2 and/or aquaporin1[J]. Am J Physiol Renal Physiol, 2013, 305(9): 1352-1364. DOI:10.1152/ajprenal.00342.2013 (  0) 0) |
| [21] |
Kieran NE, Doran PP, Connolly SB, et al. Modification of the transcriptomic response to renal ischemia/reperfusion injury by lipoxin analog[J]. Kidney Int, 2003, 64(2): 480-492. DOI:10.1046/j.1523-1755.2003.00106.x (  0) 0) |
| [22] |
Gao M, Li W, Wang H, et al. The distinct expression patterns of claudin-10, -14, -17 and E-cadherin between adjacent non-neoplastic tissues and gastric cancer tissues[J]. Diagn Pathol, 2013, 8: 205. DOI:10.1186/1746-1596-8-205 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20

