β地中海贫血(简称β地贫)是由于位于第11号染色体的β-珠蛋白基因决定簇发生点突变或缺失导致β-珠蛋白肽链合成部分减少(β+)或缺失(β0)以及α/β链比例失衡而产生的溶血性贫血,是我国南方最常见的单基因遗传病[1-2]。β地贫基因携带者只涉及一个β珠蛋白基因缺陷,有一个正常的β珠蛋白基因,能够合成β-珠蛋白链,多无临床症状,但在新生儿期和儿童期可能于某些诱因下出现急性溶血发作而影响生长发育。目前对于新生儿期β地贫基因携带者的筛查缺乏有效指标,以血常规参数作为初筛指标灵敏度及特异度不高[3];胎儿或新生儿脐带血的HbA亦可辅助筛查β地贫基因携带者,但HbA的含量存在出生胎龄依赖性,而实验室通常使用单一的HbA水平作为截断值,灵敏度较差[4-6]。本研究对进行β地贫筛查的1 193例足月新生儿进行回顾性分析,探讨足月新生儿β地贫基因携带的筛查方法。
1 资料与方法 1.1 研究对象以2013年1月至2017年7月柳州市妇幼保健院新生儿疾病筛查中心进行β地贫筛查,并排除了中重度β地贫、伴有其它异常血红蛋白、采集标本前已行输血以及出生资料不全的1 193例足月新生儿为研究对象。
1 193例中β地贫基因携带者638例,基因阴性的555例。HbA2为0的637例中根据基因检测结果分为β地贫基因携带组(310例)、基因阴性组(327例);HbA2不为0的556例中β地贫基因携带组328例,基因阴性组228例。
1.2 β-地中海贫血筛查出生72 h后采集足跟血,滴于S & S903新生儿筛查专用滤纸,5个工作日内送检,使用CAPILLARYS 2 NEONAT FAST全自动毛细管电泳技术进行血红蛋白分析。使用深圳益生堂生物企业有限公司β地贫基因检测试剂盒检测中国人群常见的17种β珠蛋白基因突变。
1.3 统计学分析采用SPSS 20.0和MedCal 3.0软件进行数据处理。正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用两独立样本t检验;非正态分布的计量资料采用中位数四分位数[P50(P25,P75)]表示,组间比较采用Mann-Whitney U检验。计数资料以率(%)表示,两组间比较采用χ2检验。并进行筛查指标与β地贫基因携带的logistic回归分析;以及筛查指标对β地贫基因携带诊断的受试者工作特征曲线(receiver operating characteristic curve, ROC)分析。P < 0.05为差异有统计学意义。
2 结果 2.1 β地贫基因携带与基因阴性组新生儿的比较HbA2为0时,β地贫基因携带组与基因阴性组在性别、出生胎龄及体重方面的差异无统计学意义(P > 0.05),β地贫基因携带组的HbA含量较低、HbF含量较高(P < 0.01),见表 1。HbA2不为0者,β地贫基因携带组与基因阴性组在性别、出生胎龄、体重及HbA2含量方面的差异无统计学意义(P > 0.05),β地贫基因携带组的HbA含量较低、HbF及HbA2/HbA比较高(P < 0.01),见表 2。
| 表 1 HbA2为0者β地贫基因携带与基因阴性组的比较 |
|
|
| 表 2 HbA2不为0者β地贫基因携带与基因阴性组的比较 |
|
|
因HbA与HbF具有共线性,本研究纳入更常用的HbA。据文献[7-8]新生儿HbA的含量与胎龄有相关性,因此将HbA、HbA2/HbA比及出生胎龄纳入回归分析,结果显示:对于HbA2为0的足月新生儿,出生胎龄及HbA可作为筛查β地贫基因携带的指标;HbA2不为0者,HbA和HbA2/HbA比可作为β地贫的筛查指标。见表 3。
| 表 3 筛查指标与β地贫基因携带相关性的logistic回归分析 |
|
|
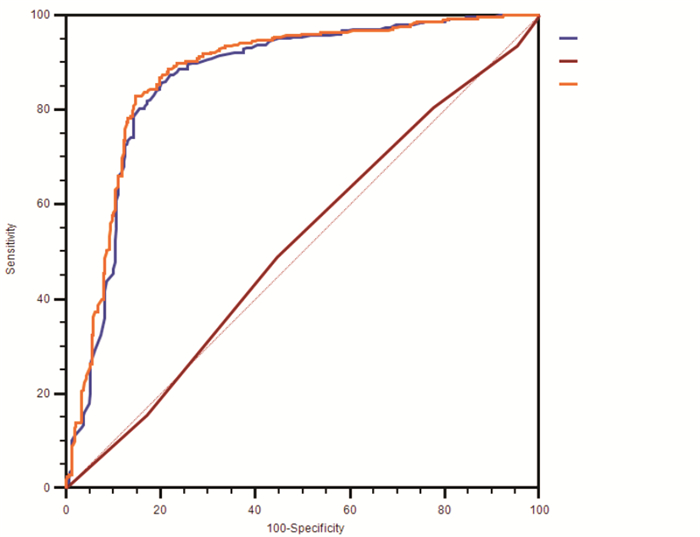
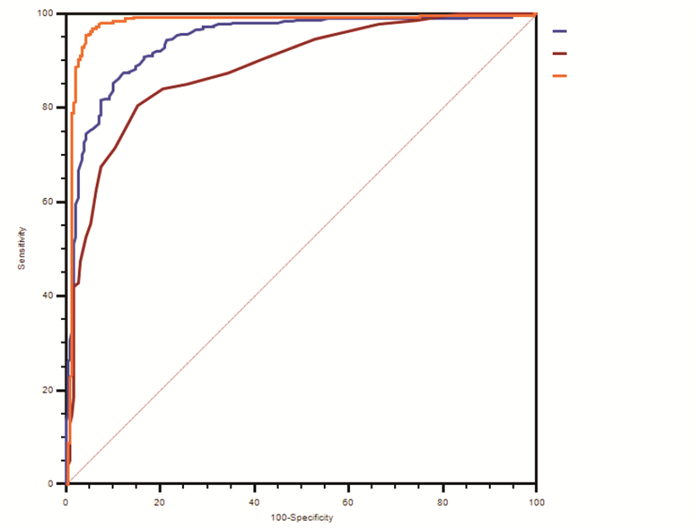
HbA2为0者,HbA、出生胎龄及两者联合对β地贫基因携带诊断的ROC曲线分析的AUC分别为0.865、0.515、0.870,其中HbA及HbA联合出生胎龄的AUC相近,均具有诊断意义(P < 0.01);HbA2不为0者,HbA、HbA2/HbA及两者联合对β地贫基因携带诊断的ROC曲线分析的AUC分别为0.943、0.885、0.978(P < 0.01),以HbA与HbA2/HbA联合的AUC最大。见图 1、图 2。
|
图 1 HbA2为0者筛查指标对β地贫基因携带诊断的ROC曲线分析 |
|
图 2 HbA2不为0者筛查指标对β地贫基因携带诊断的ROC曲线分 |
HbA2为0者,HbA的最佳cut-off值为≤11.6%,灵敏度85.81%、特异度79.82%;HbA2不为0者,HbA为16.1%~22.0%、HbA2/HbA比 > 1.4对β地贫基因携带诊断ROC曲线的AUC最大,灵敏度91.38%、特异度91.89%。见表 4。
| 表 4 筛查指标对β地贫基因携带诊断的ROC曲线分析的cut-off值 |
|
|
β地贫是由于β珠蛋白基因发生缺失或突变,导致β肽链合成减少,因此HbA(α2β2)含量降低而HbF、HbA2含量相对增加的一种遗传性溶血性贫血。β地贫基因携带者通常无临床症状,只涉及到一个β珠蛋白基因缺陷。目前国内β地贫基因检测多采用多重PCR体系扩增结合膜反向杂交技术,检测中国人群的8个常见位点和9个少见位点突变,覆盖了99%的常见β地贫基因突变。对于大片段缺失和重复的β地贫基因位点或罕见点突变,必需通过其它检测技术,如多重连接依赖性探针扩增技术或Sanger测序[9-10]。但这些检测技术要求高,仪器昂贵,结果判读难度大,限制了其在基层医疗单位的应用。初生新生儿HbF(α2γ2)约占70%、HbA(α2β2)约30%、HbA2(α2δ2)不到1%;随着胎龄增加,β肽链合成增加、γ肽链合成减少,因此HbA含量逐渐增加、HbF逐渐减少。Mantikou[7]、周曼等[8]研究指出,因HbA含量与出生胎龄相关,早产儿进行β地贫筛查时应使用相应胎龄的HbA切值[11]。足月新生儿HbA的含量相对稳定,采用HbA进行β地贫筛查发现:携带β地贫基因的足月新生儿HbA水平低于正常新生儿[7, 12-13]。本研究携带β地贫基因的足月新生儿HbA含量也减低,提示HbA可能作为足月新生儿β地贫基因携带的筛查指标。
有研究[14]认为HbA2/HbA用于新生儿β地贫基因携带筛查可提高灵敏度。本研究发现,HbA2不为0者,HbA与HbA2/HbA联合对β地贫基因携带诊断的AUC更大,提示HbA2/HbA用于新生儿β地贫基因携带筛查可提高灵敏度,与文献相符。而且本研究进一步得出对于HbA2为0者,HbA为11.6%时对β地贫基因携带诊断的灵敏度为85.81%、特异度79.82%;HbA2不为0者,HbA(cut-off 16.1%~22.0%)联合HbA2/HbA(cut-off > 1.4)对β地贫基因携带诊断的灵敏度达91.38%、特异度91.89%。
综上,HbA及HbA2/HbA是筛查足月新生儿β地贫基因携带的有效指标,但要实现其临床应用尚需要进一步开展多中心大样本研究。
| [1] |
Xu XM, Zhou YQ, Luo GX, et al. The prevalence and spectrum of α and β thalassaemia in Guangdong province:implications for the future health burden and population screening[J]. J Clin Pathol, 2004, 57(5): 517-522. DOI:10.1136/jcp.2003.014456 (  0) 0) |
| [2] |
蔡稔, 李莉艳, 梁昕, 等. 柳州市城镇人群α和β地中海贫血的发生率调查和基因型鉴定[J]. 中华流行病学杂志, 2002, 23(4): 281-285. DOI:10.3760/j.issn:0254-6450.2002.04.011 (  0) 0) |
| [3] |
王偲颖, 方星, 韩媛媛, 等. 脐血红细胞参数MCV和HbA定量对新生儿β-地中海贫血筛查的意义[J]. 中国妇幼保健, 2016, 31(22): 4803-4805. (  0) 0) |
| [4] |
林乘龙, 葛艳芬, 王景健, 等. 不同孕周胎儿脐血血红蛋白A相对含量比较[J]. 中国妇幼保健, 2017, 32(12): 2687-2689. (  0) 0) |
| [5] |
万志丹, 黄湘, 钟裕恒, 等. 滤纸干血片毛细管电泳技术检测HbA在筛查新生儿β-地中海贫血中的应用价值[J]. 检验医学, 2017, 32(12): 1128-1131. DOI:10.3969/j.issn.1673-8640.2017.12.013 (  0) 0) |
| [6] |
郭浩, 杜丽, 唐斌, 等. 脐血血红蛋白电泳在新生儿地中海贫血筛查中的应用[J]. 实用医学杂志, 2014, 30(12): 1953-1955. DOI:10.3969/j.issn.1006-5725.2014.12.031 (  0) 0) |
| [7] |
Mantikou E, Arkesteijn SG, Beckhoven van JM, et al. A brief review onnewborn screening methods for hemoglobinopathies and preliminary results selecting beta thalassemia carriers at birth by quantitative estimation of the HbA fraction[J]. Clin Biochem, 2009, 42(8): 1780-1785. (  0) 0) |
| [8] |
周曼, 刘启英, 赵钿, 等. 不同孕周新生儿脐血血红蛋白电泳结果分析[J]. 天津医药, 2013, 41(4): 307-309. DOI:10.3969/j.issn.0253-9896.2013.04.006 (  0) 0) |
| [9] |
郝颖, 徐晓昕, 徐志勇, 等. 多重连接依赖性探针扩增技术在α地中海贫血产前诊断中的应用[J]. 中华医学遗传学志, 2015, 32(5): 683-686. (  0) 0) |
| [10] |
Kubikova N, Babariya D, Sarasa J, et al. Clinical application of a protocol based on universal next-generation sequencing for the diagnosis of beta-thalassaemia and sickle cell anaemia in preimplantation embryos[J]. Reprod Biomed Online, 2018, 37(2): 136-144. DOI:10.1016/j.rbmo.2018.05.005 (  0) 0) |
| [11] |
杨金玲, 陈大宇, 谭建强, 等. 早产儿β地中海贫血筛查分析[J]. 中国儿童保健杂志, 2018, 26(5): 468-471. (  0) 0) |
| [12] |
Giordano PC. Newborn screening for hemoglobinopathies using capillary electrophoresis[J]. Methods Mol Biol, 2013, 919: 131-145. DOI:10.1007/978-1-62703-029-8 (  0) 0) |
| [13] |
Mantikou E, Harteveld CL, Giordano PC. Newborn screening for hemoglobinopathies using capillary electrophresis technology:Testing the capillarys neonat fast Hb device[J]. Clin Biochem, 2010, 43(16-17): 1345-1350. DOI:10.1016/j.clinbiochem.2010.06.009 (  0) 0) |
| [14] |
黄烁丹, 张惠琴, 邹婕, 等. 新生儿干血斑β地中海贫血筛查方法的研究[J]. 中国实验诊断学, 2015, 19(4): 582-586. (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


