脓毒性休克是重症监护室儿童死亡的主要原因之一。它主要由感染诱导,是全身炎症反应综合征不断加剧恶化导致组织低灌注和心血管功能障碍的结果[1]。早期识别、及时诊断、尽早治疗是改善脓毒性休克预后、降低病死率的关键。当确诊为脓毒性休克时,应立即给予充分的液体复苏,以提高循环血容量,改善组织器官缺血缺氧。经过充分的液体复苏仍然存在难以纠正的低血压或者低灌注时,可以考虑使用血管活性药物改善组织灌注状态[2]。血管活性药评分(vasoactive-inotropic score, VIS)使用系数将所用血管活性药物进行整合,并赋予相应权重,是评估血管活性药物对心血管系统支持作用的一个有效指标[3-4]。研究发现VIS与脓毒性休克患儿病死率具有相关性[5]。但国内关于VIS与脓毒性休克预后关系的研究较少,并且对于脓毒性休克预后具有预测意义的VIS临界值也存在着争议。本文对VIS与脓毒性休克患儿的预后关系进行回顾性研究,希望能够为脓毒性休克的治疗及预后评估提供参考。
1 资料与方法 1.1 研究对象以2011年1月至2016年12月重庆医科大学附属儿童医院重症监护室使用血管活性药物治疗、资料完整的117例失代偿型脓毒性休克患儿为研究对象。失代偿型脓毒性休克的诊断参考《儿科感染性休克(脓毒性休克)诊疗推荐方案》[6]及《严重脓毒症与脓毒性休克治疗国际指南》[7]。纳入标准包括:(1)年龄1个月至18岁;(2)使用血管活性药物的时间≥24 h。排除标准:(1)放弃治疗的患儿;(2)资料不全;(3)确诊有遗传代谢性疾病。所有研究对象除接受充分液体复苏、积极抗感染、脏器功能保护以及营养支持外,均接受血管活性药物治疗,部分患儿还接受了机械通气、血液净化、肾上腺皮质激素等对症支持治疗。
1.2 资料收集收集患儿的基本信息:包括性别、年龄、体重、感染部位、血培养结果、PRISM Ⅲ评分、治疗效果、住院时间、PICU停留时间、血管活性药物使用时间、机械通气时间以及激素、血液净化使用情况。记录血管活性药物治疗前的实验室指标,包括血常规、肝肾功能、凝血功能、电解质、血糖、血乳酸、pH等,以及血管活性药物治疗24 h后的血乳酸及pH。
1.3 血管活性药物评分VIS=多巴胺(μg/kg·min)+多巴酚丁胺(μg/kg·min)+10×米力农(μg/kg·min)+100×肾上腺素(μg/kg·min)+100×去甲肾上腺素(μg/kg·min)+10 000×垂体后叶素(U/kg·min)。评分每小时一次,第1个24 h内的最大VIS为24 h VIS max[8],取第1个24 h内的VIS平均值得到24 h VIS mean。
1.4 统计学分析应用SPSS 20.0统计学软件进行数据处理。计量资料采用均数±标准差(x±s)或中位数四分位数[M(P25,P75)]表示,组间比较采用t检验或秩和检验;计数资料以率表示,组间比较采用卡方检验;并采用受试者工作特征曲线(ROC)进行VIS预测价值的评价。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料2011年1月至2016年12月192例失代偿型脓毒性休克患儿,除去使用血管活性药物 < 24 h的41例、放弃治疗的21例、资料不全以及患有遗传代谢性疾病的13例,最后117例患儿入组。117例中神经系统感染26例、呼吸系统感染49例、消化系统感染27例,皮肤及软组织感染12例、其他3例(急性化脓性骨髓炎2例、急性化脓性腮腺炎1例)。根据患儿的预后情况分为死亡组(41例)和存活组(76例),两组在年龄、性别构成比、体重、感染部位分布、是否接受血液净化、是否使用激素治疗等方面的差异均无统计学意义(P > 0.05),但死亡组患儿的住院时间、PICU停留时间、血管活性药物使用时间、机械通气时间明显少于存活组。见表 1。
| 表 1 失代偿型脓毒性休克患儿的基本信息 |
|
|
死亡组和存活组在接受血管活性药物之前的基础实验室指标,包括基础血常规、肝肾功能、血糖、电解质的差异均无统计学意义(P > 0.05),但死亡组的PT及FDPs均明显高于存活组(P < 0.05)。见表 2。
| 表 2 死亡组与存活组的基础实验室指标比较 |
|
|
死亡组的24 h VIS max、24 h VIS mean、PRISM Ⅲ评分、基础乳酸及治疗24 h后的乳酸均明显高于存活组,治疗24 h后的pH低于存活组,差异具有统计学意义(P < 0.05)。见表 3。
| 表 3 脓毒性休克病死率的影响因素分析 |
|
|
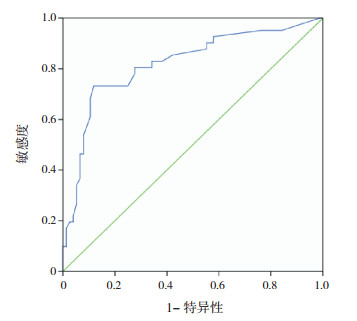
24 h VIS max、24 h VIS mean、PRISM Ⅲ评分、基础和治疗24 h后的乳酸及pH对于脓毒性休克预后预测的ROC曲线下面积(AUC)均 > 0.5、P < 0.05,其中24 h VIS max的AUC最大。见表 4。根据最大约登指数(约登指数=0.613,灵敏度= 0.732,特异度=0.882),24 h VIS max的临界值为29.5。见图 1。
| 表 4 VIS、PRISM Ⅲ评分、乳酸及pH对于脓毒性休克预后的判断价值 |
|
|
|
图 1 24 h VIS max对于脓毒性休克预后的预测价值 |
根据24 h VIS max的临界点29.5,将117例患儿分为低VIS组、高VIS组。与低VIS组相比,高VIS组的死亡率、PRISM Ⅲ评分、基础乳酸、24 h乳酸均较高,住院时间及PICU停留时间、治疗24 h后pH均较低,差异具有统计学意义(P < 0.05)。见表 5。
| 表 5 血管活性药物评分的影响因素分析 |
|
|
脓毒性休克由感染诱导,进而引起心输出量下降、有效循环血量不足,最终导致组织器官缺血缺氧[9]。对于液体复苏后难以纠正的失代偿型脓毒性休克,血管活性药物常常作为纠正休克的重要治疗手段[10-11]。而VIS通过对所用血管活性药物的剂量进行加权整合及量化,是反映心血管功能的有效指标[4, 12]。
目前VIS主要用于心脏手术患者术后的生存分析,Gaies等[13]发现心脏手术后24 h内VIS较高者死亡风险增加;Davidson等[14]发现VIS与心脏手术患儿的住院时间、ICU停留时间、气管插管时间密切相关。有关VIS与儿童脓毒性休克预后关系的报道较少。Haque等[5]将脓毒性休克患儿分为VIS≤20组和VIS > 20组,发现VIS > 20是患儿死亡的独立危险因素。本研究发现脓毒性休克死亡组患儿的24 h VIS max、24 h VIS mean、PRISM Ⅲ评分、基础乳酸及治疗24 h后乳酸均明显高于存活组患儿,且这5项指标的ROC曲线下面积均大于0.5,说明这5项指标对脓毒性休克的预后都具有一定的预测价值。而24 h VIS max的ROC曲线下面积最大,故24 h VIS max对于脓毒性休克病死率的预测价值最高。进一步根据24 h VIS max在ROC曲线的临界点再次对患儿进行分组,发现高VIS组患儿的死亡比例、血乳酸或者PRISM Ⅲ评分均较高。而血管活性药物评分作为反映心血管功能的指标,心血管功能越差,评分就越高;乳酸由机体无氧酵解产生,机体缺氧越严重,病情越危重,血乳酸值就越高。因此更进一步证实了VIS对于脓毒性休克预后评估的有效性。
血乳酸是机体缺氧后无氧代谢的产物,可以反映组织器官缺氧严重程度以及氧合利用情况,故而一直作为判断脓毒性休克预后的有效指标之一[1, 15]。研究[16]发现,脓毒性休克患者的初始血乳酸水平越高,其病死率越高,并且存活组治疗后的血乳酸水平显著下降,而死亡组的血乳酸较治疗前却无明显下降。本研究也发现血乳酸对于脓毒性休克的病死率有一定的预测价值,但24 h VIS max的ROC曲线下面积更高,因此对于脓毒性休克的死亡预测价值更高,而且VIS可以直接通过用药记录获取,更加准确。
综上所述,血管活性药物评分越高反映脓毒性休克病情越危重,病死率可能越高。进一步开展前瞻性、多中心、大样本的相关研究有助于对临床工作起到指导作用。
| [1] |
Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 (  0) 0) |
| [2] |
Ventura AM, Shieh HH, Bousso A, et al. Double-blind prospective randomized controlled trial of dopamine versus epinephrine as first-line vasoactive drugs in pediatric septic shock[J]. Crit Care Med, 2015, 43(11): 2292-2302. DOI:10.1097/CCM.0000000000001260 (  0) 0) |
| [3] |
Gaies MG, Gurney JG, Yen AH, et al. Vasoactive-inotropic score as a predictor of morbidity and mortality in infants after cardiopulmonary bypass[J]. Pediatr Crit Care Med, 2010, 11: 234-238. DOI:10.1097/PCC.0b013e3181b806fc (  0) 0) |
| [4] |
Barge-Caballero E, Segovia-Cubero J, González-Vilchez F, et al. Evaluation of the preoperative vasoactive-inotropic score as a predictor of postoperative outcomes in patients undergoing heart transplantation[J]. Int J Cardiol, 2015, 185: 192-194. DOI:10.1016/j.ijcard.2015.03.098 (  0) 0) |
| [5] |
Haque A, Siddiqui NR, Munir O, et al. Association between vasoactive-inotropic score and mortality in pediatric septic shock[J]. Indian Pediatrics, 2015, 52(4): 311-313. DOI:10.1007/s13312-015-0630-1 (  0) 0) |
| [6] |
樊寻梅. 儿科感染性休克(脓毒性休克)诊疗推荐方案[J]. 中国小儿急救医学, 2006, 13(4): 313-315. (  0) 0) |
| [7] |
Dellinger RP, Levy MM, Carlet JM, et al. Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock:2008[J]. Crit Care Med, 2008, 36(1): 296-327. DOI:10.1097/01.CCM.0000298158.12101.41 (  0) 0) |
| [8] |
崔勇丽, 刘晋萍, 赵举, 等. 血管活性药物评分对体外膜式氧合辅助下婴幼儿患者急性肾损伤的预测作用[J]. 中国医药导报, 2013, 10(18): 79-81. DOI:10.3969/j.issn.1673-7210.2013.18.028 (  0) 0) |
| [9] |
Minasyan H. Sepsis and septic shock:Pathogenesis and treatment perspectives[J]. J Crit Care, 2017, 40: 229-242. DOI:10.1016/j.jcrc.2017.04.015 (  0) 0) |
| [10] |
Oba Y, Lone NA. Mortality beneft of vasopressor and inotropic agents in septic shock:a Bayesian network meta-analysis of randomized controlled trials[J]. J Crit Care, 2014, 29: 706-710. DOI:10.1016/j.jcrc.2014.04.011 (  0) 0) |
| [11] |
Persichini R, Silva S, Teboul JL, et al. Effects of norepinephrine on mean systemic pressure and venous return in human septic shock[J]. Crit Care Med, 2012, 40(12): 3146-3153. DOI:10.1097/CCM.0b013e318260c6c3 (  0) 0) |
| [12] |
Sanil Y, Aggarwal S. Vasoactive-inotropic score after pediatric heart transplant:a marker of adverse outcome[J]. Pediatr Transplant, 2013, 17(6): 567-572. DOI:10.1111/petr.2013.17.issue-6 (  0) 0) |
| [13] |
Gaies MG, Jeffries HE, Niebler RA, et al. Vasoactive-inotropic score is associated with outcome after infant cardiac surgery:An analysis from the Pediatric Cardiac Critical Care Consortium and Virtual PICU System Registries[J]. Pediatr Crit Care Med, 2014, 15(6): 529-537. DOI:10.1097/PCC.0000000000000153 (  0) 0) |
| [14] |
Davidson J, Tong S, Hancock H, et al. Prospective validation of the vasoactive-inotropic score and correlation to short-term outcomes in neonates and infants after cardiothoracic surgery[J]. Intensive Care Med, 2012, 38(7): 1184-1190. DOI:10.1007/s00134-012-2544-x (  0) 0) |
| [15] |
Doenyasbarak K, Beberashvili I, Marcus R, et al. Lactic acidosis and severe septic shock in metformin users:a cohort study[J]. Crit Care, 2016, 20: 10. (  0) 0) |
| [16] |
包磊, 张敏, 颜培夏, 等. 动脉血乳酸及其清除率预测感染性休克患者预后的回顾性研究[J]. 中华危重病急救医学, 2015, 27(1): 38-42. (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


