肠源性感染与肠黏膜机械屏障破坏相关,紧密连接蛋白ZO-1等是肠道屏障的重要组分,紧密连接能够阻止毒性大分子及微生物入侵。炎症因子包括脂多糖(LPS)、肿瘤坏死因子(TNF)、白细胞介素-1(IL-1)等可损害肠道屏障。Toll样受体是广泛表达于哺乳动物细胞表面的一种跨膜信号转导蛋白,是LPS的主要受体,是LPS-TLR介导的信号转导通路中的关键环节[1]。LPS-TLR4通路是目前较为明确的炎症通路,是目前医学领域研究的热点[2]。LPS主要通过LPS-TLR通路发挥毒性作用,LPS与TLR结合后激活核转录因子NF-κB,从而诱导炎症因子TNF-α的产生,损伤肠道屏障。本实验通过检测NF-κBp65、TNF-α及ZO-1的mRNA和蛋白表达情况,验证Toll样受体阻断剂(TLR4-Ab、TLR2-Ab)是否对LPS引起的紧密连接损伤具有拮抗作用,以期为肠源性感染的治疗提供理论依据。
1 材料与方法 1.1 试剂与仪器TLR4单克隆抗体(TLR4mAb,CD282.121802)和TLR2单克隆抗体(TLR2mAb,CD284.117602)购自美国eBiosime公司。内毒素(O55:B5)和LPS购自美国Sigma公司。TNF-α、NF-κBp65、ZO-1一抗(稀释比1 : 100)购自武汉博士德生物工程有限公司。总RNA提取试剂盒购自美国Invitrogen公司;PCR引物由北京华大基因公司合成;荧光定量PCR试剂盒购自美国Promega公司。即用型SABC试剂盒及DAB染色剂均购自武汉博士德生物工程有限公司。小型台式离心机(1-13,美国Sigma公司),高速冷冻离心机(31k5C型,美国Sigma公司),PCR扩增仪(德国Biometra公司),紫外分光光度计(UV300,英国Biochrom公司)。OLYMPUS-BX41图像采集系统及Meta Morph/DP10/BX41软件分析系统(日本Olympus公司)。
1.2 实验动物分组与模型建立清洁级成年BALB/C小鼠32只,雌雄不限,体重为15~25 g,由中国医科大学医学动物实验中心提供。将32只小鼠随机分成对照组、模型组、TLR4处理组及TLR2处理组(n=8)。模型组给予LPS(5 mg/kg)腹腔注射,建立内毒素血症模型[3],TLR4处理组给予LPS(5 mg/kg)+TLR4抗体(10 μg/只)腹腔注射,TLR2处理组给予LPS(5 mg/kg)+TLR2抗体(10 μg/只)腹腔注射,对照组以等量生理盐水替代注射。各组分别于注射后3 h处死小鼠,取远端小肠用于免疫组化及RT-PCR检测紧密连接蛋白ZO-1、NF-κBp65及TNF-α的表达情况。
1.3 RT-PCR每组取6只小鼠小肠组织,参照TRIzol说明书采取一步法提取总RNA,测定RNA浓度和纯度,逆转录合成cDNA作为模版进行扩增。ZO-1正义序列5'-AGCGAACAGAAGGAGCG-3';反义序列5'-CTGCCAAACTATCTTGTGAAA-3',片段长度215 bp。TNF-α正义序列5'-CGGGCAGGTCTACTTT-3';反义序列5'-TCACTGTCCCAGCATCT-3',片段长度226 bp。NF-κB正义序列5'-CTCTTTATCTCGCTTTCGG-3';反义序列5'-TGGCTCCAGTCTGTCCC-3',片段长度174 bp。β-actin正义序列5'-CTGTCCCTGTATGCC-TCTG-3';反义序列5'-TGTCACGCACGATTTCC-3',片段长度217 bp。PCR扩增体系(20 μL):cDNA 5 μL(1 μg),5×buffer 4 μL,MgCl2 2 μL,10 mmol/L dNTPs 2 μL,引物2 μL(100 ng),TagDNA多聚酶1 μL(1 U),ddH2O补足剩余体积。反应条件:70℃预变性5 min;94℃变性40 s,25℃退火5 min,42℃延伸60 s,共35个循环。取PCR扩增产物于2%琼脂糖凝胶中电泳,利用计算机凝胶成像分析系统处理软件量化PCR扩增产物,mRNA相对表达量=目的基因光密度值/β-actin光密度值。
1.4 免疫组化每组取8只小鼠小肠组织,在40 g/L甲醛溶液中固定、包埋、石蜡切片,厚度5 μm。每个时间点选取染色清晰的切片5~8张,于光镜下(×40)随机选取5~6个视野。石蜡切片脱蜡至水,放入30%H2O2与蒸馏水的混合液中,室温孵育10 min,灭活内源性过氧化物酶,蒸馏水冲洗;经热修复抗原,滴加5%BSA封闭,室温孵育30 min;滴加抗体(一抗),4℃孵育过夜;冲洗后滴加生物素标记的山羊抗小鼠IgG(二抗),37℃孵育30 min;经冲洗,再滴加SABC液,37℃孵育30 min,冲洗,混匀后DAB显色,室温条件下显色5 min,蒸馏水充分洗涤;苏木素轻度复染10 min,水洗反蓝30 min;脱水,二甲苯透明处理,封片,显微镜下观察。阴性对照:除用PBS代替一抗外,其他步骤同上。以细胞膜有棕黄色染色为ZO-1阳性细胞,以细胞核和细胞质内有均匀的棕黄色颗粒染色为TNF-α和NF-κBp65阳性细胞。免疫组织化学图片测定:利用OLYMPUS摄像系统和Meta-Mroph/BX41图像数据分析系统测定平均积分光密度值(IOD)。
1.5 统计学分析采用SPSS 18.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间均数比较采用单因素方差分析,组间两两比较采用SNK-q法,P < 0.05为差异有统计学意义。
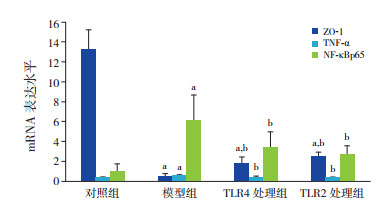
2 结果 2.1 TLR4、TLR2单克隆抗体对ZO-1、TNF-α及NF-κBp65 mRNA表达水平的影响模型组ZO-1 mRNA表达明显低于对照组(P < 0.05);TNF-α、NF-κBp65 mRNA表达均高于对照组(P < 0.05)。TLR4处理组及TLR2处理组中ZO-1 mRNA表达高于模型组,但仍低于对照组(P < 0.05);TNF-α、NF-κBp65 mRNA表达低于模型组(P < 0.05),且与对照组比较差异无统计学意义(P > 0.05)。TLR4处理组与TLR2处理组ZO-1、TNF-α及NF-κBp65 mRNA表达水平比较差异均无统计学意义(P > 0.05)。见表 1,图 1。
| 表 1 各组ZO-1、TNF-α及NF-κBp65 mRNA表达水平比较 (x±s) |
|
|
|
图 1 各组ZO-1、TNF-α及NF-κBp65 mRNA表达水平比较(n=6) a示与对照组相比,P < 0.05;b示与模型组相比,P < 0.05。 |
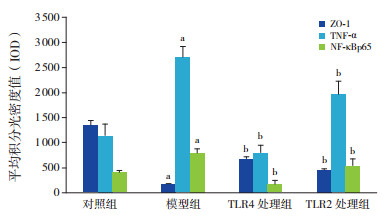
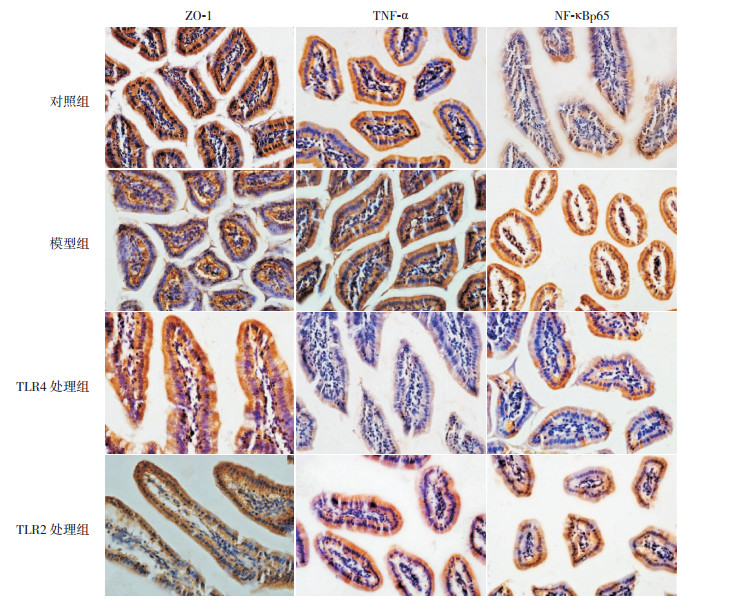
免疫组化结果显示:对照组ZO-1均匀一致的分布于小肠上皮细胞连接处的顶端,呈蜂巢状;NF-κBp65、TNF-α蛋白表达在小肠绒毛上皮顶端细胞浆和细胞核内。模型组ZO-1分布不均,染色较对照组变浅,ZO-1阳性信号的IOD值较对照组明显降低(P < 0.05);NF-κBp65、TNF-α染色较对照组变深,蛋白阳性信号的IOD值较对照组明显升高(P < 0.05)。TLR4处理组及TLR2处理组ZO-1染色较模型组深,蛋白阳性信号的IOD值较模型组明显升高(P < 0.05),且与对照组比较差异无统计学意义(P > 0.05);NF-κBp65、TNF-α染色较模型组浅,蛋白阳性信号的IOD值较模型组明显降低(P < 0.05),且与对照组比较差异无统计学意义(P > 0.05)。TLR4处理组与TLR2处理组ZO-1、TNF-α及NF-κBp65蛋白阳性信号IOD值比较差异无统计学意义(P > 0.05)。见表 2,图 2~3。
| 表 2 各组ZO-1、TNF-α及NF-κBp65阳性信号IOD值比较 (x±s) |
|
|
|
图 2 各组ZO-1、TNF-α及NF-κBp65阳性信号IOD值比较(n=8) a示与对照组相比,P < 0.05;b示与模型组相比,P < 0.05。 |
|
图 3 免疫组化检测各组肠黏膜上皮细胞蛋白定位表达(DAB显色,×40) 对照组ZO-1均匀一致地分布于小肠黏膜上皮细胞连接处的顶端,蛋白阳性表达呈深棕色;TNF-α、NF-κBp65蛋白表达在对照组肠绒毛上皮顶端细胞浆和细胞核内,TNF-α蛋白阳性表达呈浅棕色,NF-κBp65蛋白阳性表达呈棕黄色。模型组ZO-1的分布不均,染色变浅,提示水平较对照组降低;TNF-α及NF-κBp65染色加深,提示水平较对照组升高。TLR4处理组、TLR2处理组ZO-1的分布较均匀,染色加深,提示水平较模型组升高,TNF-α及NF-κBp65染色变浅,提示水平较模型组降低。 |
机械屏障的基础是细胞间连接, 紧密连接破坏最重要的标志是紧密连接蛋白的减少。ZO-1是一个220 kD的外周膜蛋白,它属于闭锁小带蛋白家族,位于细胞质内膜表面,与绝大多数紧密连接蛋白及细胞骨架相连,是紧密连接的结构性蛋白[4-7]。LPS进入机体与LPS结合蛋白(LPB)结合形成复合物,再与CD14分子形成LPS-LPB-CD14复合物,将信号传到细胞内,然后激活TLR4,TLR4进一步将LPS信号向下传导,激活NF-κB和MAPK通路[8],被激活的NF-κB与特定的DNA区域结合,诱导炎症因子如TNF-α的表达。LPS-TLR信号通路是识别LPS,启动细胞反应的重要途径。TLR信号在肠道上皮细胞损伤后的修复和重建中起重要作用[9-20]。
有研究显示,用IFN-γ、TNF-α和IL-1β组成的复合因子与Caco-2共同培养后,发现肠屏障功能降低,ZO-1的mRNA表达减少,同时ZO-1、ZO-3和occludin蛋白的表达也降低。TNF-α已被证实是多种疾病引起肠黏膜屏障损伤的重要起动因子,体外实验研究表明TNF-α能增强肠上皮细胞屏障的通透性,这与其影响紧密连接蛋白occludin、ZO-1的表达及分布有一定关系[19, 21-26]。
有文章指出TLR2激动剂提高紧密连接的功能,增加皮肤紧密连接蛋白的表达,包括claudin1、claudin23、occludin、ZO-1,文章中证明TLR2激动剂作用于原代角质形成细胞24 h后观察到紧密连接蛋白的mRNA及蛋白表达比对照组增加[27],还有文章证明在体外培养的表皮角质形成细胞,激活TLR2受体,在第一个3 h的细胞紧密连接功能增强[10];有研究指出,在体外实验,TLR2通过非典型蛋白激酶C调节人支气管上皮细胞膜的屏障功能,激活TLR2受体并增加claudin-1、ZO-1的表达[28];本文研究结果与以上文章的研究结果有差异,不同的是,以上的研究都是体外实验,通过培养人表皮角质形成细胞、人支气管上皮细胞,用TLR2激动剂作用于细胞,来观察对紧密连接蛋白的影响;本研究为动物实验,首先用LPS造成内毒素血症模型,然后分别给予TLR4、TLR2受体阻断剂,选取小肠上皮细胞来观察Toll样受体阻断剂对紧密连接蛋白的影响,是通过LPS来激活Toll样受体,而不是Toll样受体激动剂,LPS-TLR传导通路激活后,最终会产生炎症因子,损伤紧密连接,因此结果与以往研究有差异。分别给予TLR4、TLR2受体阻断剂是为了观察Toll样受体阻断剂是否能减小LPS对紧密连接的损伤作用。
本研究结果显示,在内毒素血症模型小鼠的肠上皮中,LPS被Toll样受体识别后,将信号向下传导,激活NF-κB通路,诱导NF-κB的表达增加,从而分泌大量炎症因子TNF-α,导致ZO-1表达减少和异常分布,损伤小鼠肠上皮紧密连接,造成肠上皮细胞通透性增高,毒素入血,引起内毒素血症。在TLR4单克隆抗体的作用下,与模型组相比,小肠组织紧密连接蛋白ZO-1的mRNA及蛋白表达水平明显增加,TNF-α、NF-κBp65的mRNA及蛋白表达水平明显降低;在TLR2单克隆抗体的作用下,与模型组相比,小肠组织紧密连接蛋白ZO-1的mRNA及蛋白表达水平增加,TNF-α、NF-κBp65的mRNA及蛋白表达水平降低,差异均有统计学意义。由本实验研究推测,当LPS作用于肠道屏障时,一方面,TLR4、TLR2单克隆抗体分别与小鼠肠道上皮细胞的TLR4、TLR2受体结合,对LPS起到竞争性抑制作用,减少LPS与TLR4、TLR2受体结合,阻碍LPS-TLR信号通路的信号传导,从而对LPS引起的肠道损伤起到抑制作用;另一方面,TLR2、TLR4单克隆抗体通过对LPS-TLR信号通路的调节,上调ZO-1 mRNA,下调NF-κB及炎症因子TNF-α mRNA的表达,从而对ZO-1起到正性调节作用,抑制TNF-α的分泌,对肠道起保护作用。
| [1] |
罗兵, 李涛, 徐元宏. Toll样受体的信号转导及抗感染免疫研究进展[J]. 免疫学杂志, 2011, 27(2): 165-169. (  0) 0) |
| [2] |
李维朝, 蒋电明, 朱凤臣, 等. 内毒素耐受的分子机制研究进展[J]. 中国免疫学杂志, 2010, 26(8): 764-768. (  0) 0) |
| [3] |
王丽杰, 刘春英, 许玲芬, 等. 血小板活化因子受体拮抗剂对幼年大鼠肠黏膜上皮细胞间紧密连接蛋白的影响[J]. 世界华人消化杂志, 2006, 14(4): 392-397. (  0) 0) |
| [4] |
白小武, 嵇武, 丁博文, 等. 大黄素对肠黏膜屏障损伤的保护作用及机制研究[J]. 东南国防医药, 2012, 14(1): 12-15. (  0) 0) |
| [5] |
Shindou H, Ishii S, Yamamoto M, et al. Priming effect of lipopolysaccharide on acetyl-coenzyme A:lyso-platelet-activating factor acetyltransferase is MyD88 and TRIF independent[J]. Immunol, 2005, 175(2): 1177-1183. DOI:10.4049/jimmunol.175.2.1177 (  0) 0) |
| [6] |
刘志华, 秦环龙. 肠上皮细胞紧密连接基因及信号调控的研究进展[J]. 中华临床营养杂志, 2010, 18(5): 310-316. (  0) 0) |
| [7] |
Zareie M, Riff J, Donato K, et al. Novel effects of the prototype translocating Escherichia coli, strain C25 on intestinal epithelial structure and barrier function[J]. Cell Microbiol, 2005, 7(12): 1782-1797. DOI:10.1111/cmi.2005.7.issue-12 (  0) 0) |
| [8] |
Lendemans S, Kreuzfelder E, Rani M, et al. Toll-like recepor 2 and 4 expression after severe injury is not involved in he dysregulation of the innate immune system[J]. J Trauma, 2007, 63(4): 740-746. DOI:10.1097/01.ta.0000240451.42238.d1 (  0) 0) |
| [9] |
牛海刚. LPS-CD14-TLR传导通路的研究进展[J]. 山西医科大学学报, 2004, 35(1): 76-78. (  0) 0) |
| [10] |
Yuki T, Yoshida H, Akazawa Y, et al. Activation of TLR2 enhances tight junction barrier in epidermal keratinocytes[J]. J Immunol, 2011, 187(6): 3230-3237. DOI:10.4049/jimmunol.1100058 (  0) 0) |
| [11] |
Boulard O, Asquith MJ, Powrie F, et al. TLR2-independent induction and regulation of chronic intestinal inflammation[J]. Eur J Immunol, 2010, 40(2): 516-524. DOI:10.1002/eji.v40:2 (  0) 0) |
| [12] |
González-Mariscal L, Betanzos A, Nava P, et al. Tight junction proteins[J]. Prog Biophys Mol Biol, 2003, 81(1): 1-44. DOI:10.1016/S0079-6107(02)00037-8 (  0) 0) |
| [13] |
Huang B, Zhao J, Unkeless JC, et al. TLR signaling by tumor and immune cells:a double-edged sword[J]. Oncogene, 2008, 27(2): 218-224. DOI:10.1038/sj.onc.1210904 (  0) 0) |
| [14] |
Lu YC, Yeh WC, Ohashi PS. LPS/TLR4 signal transduction pathway[J]. Cytokine, 2008, 42(2): 145-151. DOI:10.1016/j.cyto.2008.01.006 (  0) 0) |
| [15] |
Kim TW, Staschke K, Bulek K, et al. A critical role for IRAK 4 kinase activity in Toll-like receptor-mediated innate immunity[J]. J Exp Med, 2007, 204(5): 1025-1036. DOI:10.1084/jem.20061825 (  0) 0) |
| [16] |
Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity[J]. Cell, 2006, 124(4): 783-801. DOI:10.1016/j.cell.2006.02.015 (  0) 0) |
| [17] |
Mazzon E, Sturniolo GC, Puzzolo D, et al. Effect of stress on the paracellular barrier in the rat ileum[J]. Gut, 2002, 51(4): 507-513. DOI:10.1136/gut.51.4.507 (  0) 0) |
| [18] |
Fukata M, Michelsen KS, Eri R, et al. Toll-like receptor-4 is required for intestinal response to epithelial injury and limiting bacterial translocation in a murine model of acute colitis[J]. Am J Physiol Gastrointest Liver Physiol, 2005, 288(5): G1055-G1065. DOI:10.1152/ajpgi.00328.2004 (  0) 0) |
| [19] |
Rakoff-Nahoum S, Paglino J, Eslami-Varzaneh F, et al. Recognition of commensal microflora by toll-like receptors is required for intestinal homeostasis[J]. Cell, 2004, 118(2): 229-241. DOI:10.1016/j.cell.2004.07.002 (  0) 0) |
| [20] |
Cario E, Gerken G, Podolsky DK. Toll-like receptor 2 controls mucosal inflammation by regulating epithelial barrier function[J]. Gastroenterology, 2007, 132(4): 1359-1374. DOI:10.1053/j.gastro.2007.02.056 (  0) 0) |
| [21] |
Ye D, Ma I, Ma TY. Molecular mechanism of tumor necrosis factor-alpha modulation of intestinal epithelial tight junction barrier[J]. Am J Physiol Gastrointest Liver Physiol, 2006, 290(3): G496-G504. DOI:10.1152/ajpgi.00318.2005 (  0) 0) |
| [22] |
李春艳, 肖福大, 于明. 幼鼠肠缺血再灌注损伤时TNF-α的产生及作用[J]. 中国医科大学学报, 2002, 31(4): 241-243. (  0) 0) |
| [23] |
Andonegui G, Goyert SM, Kubes P. Lipopolysaccharide-induced leukocyte-endothelial cell interactions:a role for CD14 versus toll-like receptor 4 within microvessels[J]. J Immunol, 2002, 169(4): 2111-2119. DOI:10.4049/jimmunol.169.4.2111 (  0) 0) |
| [24] |
高志光, 秦环龙. 肠上皮细胞紧密连接的生物学功能及在肠屏障中的作用[J]. 肠外与肠内营养, 2005, 12(5): 299-302. (  0) 0) |
| [25] |
Han X, Fink MP, Delude RL. Proinflammatory cytokines cause NO*-dependent and -independent changes in expression and localization of tight junction proteins in intestinal epithelial cells[J]. Shock, 2003, 19(3): 229-237. DOI:10.1097/00024382-200303000-00006 (  0) 0) |
| [26] |
崔巍, 周莹, 刘沛. 谷氨酰胺对肿瘤坏死因子-α引起的肠上皮紧密连接损害的保护作用[J]. 山西医药杂志, 2009, 38(6): 491-493. (  0) 0) |
| [27] |
Kuo IH, Carpenter-Mendini A, Yoshida T, et al. Activation of epidermal toll-like receptor 2 enhances tight junction function:implications for atopic dermatitis and skin barrier repair[J]. J Invest Dermatol, 2013, 133(4): 988-998. DOI:10.1038/jid.2012.437 (  0) 0) |
| [28] |
Ragupathy S, Esmaeili F, Paschoud S, et al. Toll-like receptor 2 regulates the barrier function of human bronchial epithelial monolayers through atypical protein kinase C zeta, and an increase in expression of claudin-1[J]. Tissue Barriers, 2014, 2: e29166. DOI:10.4161/tisb.29166 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


