2. 厦门市妇幼保健院新生儿科, 福建 厦门 361000
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)是围产期窒息导致的急性缺氧缺血性脑损害,其损伤恢复慢,治疗周期长,预后多不佳[1],早期诊断和干预尤为重要。目前HIE的诊断及严重程度分度仍主要依据临床病史及体格检查,存在一定的主观性。MRI能较准确地反映新生儿脑组织的结构及发育[2-3],已成为新生儿HIE的主要辅助检查手段。
HIE的MRI表现有多种类型,不同类型的损伤及评分与运动、认知等远期结局相关[4-7]。Barkovich [5]提出的围产期窒息脑损伤MRI评分系统采用的主要是MRI常规序列。目前仍缺少有关HIE DWI评分的研究,而且国内将MRI应用于HIE诊断开展较晚,缺少统一的磁共振诊断及评价规范。因此,进行HIE的动态MRI损伤类型研究有助于MRI规范化应用,提高HIE诊断及远期预后判定的准确性。
本研究依据MRI的T1WI、T2WI和DWI序列,在Barkovich [5]分类基础上,将HIE的MRI神经病理分类划分为:分水岭区(watershed, W)损伤、基底节/丘脑(basal ganglia / thalamus, BG/T)损伤、内囊后肢(posterior limbs of internal capsule, PLIC)损伤及脑干(brainstem, Bs)损伤,并根据受累组织的结构及范围对损伤类型赋予分值,分析MRI评分高低与临床严重程度的相关性,确立MRI检查的最佳序列,探索MRI不同脑损伤类型的发生规律及重度HIE的MRI动态演变规律。
1 资料与方法 1.1 研究对象本研究为回顾性研究,收集2009年1月至2016年12月中国医科大学附属盛京医院第二新生儿科确诊为HIE的61例足月儿。HIE诊断及分度符合中华医学会儿科分会制定的新标准[8]。纳入标准如下:①存在胎儿宫内窘迫(胎心 < 100次/min,持续5 min以上,和/或羊水Ⅲ度污染)及窒息史(1 min Apgar评分≤ 3分,5 min仍≤5分,脐血/生后早期血气的pH值< 7.1);②存在窒息复苏史(正压通气、气管插管、心肺复苏、肾上腺素应用);③早期出现神经系统症状甚至呼吸节律改变、瞳孔对光反应迟钝或消失等脑干症状;④住院期间完善头MRI检查;⑤排除宫内感染、颅内出血和产伤等原因引起的抽搐,以及遗传代谢性疾病和其他先天性疾病所引起的脑损伤。
1.2 MRI检查的选择MRI采用Philips Intera Achieva 3.0 T磁共振仪,全部病例均进行常规MRI及DWI扫描。扫描参数为:T1加权成像,SE序列TR=200 ms、TE=2.3 ms,常规进行矢状面和轴面扫描,矩阵432×432;T2加权成像,快速FSE序列TR=5 000 ms、TE=80 ms,常规进行轴面扫描,矩阵432×432;弥散加权成像采用回波平面成像(EPI)超高速成像方法,TR=3 500 ms、TE=60 ms,梯度磁场从X、Y、Z轴3个方向施加,b值为1 000 s/mm2,视野17 cm×17 cm~22 cm×22 cm,矩阵128×128,层厚4 mm;扫描前应用水合氯醛镇静,检查时应用保温毯,耳罩护耳。
1.3 影像学评价与评分依据表 1[5]对MRI各检查序列进行评分。以3个序列为基础,选取各序列各损伤部位的最高评分计入总分作为最后的综合评分,所有MRI资料由两名不知临床病史的放射科医师及新生儿神经病理学专家共同分析、给出结果。
| 表 1 改进的HIE MRI影像学评分 |
|
|
采用SPSS 19.0软件进行数据处理。正态分布的计量资料采用均数±标准差(x±s)表示,组间比较采用独立样本t检验;非正态分布的计量资料采用中位数四分位数[M(P25,P75)]表示,组间比较采用非参数秩和检验。计数资料的统计学比较采用卡方检验。MRI评分与检查之间的关系采用Spearman相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 不同严重程度HIE患儿的临床特征比较61例HIE患儿重度的37例(60%)、中度24例(39%),两组患儿的1 min和5 min Apgar评分以及肾上腺素应用、机械通气、生后一周不能自行进乳及中断治疗/死亡所占比例的差异有统计学意义(P < 0.05)。两组患儿在出生胎龄、出生体重、生后1 h内pH值、生后1 h内BE值、惊厥发生时间,以及男性患儿、剖宫产、宫内窘迫、胎膜早破、胎盘早剥、脐带异常、心肺复苏比例的差异无统计学意义(P > 0.05)。见表 2。
| 表 2 不同严重程度缺氧缺血性脑病患儿的临床特征比较 |
|
|
61例患儿住院期间完善1次头部MRI检查者38人,2次者23人,共计84(中度39人次、重度45人次)人次,中、重度HIE患儿行MRI检查时间的差异无统计学意义(分别为8±6 d、6±5 d,t=1.792,P > 0.05),重度HIE患儿各部位损伤评分及MRI综合评分较高,中度HIE较低,差异存在统计学意义(P < 0.01),见表 3。
| 表 3 不同严重程度HIE患儿损伤部位评分、MRI综合评分比较 [x±s或M(P25,P75)] |
|
|
依据检查时间分为≤3 d检查组,> 3~7 d组和 > 7 d组,不同时间段的MRI检查中,各序列评分与综合评分之间均具有相关性(P < 0.01),1周之内的MRI检查,以DWI评分的相关性最好,> 7 d的MRI检查以T1WI评分的相关性最好;除 > 3~7 d时的T2WI外,各时间段各序列的MRI评分与临床分度均有一定的相关性。见表 4。
| 表 4 头部MRI不同序列评分与MRI综合评分及临床分度的相关性 |
|
|
中度HIE患儿的分水岭区损伤发生率较高,而重度HIE患儿全脑型损伤(W+BG/T+Bs+PLIC)、基底节/丘脑及脑干损伤的发生率较高,差异有统计学意义(P < 0.01)。见表 5。
| 表 5 中、重度HIE患儿MRI脑损伤类型的比较 [例(%)] |
|
|
6例重度HIE患儿在2~3月龄随访时进行了头部MRI复查,其中分水岭区损伤为主者2例,BG/T损伤为主者2例,全脑型损伤者2例。2例患儿首次MRI检查时间较晚(分别于生后10天、14天),余患儿首次MRI检查均在生后3天内进行。分水岭区损伤重者(MRI评分4分)随访MRI可见皮层萎缩、皮层下白质容积减少,损伤较轻的患儿(评分2分)随访MRI病灶消失;BG/T损伤重者(评分3分)随访MRI可见基底节、丘脑萎缩,损伤较轻者(评分2分)随访MRI可见基底节、丘脑信号恢复正常。选取住院期间重度HIE分水岭区及BG/T损伤病例,结合随访MRI,列举不同损伤类型的典型MRI动态改变,图 1~2、图 3~4分别为两例重度广泛分水岭区损伤患儿的MRI动态变化,图 5~7为重度BG/T+脑干损伤的MRI动态变化,图 8~9为全脑型损伤的MRI动态变化。
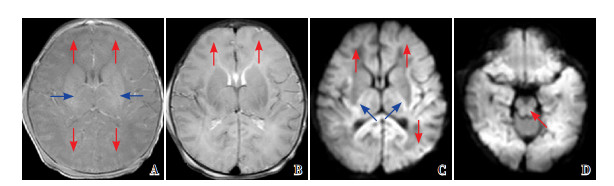
|
图 1 病例1的首次MRI(生后69 h) 重度广泛分水岭区损伤,T1WI(A)、T2WI(B)灰白质不能分辨(红色箭头所示)、T1WI(A)PLIC正常高信号缺失(蓝色箭头所示),DWI(C图)皮层及皮层下白质高信号、并可见丘脑腹外侧核及PLIC异常高信号(蓝色箭头所示),D为脑干广泛信号异常。 |
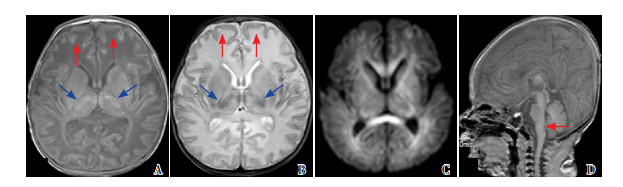
|
图 2 病例1的MRI复查(生后10 d) 重度广泛分水岭区损伤,T1WI(A)、T2WI(B)、DWI(C)广泛皮层变薄、白质软化(红色箭头所示),T1WI(A)的PLIC正常高信号缺失、T2WI(B)的PLIC信号减弱(蓝色箭头所示),T1WI矢状位(D图)脑干萎缩。 |
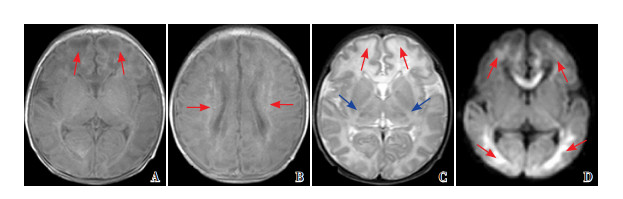
|
图 3 病例2的首次MRI(生后10 d) 重度广泛分水岭区损伤,T1WI(A)、T2WI(C)、DWI(D)广泛皮层及皮层下白质受累(红色箭头所示),T1WI(B)半卵圆中心白质异常,T2WI(C)上PLIC及丘脑信号异常(蓝色箭头所示)。 |
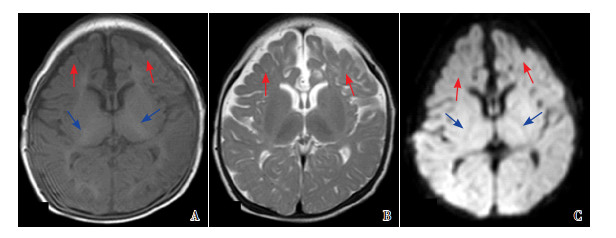
|
图 4 病例2的MRI复查(生后56 d) 重度广泛分水岭区损伤,T1WI(A)、T2WI(B)、DWI(C)上双侧额叶体积缩小,皮层下白质容积明显减少,脑外间隙增宽(如红色箭头所示),T1WI(A)和DWI(C)的PLIC髓鞘化发育异常(如蓝色箭头所示)。 |
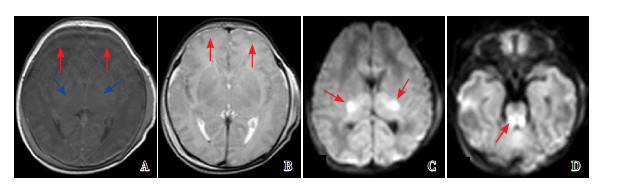
|
图 5 病例3的首次MRI(生后30 h) 重度BG/T+脑干损伤,T1WI(A)、T2WI(B)灰白质分辨不清(如红色箭头所示),T1WI(A)PLIC正常高信号缺失(蓝色箭头所示),DWI(C、D)示丘脑及脑干信号异常。 |
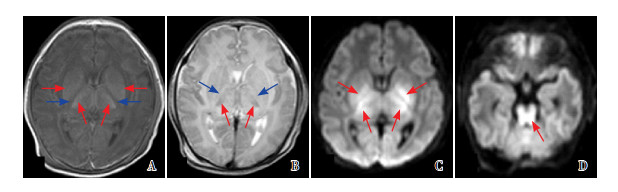
|
图 6 病例3的第一次MRI复查(生后8 d) 重度BG/T+脑干损伤,T1WI(A)、T2WI(B)、DWI(C)基底节、丘脑信号异常(红色箭头所示),PLIC信号缺失(蓝色箭头所示),DWI示脑干信号异常(D图)。 |
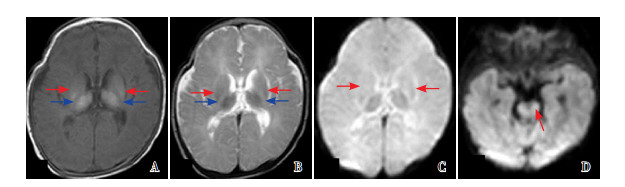
|
图 7 病例3的第二次MRI复查(生后41 d) 重度BG/T+脑干损伤,T1WI(A)、T2WI(B)显示BG/T萎缩(红色箭头所示),无PLIC髓鞘化(蓝色箭头所示),DWI显示BG/T萎缩(C图)和脑干信号异常(D图,箭头所示)。 |
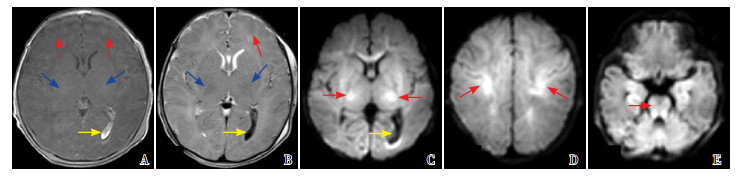
|
图 8 病例4的首次MRI(生后3 d) 全脑型损伤。T1WI(A)、T2WI(B)灰白质分界不清(红色箭头所示)、PLIC信号缺失(蓝色箭头所示)、脑室内出血(黄色箭头所示);DWI C图显示基底节、丘脑信号异常(红色箭头所示)以及脑室内出血(黄色箭头所示),D图显示罗兰氏区信号异常(红色箭头所示),E图显示脑干广泛信号异常(红色箭头所示)。 |
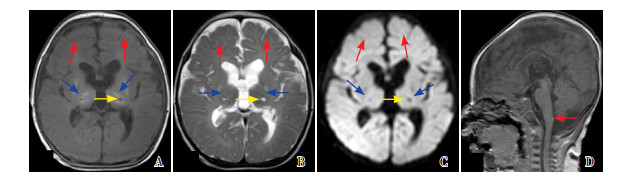
|
图 9 病例4的MRI复查(生后95 d) 全脑型损伤,T1WI(A)、T2WI(B)、DWI(C)显示额叶皮质萎缩,皮层下白质发育障碍(红色箭头所示),基底节、丘脑萎缩,内含软化灶(黄色箭头所示),PLIC髓鞘化异常(蓝色箭头所示),T1WI矢状位(D)示脑干萎缩。 |
研究[9-12]指出围生期窒息后数小时头部MRI开始出现DWI异常信号,24 h之内即出现平均弥散度下降,并持续到2~5天,之后信号逐渐恢复正常(7~10天进入假正常化时期),而且出生7天后的MRI常规序列的敏感性优于DWI。本研究≤3天组及 > 3~7天组HIE患儿的DWI评分与综合评分均具有显著的相关性,表明DWI序列评分在HIE患儿生后1周内具有较高的可信度,这与既往研究一致。而 > 7 d组的MRI以T1WI评分与综合评分之间的相关性最好,提示出生7天后常规序列MRI对HIE的诊断价值更大,与既往研究相符。HIE患儿头部MRI特定类型的损伤在评估严重程度及预后方面有很重要的意义。有研究[7, 13]表明指出,脑瘫患儿的头部MRI存在严重的BG/T和PLIC信号异常,内囊后肢的信号异常与不良结局相关。本研究重度HIE患儿的PLIC评分高于中度HIE患儿,提示内囊后肢信号异常与HIE不良结局相关。但84人次的MRI检查中,PLIC损伤共68例(中度HIE 23例,重度45例),均合并分水岭区或BG/T损伤,提示仍不能单纯依赖PLIC损伤评估预后。研究[13-14]表明,BG/T损伤程度与患儿运动、认知的预后相关。本研究重度HIE患儿BG/T评分高于中度,且全脑型损伤及BG/T+脑干损伤多见于重度HIE患儿,与文献相符。
动物实验[15]表明,完全窒息所致的神经病理损伤主要涉及丘脑和脑干,特别是被盖和下丘脑,而不完全窒息所致脑损伤主要为近中央区大脑皮质及白质(即分水岭区),也可包括基底节。人类因脐带脱垂、子宫破裂所致脑损伤的病变部位也主要涉及丘脑和脑干[16]。Volpe等[4]研究表明:HIE患儿头部MRI的病变范围及部位与缺氧缺血的严重程度及持续时间有关。本研究分水岭区损伤多见于中度HIE,而全脑型损伤及基底节/丘脑+脑干损伤多见于重度HIE,与Volpe等的研究相符。此外,本研究有2例重度HIE患儿MRI仅存在分水岭区损伤、无基底节/丘脑损伤,有4例中度HIE患儿的MRI表现为全脑型损伤(综合评分均≥11分),提示临床分度与MRI评分存在差异。
本研究对6例重度HIE患儿进行了头颅MRI随访,发现新生儿期MRI脑损伤评分越高,MRI信号恢复正常的可能性越小。与国外学者研究一致[17]。既往研究将HIE的脑损伤过程分成两个阶段:缺血损伤期及再灌注期,目前认为缺氧缺血后的脑损伤存在第3个阶段,此阶段可能一直持续到损伤后的数周、数月甚至数年[18-20]。也有研究表明,MRI正常的HIE患儿也可能在随访中发生缺陷[21];而临床结局正常(随访至1~2岁)的患儿MRI也可发现白质损伤[17]。因此,婴幼儿期的MRI随访对于HIE患儿预后评估很有必要。
综上所述,MRI影像学评分与HIE临床分度之间有较好的相关性。生后1周以内的MRI检查应重视DWI的影像学表现,而1周以后可主要参考常规序列。重度HIE以基底节/丘脑+脑干和全脑型损伤为主,而中度HIE以分水岭区损伤为主。MRI评分越高,脑损伤恢复正常的可能性越小。本研究存在一定的局限性,多数患儿住院期间仅完善一次MRI检查;重度HIE患儿常常在住院期间中断治疗,对临床短期结局分析的影响较大;而且本研究没有包括轻度HIE,不能完全揭示不同严重程度HIE的神经损伤规律。因此有待进一步扩大研究样本、完善临床预后及MRI随访,寻找HIE头部MRI的动态变化规律与预后的关系,进而指导临床。
| [1] |
Garbutt A, Trotman H. Outcome of neonates with hypoxic-ischaemic encephalopathy admitted to the neonatal unit of the University Hospital of the West Indies[J]. Ann Trop Paediatr, 2009, 29(4): 263-269. DOI:10.1179/027249309X12547917868925 (  0) 0) |
| [2] |
Groenendaal F, de Vries LS. Fifty years of brain imaging in neonatal encephalopathy following perinatal asphyxia[J]. Pediatr Res, 2017, 81(1-2): 150-155. DOI:10.1038/pr.2016.195 (  0) 0) |
| [3] |
Liauw L, van der Ground J, van denBerg-Huysmans AA, et al. Is there a way to predict outcome in (near) term neonates with hypoxic-ischemic encephalopathy based on MR imaging?[J]. AJNR Am J Neuroradiol, 2008, 29(9): 1789-1794. DOI:10.3174/ajnr.A1188 (  0) 0) |
| [4] |
Volpe JJ. Neonatal encephalopathy:an inadequate term for hypoxic-ischemic encephalopathy[J]. Ann Neurol, 2012, 72(2): 156-166. DOI:10.1002/ana.v72.2 (  0) 0) |
| [5] |
Barkovich AJ, Hajnal BL, Vigneron D, et al. Prediction of neuromotor outcome in perinatal asphyxia:evaluation of MR scoring systems[J]. AJNR Am J Neuroradiol, 1998, 19(1): 143-149. (  0) 0) |
| [6] |
Miller SP, Ramaswamy V, Michelson D, et al. Patterns of brain injury in term neonatal encephalopathy[J]. J Pediatric, 2005, 146(4): 453-460. DOI:10.1016/j.jpeds.2004.12.026 (  0) 0) |
| [7] |
Martinez-Biarge M, Diez-Sebastian J, Kapellou O, et al. Predicting motor outcome and death in term hypoxic-ischemic encephalopathy[J]. Neurology, 2011, 76(24): 2055-2061. DOI:10.1212/WNL.0b013e31821f442d (  0) 0) |
| [8] |
中华医学会儿科学分会新生儿学组. 新生儿缺氧缺血性脑病诊断标准[J]. 中国当代儿科杂志, 2005, 7(2): 97-98. (  0) 0) |
| [9] |
McKinstry RC, Miller JH, Snyder AZ, et al. A prospective, longitudinal diffusion tensor imaging study of brain injury in newborns[J]. Neurology, 2002, 59(6): 824-833. DOI:10.1212/WNL.59.6.824 (  0) 0) |
| [10] |
Barkovich AJ, Miller SP, Bartha A, et al. MR imaging, MR spectroscopy, and diffusion tensor imaging of sequential studies in neonates with encephalopathy[J]. AJNR Am J Neuroradiol, 2006, 27(3): 533-547. (  0) 0) |
| [11] |
Winter JD, Lee DS, Hung RM, et al. Apparent diffusion coefficient pseudonormalization time in neonatal hypoxic-ischemic encephalopathy[J]. Pediatr Neurol, 2007, 37(4): 255-262. DOI:10.1016/j.pediatrneurol.2007.06.005 (  0) 0) |
| [12] |
Rutherford M, Biarge MM, Allsop J, et al. MRI of perinatal brain injury[J]. Pediatr Radiol, 2010, 40(6): 819-833. DOI:10.1007/s00247-010-1620-z (  0) 0) |
| [13] |
Martinez-Biarge M, Diez-Sebastian J, Rutherford MA, et al. Outcomes after central grey matter injury in term perinatal hypoxic-ischaemic encephalopathy[J]. Early Hum Dev, 2010, 86(11): 675-682. DOI:10.1016/j.earlhumdev.2010.08.013 (  0) 0) |
| [14] |
Kaufman SA, Miller SP, Ferriero DM, et al. Encephalopathy as a predictor of magnetic resonance imaging abnormalities in asphyxiated newborns[J]. Pediatr Neurol, 2003, 28(5): 342-346. DOI:10.1016/S0887-8994(03)00015-8 (  0) 0) |
| [15] |
Myers RE. Two patterns of perinatal brain damage and their conditions of occurrence[J]. Am J Obstet Gynecol, 1972, 112(2): 246-276. DOI:10.1016/0002-9378(72)90124-X (  0) 0) |
| [16] |
Cowan F, Rutherford M, Groenendaal F, et al. Origin and timing of brain lesions in term infants with neonatal encephalopathy[J]. Lancet, 2003, 361(9359): 736-742. DOI:10.1016/S0140-6736(03)12658-X (  0) 0) |
| [17] |
Rutherford M, Pennock J, Schwieso J, et al. Hypoxic-ischaemic encephalopathy:early and late magnetic resonance imaging findings in relation to outcome[J]. Arch Dis Child Fetal Neonatal Ed, 1996, 75(3): F145-151. DOI:10.1136/fn.75.3.F145 (  0) 0) |
| [18] |
Robertson NJ, Cox IJ, Cowan FM, et al. Cerebral intracellular lactic alkalosis persisting months after neonatal encephalopathy measured by magnetic resonance spectroscopy[J]. Pediatr Res, 1999, 46(3): 287-296. DOI:10.1203/00006450-199909000-00007 (  0) 0) |
| [19] |
Northington FJ, Chavez-Valdez R, Martin LJ. Neuronal cell death in neonatal hypoxia-ischemia[J]. Ann Neurol, 2011, 69(5): 743-758. DOI:10.1002/ana.v69.5 (  0) 0) |
| [20] |
Fleiss B, Gressens P. Tertiary mechanisms of brain damage:a new hope for treatment of cerebral palsy[J]. Lancet Neurol, 2012, 11(6): 556-566. DOI:10.1016/S1474-4422(12)70058-3 (  0) 0) |
| [21] |
Shankaran S, McDonald SA, Laptook AR, et al. Neonatal magnetic resonance imaging pattern of brain injury as a biomarker of childhood outcomes following a trial of hypothermia for neonatal hypoxic-ischemic encephalopathy[J]. J Pediatr, 2015, 167(5): 987-993. DOI:10.1016/j.jpeds.2015.08.013 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


