2. 成都市第三人民医院/重庆医科大学附属成都第二临床学院检验科, 四川 成都 610031
坏死性小肠结肠炎(necrotic enterocolitis, NEC)是一种主要发生于早产儿的疾病, 流行病学研究显示, 90%~95%NEC发生于出生胎龄小于36周的早产儿[1]。以前, 由于早产儿早期病死率高, 新生儿NEC发生率相对较低。但最近几年, 随着早产儿数量增多, 存活时间延长, 早产儿NEC的发生率呈上升趋势, 尤其是极低出生体重早产儿[2]。NEC是影响早产儿发病率和病死率的重要因素之一, 据统计极低出生体重儿NEC发病率大约为10%, 病死率在20%~40%之间[3-4]。尽管NEC的发病机制还没有完全明确, 但NEC患儿血浆和肠道组织中细胞因子含量增加, 提示过度的炎症反应与NEC的发生有关[5]。除了血小板活化因子和活性氧之外, IL-8和其他许多细胞因子参与NEC病例的炎症进展, 肠道菌群定植异常, 益生菌减少而病原菌增加, 促使早产儿更容易发生NEC[6]。维生素D是一种类固醇衍生物, 属于脂溶性维生素, 有维持钙稳态和骨矿化的作用, 同时也具有免疫调节作用[7]。维生素D缺乏是一个常见问题, 根据不同国家和地区, 其发生率在18%~84%之间[8]。有作者指出维生素D缺乏对胃肠道的可能影响是降低结肠细菌清除能力, 减少肠上皮细胞紧密连接的表达, 增强Th1细胞介导的肠道炎症反应[9]。本研究目的在于进一步研究母亲和早产儿维生素D水平与早产儿NEC之间的关系, 为如何有效预防早产儿NEC提供循证依据。
1 资料与方法 1.1 研究对象选取2016年1~12月在我院产科出生, 并于生后2 h内入我院新生儿科住院治疗的胎龄 < 36周的早产儿429例为研究对象。排除标准包括先天畸形、NEC Ⅰ期、自发性肠穿孔、临床资料不全、住院期间因其他疾病死亡者, 以及父母不同意参与本研究者。依据患儿是否发生NEC, 将429例患儿分为NEC组(n=22)和非NEC组(n=407)。本研究在取得医院伦理委员会的批准后开始实施。
1.2 NEC诊断标准NEC的确诊和分期根据临床和影像学检查, 按照第4版《实用新生儿学》和修正贝尔标准进行[10-11]。NEC的临床表现包括:腹胀或腹部压痛、便血、胃潴留、胃液中含血或胆汁、呕吐、喂养不耐受、肠鸣音减少或消失, 以及腹壁红斑等。影像学发现中, 轻微的肠管扩张或肠梗阻与NECⅠ期有关; 较明显的肠道扩张、肠梗阻和肠壁积气与NECⅡA期相关; 门静脉积气和(或)腹水与NECⅡB期有关; 发现气腹则与NECⅢ期有关。在NEC病例中, 前48 h内每12 h重复1次腹部X线片检查, 以后检查频率逐渐减少, 直到抗生素治疗停止。腹部X线片由同一放射科医师阅读并出具检查报告。诊断为NEC的患儿给予适当的抗生素和胃肠减压、机械通气以及液体或血液制品扩容等支持治疗。
1.3 临床资料收集问卷调查母亲分娩时年龄、学历、孕期合并症、维生素D补充情况, 以及分娩前糖皮质激素使用情况。本研究中, 依据参考文献[12-13], 将母亲产前3个月维生素D补充情况分为未补充、补充不足(间断补充或每日补充 < 600 U/d)和足量补充(每日补充≥600 U/d)。
记录早产儿胎龄、出生体重、性别、分娩方式、Apgar评分、出生季节、喂养方式、是否使用免疫球蛋白、机械通气持续时间、NCPAP持续时间、用氧持续时间、住院时间和主要并发症。
1.4 实验方法所有新生儿在入院时常规采集血液标本进行血液常规和生化检查, 收集生化检查后剩余血清标本于-80℃保存。同时采集其母亲静脉血标本分离获得血清, 同样方法保存。采用美国MDS公司的SpectraMax M型酶标仪与英国IDS公司的25-羟基维生素D(25-hydroxyvitamin D, 25-OHD) ELISA试剂盒进行25-OHD检测。所有操作步骤严格按照说明书进行。按照《儿童微量营养素缺乏防治建议》, 新生儿血清25-OHD水平 > 20 ng/mL(50 nmol/L)为正常, 15~20 ng/mL(37.5~50 nmol/L)为不足, < 15 ng/mL(37.5 nmol/L)为缺乏, ≤5 ng/mL(12.5 nmol/L)为严重缺乏[14]。
1.5 统计学分析采用SPSS 16.0统计软件包对数据进行统计学分析。符合正态分布的计量资料以均数±标准差(x±s)表示, 两组间比较采用t检验; 计数资料以构成比或率(%)表示, 组间比较采用χ2检验; 二变量相关分析采用Pearson相关分析; 等级资料采用Wilcoxon秩和检验; 单因素分析采用logistic回归分析。P < 0.05为差异有统计学意义。
2 结果 2.1 早产儿一般情况纳入研究的429例患儿中, 男238例, 女191例; 平均胎龄33.2±1.9周; 平均出生体重1.9±0.4 kg; 自然分娩175例, 剖宫产254例; 春季(3~5月)出生105例, 夏季(6~8月)出生81例, 秋季(9~11月)出生138例, 冬季(12~2月)出生105例; 纯母乳喂养43例, 混合喂养354例, 人工喂养32例。
在发生NEC的22例患儿中, 平均发病日龄为12±5 d, 其中有16例(73%)诊断为NECⅡA期, 6例(27%)诊断为ⅡB期, 无1例发展为NECⅢ期。
NEC组和非NEC组在分娩方式、性别、Apgar评分、出生季节和喂养方式等方面比较差异均无统计学意义(P > 0.05);NEC组胎龄和出生体重显著低于非NEC组(P < 0.05)(表 1)。研究期间, NEC组无1例早产儿死亡。
| 表 1 早产儿一般情况 |
|
|
所有患儿母亲平均分娩年龄为29±5岁, 孕期主要合并症有子癎前期、胎膜早破、肝内胆汁淤积和妊娠期糖尿病。如表 2所示, 两组间母亲分娩年龄、受教育程度、合并症发生率以及分娩前糖皮质激素使用情况比较差异均无统计学意义(P > 0.05)。两组母亲产前3个月补充维生素D的情况比较差异有统计学意义(P=0.003)。
| 表 2 两组母亲情况比较 |
|
|
所有早产儿平均机械通气持续时间为1.19±0.13 d, 平均经鼻持续气道正压通气(NCPAP)持续时间为3.6±2.8 d, 平均用氧持续时间为7.6±6.8 d, 平均住院时间14.2±10.8 d。所有早产儿中有17.2%(74/429)在此次住院期间曾使用静脉免疫球蛋白(IVIG)治疗, 6.5%(28/429)并发动脉导管未闭(PDA), 7.2%(31/429)并发支气管肺发育不良(BPD), 9.6%(41/429)并发早产儿视网膜病(ROP), 10.5%(45/429)并发脑室内出血(IVH)。NEC组机械通气持续时间、用氧持续时间和住院时间显著高于非NEC组(P < 0.05);两组间NCPAP持续时间及IVIG使用率比较差异无统计学意义; NEC组并发PDA、BPD、ROP和IVH的发生率均显著高于非NEC组(P < 0.05)。见表 3。
| 表 3 早产儿临床特征和并发症比较 |
|
|
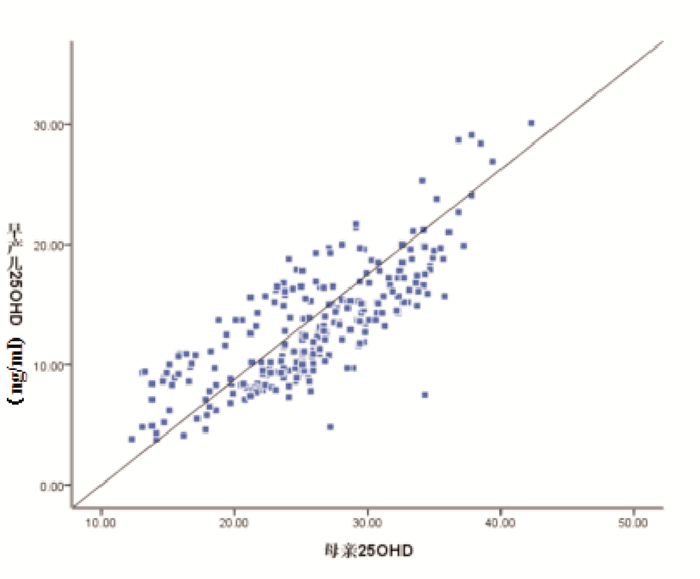
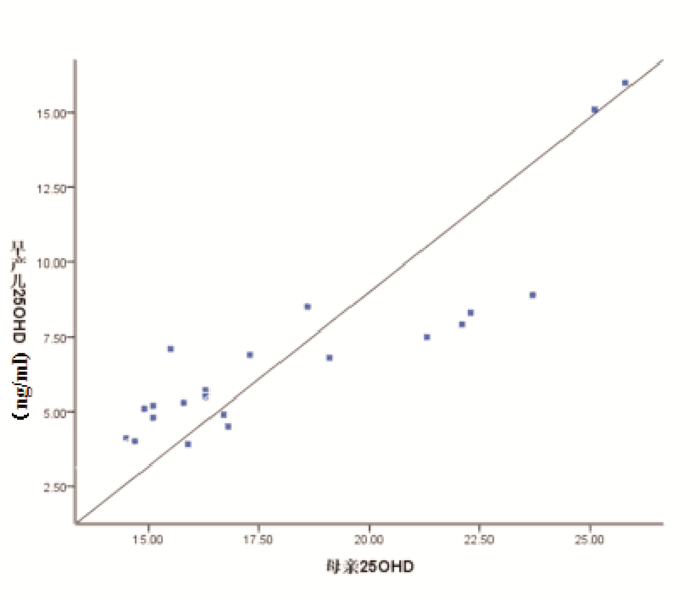
NEC组母亲和早产儿血清25-OHD水平均显著低于非NEC组(P < 0.001)(表 4); 非NEC组和NEC组母亲与早产儿间血清25-OHD水平均呈显著正相关(分别r=0.792、0.882, P < 0.001)(图 1~2)。
| 表 4 两组母亲和早产儿血清25-OHD水平比较 |
|
|
|
图 1 非NEC组母亲和早产儿血清25-OHD水平相关分析图 |
|
图 2 NEC组母亲和早产儿血清25-OHD水平相关分析图 |
非NEC组与NEC组早产儿维生素D水平在正常、不足、缺乏、严重缺乏等状况的分布上比较差异有统计学意义(P < 0.001), 见表 5。
| 表 5 两组早产儿不同维生素D水平分布比较 |
|
|
单因素logistic回归分析结果显示, NEC的主要影响因素为:胎龄、出生体重、母亲和早产儿25-OHD水平、机械通气持续时间、用氧持续时间和住院时间。母亲和早产儿血清25-OHD水平每增加1 ng/mL, 新生儿NEC风险就分别降低0.751和0.582倍(P < 0.001)。见表 6。
| 表 6 NEC单因素回归分析结果 |
|
|
近年来, 尽管NICU护理水平有了很大程度的提高, 但NEC的发病率和病死率并没有显著降低, 仍是新生儿人群的一个沉重负担[15]。NEC发病机制复杂, 有学者认为是多种因素导致的对某些损伤因子失控或过渡的炎症反应[3]。也有人认为乳基质、微生物和宿主未成熟免疫系统之间的相互作用是引发NEC发病的主要机制[16]。维生素D是一种多效类固醇激素, 除在调节矿物质平衡中起关键作用外, 还具有重要的免疫调节和抗炎作用[17]。近年来, 有关维生素D缺乏与胎儿发育和多种婴儿疾病之间关系的研究越来越多。Miliku等[18]的研究发现孕期低25-OHD水平与胎儿宫内发育迟缓和早产风险增加有关。De-Regil等[9]指出孕期补充维生素D可显著降低妊娠高血压和子癎前期的风险, 增加新生儿出生时身长和头围。Çetinkaya等[19]的研究发现母亲和新生儿维生素D缺乏可能是早产儿支气管肺发育不良的一个危险因素。我们先前的研究表明母亲和新生儿维生素D缺乏与足月新生儿败血症之间存在相关性[20]。维生素D通过维生素D受体(VDR)发挥其生物学效应, 有研究表明维生素D在肠道具有调节细胞增殖、分化和诱导凋亡的作用[21]。已经有作者提出维生素D与一些免疫介导性肠道疾病如炎症性肠病(IBD)的发生有关[22]。Abraham等[23]报道, 60%的IBD患者存在维生素D缺乏。如同IBD和其他慢性肠道疾病, 炎症是NEC的一个重要潜在病因。Liu等[24]的研究表明NEC的发生与TLR-2和TLR-4的表达增加, 而TLR-9的表达降低有关。维生素D具有抗炎效应, 最近一项包括23项研究在内的系统回顾指出维生素D介导抗炎效应的可能机制是通过降低TLR-2和TLR-4蛋白的表达而实现[17]。本研究发现, NEC组母亲和早产儿25-OHD水平显著低于非NEC组; NEC组无1例早产儿25-OHD水平在 > 20 ng/mL的正常范围内; NEC组早产儿25-OHD严重缺乏率高于非NEC组; 但是, 在非NEC组中仍然有64.1%的早产儿25-OHD水平 < 15 ng/mL; 在单变量回归分析中母亲和早产儿25-OHD水平均对NEC的发生具有影响。这与Cetinkaya等[25]的研究结果类似; 母亲和早产儿血清25-OHD水平每增加1 ng/mL, 新生儿NEC风险就分别降低0.751和0.582倍。因此, 母亲和早产儿较低的血清25-OHD水平与早产儿NEC的发生可能具有相关性, 低血清25-OHD水平可能是早产儿NEC的又一危险因素, 提高血清25-OHD水平, 避免维生素D缺乏, 有利于预防早产儿NEC的发生。
新生儿维生素D来源于胎盘的营养供给, 孕后期母体内25-OHD水平迅速增加, 母孕期维生素D水平决定胎儿维生素D水平[26]。本研究发现母亲和早产儿之间血清25-OHD水平呈显著正相关; 且非NEC组母亲产前3个月足量补充维生素D的比例高于NEC组。因此, 我们认为母亲孕期尤其是产前3个月足量补充维生素D, 可提高其自身和新生儿出生时血清25-OHD水平, 降低早产儿NEC的发病率。
维生素D缺乏在世界范围内普遍存在, 已成为公共卫生问题。新生儿尤其早产儿作为特殊群体, 是维生素D缺乏的高危人群。NEC是影响早产儿发病率和病死率的重要疾病之一。本研究发现母亲和早产儿血清25-OHD水平与早产儿NEC的发生之间可能存在相关性, 为孕期补充维生素D的重要性提供了又一临床依据。我们建议对所有妊娠妇女加强孕期保健, 妊娠中晚期补充足量维生素D, 监测血清25-OHD水平, 维持其在正常范围, 预防维生素D缺乏。在发生不可避免的早产时, 正常的血清25-OHD水平可能会降低早产儿发生NEC的风险。
| [1] |
王雪莲, 陈超. 新生儿坏死性小肠结肠炎的病因及危险因素研究进展[J]. 中华儿科杂志, 2013, 51(5): 340-344. (  0) 0) |
| [2] |
陈超. 新生儿坏死性小肠结肠炎的临床问题及防治策略[J]. 中华儿科杂志, 2013, 51(5): 321-325. (  0) 0) |
| [3] |
Dominguez KM, Moss RL. Necrotizing enterocolitis[J]. Clin Perinatol, 2012, 39(2): 387-401. DOI:10.1016/j.clp.2012.04.011 (  0) 0) |
| [4] |
Berrington JE, Hearn RI, Bythell M, et al. Deaths in preterm infants:changing pathology over 2 decades[J]. J Pediatr, 2012, 160(1): 49-53. DOI:10.1016/j.jpeds.2011.06.046 (  0) 0) |
| [5] |
De Plaen IG, Liu SX, Tian R, et al. Inhibition of nuclear factor-kappaB ameliorates bowel injury and prolongs survival in a neonatal rat model of necrotizing enterocolitis[J]. Pediatr Res, 2007, 61(6): 716-721. DOI:10.1203/pdr.0b013e3180534219 (  0) 0) |
| [6] |
De Plaen IG. Inflammatory signaling in necrotizing enterocolitis[J]. Clin Perinatol, 2013, 40(1): 109-124. DOI:10.1016/j.clp.2012.12.008 (  0) 0) |
| [7] |
Clancy N, Onwuneme C, Carroll A, et al. Vitamin D and neonatal immune function[J]. J Matern Fetal Neonatal Med, 2013, 26(7): 639-646. DOI:10.3109/14767058.2012.746304 (  0) 0) |
| [8] |
Hatun Ş, Ozkan B, Bereket A. Vitamin D deficiency and prevention:Turkish experience[J]. Acta Paediar, 2011, 100(9): 1195-1199. DOI:10.1111/apa.2011.100.issue-9 (  0) 0) |
| [9] |
De-Regil LM, Palacios C, Ansary A, et al. Vitamin D supplementation for women during pregnancy[J]. Cochrane Database Syst Rev, 2012(2): CD008873. (  0) 0) |
| [10] |
邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 第4版. 北京: 人民卫生出版社, 2011, 479.
(  0) 0) |
| [11] |
Walsh MC, Kliegman RM. Necrotizing enterocolitis:treatment based on staging criteria[J]. Pediatr Clin North Am, 1986, 33(1): 179-201. DOI:10.1016/S0031-3955(16)34975-6 (  0) 0) |
| [12] |
王晨, 禹松林, 王丹华. 新生儿维生素D水平及其相关因素[J]. 中国新生儿科杂志, 2015, 30(4): 241-245. (  0) 0) |
| [13] |
张名旭, 李磊. 孕妇维生素D缺乏对母体及子代的影响[J]. 中华临床营养杂志, 2015, 23(1): 60-64. (  0) 0) |
| [14] |
中华医学会儿科学分会儿童保健学组, 《中华儿科杂志》编辑委员会. 儿童微量营养素缺乏防治建议[J]. 中华儿科杂志, 2010, 48(7): 502-509. (  0) 0) |
| [15] |
Neu J, Walker WA. Necrotizing enterocolitis[J]. N Engl J Med, 2011, 364(3): 255-264. DOI:10.1056/NEJMra1005408 (  0) 0) |
| [16] |
Sharma R, Hudak ML. A clinical perspective of necrotizing enterocolitis:past, present, and future[J]. Clin Perinatol, 2013, 40(1): 27-51. DOI:10.1016/j.clp.2012.12.012 (  0) 0) |
| [17] |
Calton EK, Keane KN, Newsholme P, et al. The impact of vitamin D levels on inflammatory status:a systematic review of immune cell studies[J]. PLoS One, 2015, 10(11): e0141770. DOI:10.1371/journal.pone.0141770 (  0) 0) |
| [18] |
Miliku K, Vinkhuyzen A, Blanken LM, et al. Maternal vitamin D concentrations during pregnancy, fetal growth patterns, and risks of adverse birth outcomes[J]. Am J Clin Nutr, 2016, 103(6): 1514-1522. DOI:10.3945/ajcn.115.123752 (  0) 0) |
| [19] |
Çetinkaya M, Çekmez F, Erener-Ercan T, et al. Maternal/neonatal vitamin D deficiency:a risk factor for bronchopulmonary dysplasia in preterms?[J]. J Perinatol, 2015, 35(10): 813-817. DOI:10.1038/jp.2015.88 (  0) 0) |
| [20] |
杨玲蓉, 李桦, 杨涛义, 等. 维生素D缺乏与新生儿早发型败血症的相关性研究[J]. 中国当代儿科杂志, 2016, 18(9): 791-795. (  0) 0) |
| [21] |
Masri OA, Chalhoub JM, Sharara AI. Role of vitamins in gastrointestinal diseases[J]. World J Gastroenterol, 2015, 21(17): 5191-5209. DOI:10.3748/wjg.v21.i17.5191 (  0) 0) |
| [22] |
Di Rosa M, Malaguarnera G, De Gregorio C, et al. Immuno-modulatory effects of vitamin D3 in human monocyte and macrophages[J]. Cell Immunol, 2012, 280(1): 36-43. DOI:10.1016/j.cellimm.2012.10.009 (  0) 0) |
| [23] |
Abraham BP, Prasad P, Malaty HM. Vitamin D deficiency and corticosteroid use are risk factors for low bone mineral density in inflammatory bowel disease patients[J]. Dig Dis Sci, 2014, 59(8): 1878-1884. DOI:10.1007/s10620-014-3102-x (  0) 0) |
| [24] |
Liu Y, Zhu L, Fatheree NY, et al. Changes in intestinal toll-like receptors and cytokines precede histological injury in a rat model of necrotizing enterocolitis[J]. Am J Physiol Gastrointest Liver Physiol, 2009, 297(3): G442-G450. DOI:10.1152/ajpgi.00182.2009 (  0) 0) |
| [25] |
Cetinkaya M, Erener-Ercan T, Kalayci-Oral T, et al. Maternal/neonatal vitamin D deficiency:a new risk factor for necrotizing enterocolitis in preterm infants?[J]. J Perinatol, 2017, 37(6): 673-678. DOI:10.1038/jp.2017.18 (  0) 0) |
| [26] |
Principi N, Bianchini S, Baggi E, et al. Implications of maternal vitamin D deficiency for the fetus, the neonate and the young infant[J]. Eur J Nutr, 2013, 52(3): 859-867. DOI:10.1007/s00394-012-0476-4 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20

