人巨细胞病毒(human cytomegalovirus, HCMV)感染在我国广泛流行, 且多发生在婴幼儿时期[1]。HCMV属于疱疹病毒科5型, 是一种双链线状DNA病毒, 能侵害身体多脏器如肝脏、肺、神经系统等, 并对免疫缺陷患儿造成致命性危害, 因此HCMV感染的防治一直是国际医学界研究的热点及难点。HCMV感染的发病机制尚不十分清楚, 有研究[2]证实可能与免疫功能异常和细胞因子释放有关, 人们已认识到免疫系统在HCMV感染过程中起非常重要的作用。γδT细胞是新近认识的一个T细胞亚群, 是机体抵抗外来病原微生物的天然免疫细胞, 在病毒性感染、自身免疫性疾病及恶性肿瘤的发生中均发挥着重要作用[3-4]。既往研究[5-6]主要关注辅助性T细胞和CD4+CD25+调节性T细胞(Treg细胞)在HCMV感染中的作用, 而对γδT细胞的作用研究较少。本研究通过流式细胞术及酶联免疫吸附(ELISA)试验检测HCMV感染婴儿外周血γδT细胞及Treg细胞的表达和相关细胞因子IL-17、TGF-β1含量, 初步探讨γδT细胞、Treg细胞及其相关细胞因子在HCMV感染发病机制中的作用, 为进一步阐明HCMV感染的发病机制及对HCMV感染的防治提供新的思路和理论依据。
1 资料与方法 1.1 研究对象以2017年1~12月徐州医科大学附属医院儿科医院诊断的22例初发HCMV感染婴儿为研究对象, 其中男12例、女10例, 平均年龄6±3个月; 表现为肺炎(8例)、单纯肝功能损害(3例)、黄疸合并肝功能损害(1例)、血小板减少性紫癜(1例), 肺炎合并黄疸、肝损1例, 无症状性感染8例。HCMV感染的诊断参照2012年《儿童巨细胞病毒性疾病诊断和防治的建议》[1], 尿液聚合酶链式反应巨细胞病毒DNA(PCR-CMV-DNA)均阳性, 肝炎病毒、EB病毒、风疹病毒、单纯疱疹病毒和呼吸道病毒等常见病毒的抗体均阴性。对照组选择同期儿科门诊健康体检的婴儿22例, 其中男10例、女12例, 平均年龄7±4个月。两组在年龄、性别构成上的差异无统计学意义(P > 0.05)。
本研究获得受试者家长知情同意及医院伦理委员会批准。
1.2 标本采集清晨采集受试婴儿静脉血2 mL, EDTA抗凝, 密度梯度离心法获取单个核细胞和血浆。血浆置-80℃冰箱冻存, 用于检测IL-17和TGF-β1浓度。取单个核细胞均分至两个流式管(管1和管2), 于3 h内采用流式细胞仪检测γδT细胞和Treg细胞表达。
1.3 流式细胞仪检测γδT和Treg细胞表达在两管单个核细胞中分别加入2 mL磷酸盐缓冲液(PBS), 1 500 r/min离心5 min, 弃上清, 并重复1次, 加PBS重悬细胞。管1中加入荧光标记抗体FITC anti-human CD3与PE/Cy7-γδT(购自美国Biolegend公司)各5 μL, 管2中加入荧光标记抗体FITC anti-human CD4与PE anti-human CD25(购自美国Biolegend公司)各5 μL, 震荡混匀, 室温避光孵育15~20 min; 两管分别加入PBS 2 mL, 1 500 r/min离心5 min, 弃上清, 并重复1次, 加PBS重悬细胞, 取200 μL置于流式细胞仪(Beckman Coulter公司FC500型)检测, 以CellQuest软件分析数据。
1.4 ELISA法检测血浆IL-17和TGF-β1水平按照ELISA试剂盒(抗人IL-17和TGF-β1 ELISA kit购于徐州康美生物科技有限公司)说明书检测IL-17和TGF-β1水平, IL-17的灵敏度为4 pg/mL, TGF-β1的灵敏度为15 pg/mL。
1.5 统计学分析采用SPSS 16.0软件进行统计学处理。计量资料采用均数±标准差(x±s)表示, 组间比较采用独立样本t检验; 各项参数的相关性采用Pearson相关分析。以P < 0.05为差异有统计学意义。
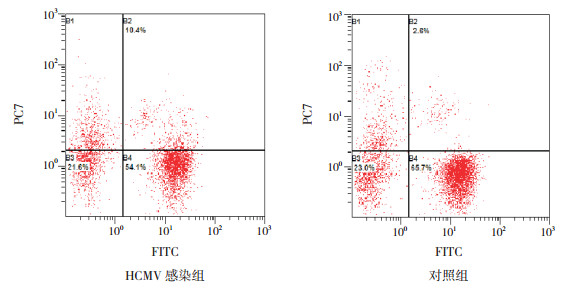
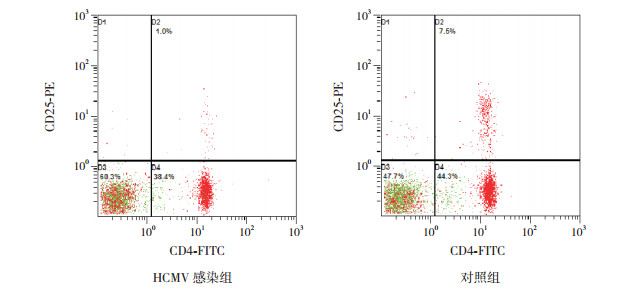
2 结果 2.1 两组γδT细胞、Treg细胞表达及IL-17和TGF-β1水平的比较HCMV感染组外周血γδT细胞表达和IL-17水平均高于对照组(P < 0.01);Treg细胞和TGF-β1水平均低于对照组(P < 0.01)。见图 1、2和表 1。
|
图 1 两组γδT细胞表达的比较 右上象限区域即为γδT细胞, HCMV感染组的γδT细胞表达高于对照组。 |
|
图 2 两组Treg细胞表达的比较 右上象限区域即为Treg细胞, HCMV感染组的γδT细胞表达低于对照组。 |
| 表 1 巨细胞病毒感染组和对照组γδT细胞、Treg细胞表达及IL-17和TGF-β1水平的比较 (x±s) |
|
|
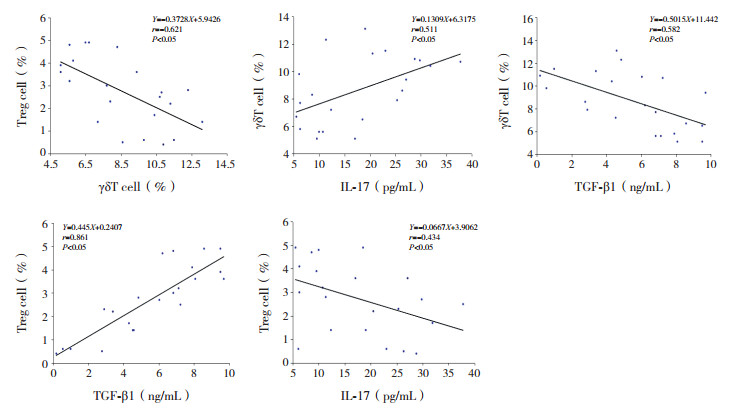
HCMV感染组外周血γδT细胞表达与Treg细胞表达、TGF-β1水平呈负相关(P < 0.05), 与IL-17水平呈正相关(P < 0.05);Treg细胞表达与TGF-β1水平呈正相关、与IL-17水平呈负相关(P < 0.05);外周血IL-17水平与TGF-β1水平无相关性(r为-0.239, P > 0.05)。见图 3。
|
图 3 HCMV感染组婴儿外周血γδT细胞、Treg细胞表达与IL-17、TGF-β1水平的相关性分析 |
人巨细胞病毒具有典型的疱疹病毒形态, 多为隐性感染, 对免疫系统尚未发育完善的胎儿和婴儿常表现为显性感染, 可导致多器官系统的损害。在机体巨细胞病毒感染的免疫应答过程中, 免疫细胞及细胞因子在免疫防御和免疫病理过程中发挥着重要的作用。
T淋巴细胞依据其表面的抗原识别受体(T cell receptor, TCR)可分成αβT细胞和γδT细胞两大类, 其中γδT细胞是近年被发现的, 由γ和δ链组成, 是执行固有免疫功能的T细胞。γδT细胞的TCR缺乏多样性, 可直接识别某些完整的多肽抗原, 不仅具有高效的抗病毒和吞噬等典型的天然免疫功能, 还可作为特殊的抗原提呈细胞(antigen presenting cell, APC)进一步活化适应性免疫应答, 所以γδT细胞被认为可能是固有免疫和适应性免疫的桥梁, 与NK细胞、巨噬细胞及树突状细胞等免疫细胞共同构成机体抵抗病原微生物的第一道防御屏障[7-8]。Couzi[9]及Daguzan等[10]发现γδT细胞在HCMV感染后数目增多。本研究HCMV感染婴儿的γδT细胞表达较对照组升高, 与文献相符。
IL-17是一类具有强大促炎作用的细胞因子, 可诱导前炎症因子IL-6、TNF-α、急性期反应蛋白、趋化因子MCP-1、MIP-2和粒-巨细胞集落刺激因子(GM-CSF)等表达, 促进中性粒细胞反应, 从而在清除细菌、病毒和真菌中发挥重要作用[11]。近来发现γδT细胞也可产生IL-17, 并且IL-17+γδT细胞具有更强的产生IL-17能力[12]。Umemura等[13]研究发现, 结核鼠模型中60%~70%的IL-17由γδT细胞产生, 并且IL-17+γδT细胞占γδT细胞的45%。Corpuz等[14]的研究进一步证实γδT细胞是IL-17的重要来源。本研究中HCMV感染组IL-17水平较对照组升高, 其表达水平与γδT细胞表达呈正相关, 提示γδT细胞可能也参与了HCMV感染患儿IL-17的产生。
转化生长因子β1(transforming growth factor-β1, TGF-β1)是某些调节性T细胞(可发挥强大和多样性免疫抑制作用)分化的重要细胞因子, 通过阻止炎性细胞功能和促进调节性T细胞的产生, 从而发挥免疫抑制作用, 稳定机体免疫平衡[15]。同时TGF-β1还可通过影响细胞因子和NK细胞进而发挥免疫抑制作用。国外学者[16]研究发现, TGF-β1可以诱导大鼠Th17细胞分化成熟, 使IL-17大量分泌。但对于人类而言, TGF-β1并不是Th17细胞分化的必要条件, 反之还可以通过剂量依赖性关系而抑制IL-17分泌。有研究发现, 人类TGF-β1水平与IL-17水平不存在明显相关性[17]。本研究HCMV感染组的TGF-β1水平较低, TGF-β1水平与IL-17水平无相关性, 提示TGF-β1具有免疫抑制作用, 与国外研究一致。
Treg细胞是表达CD4+ CD25+ Foxp3+的一类T细胞亚型, 约占外周血CD4+T细胞的5%~10%, 可通过细胞-细胞接触、细胞因子(IL-10或TGF-β1)介导以及转录因子调节等机制抑制效应性T淋巴细胞和CD8+T淋巴细胞的活化、增殖以及细胞因子分泌, 从而发挥免疫抑制作用, 有利于维持机体免疫稳定状态[18]。Treg细胞与γδT细胞的功能和分化过程相互拮抗, 在正常情况下, 二者保持平衡, 有利于维持机体的免疫稳定状态。有研究发现, HCMV感染组的外周血Treg细胞表达降低且与IL-17水平呈负相关[5-6]。Petermann等[19]发现, IL-23R+γδT细胞被IL-23活化后能够分泌大量的IL-17, 并抑制Treg细胞的分化和功能, 证实γδT细胞具有抑制Treg细胞的作用。本研究显示, HCMV感染组Treg细胞表达和TGF-β1水平降低, γδT细胞表达和IL-17水平增高, Treg细胞表达和IL-17呈负相关, γδT细胞表达与Treg表达、TGF-β1呈负相关, 提示HCMV感染婴儿γδT细胞过度活化, Treg免疫抑制效应不足, γδT细胞与Treg细胞的表达失衡, 平衡向γδT细胞一方偏移, 即γδT细胞和Treg细胞存在功能异常。
综上所述, HCMV感染婴儿外周血γδT细胞与Treg细胞的表达之间存在免疫平衡失调, TGF-β1和IL-17等相关细胞因子的异常表达可能是导致两群细胞比例失衡的重要因素, 并且γδT细胞可能参与HCMV感染婴儿IL-17的分泌。因此, 进一步研究免疫细胞及其细胞因子与HCMV感染的关系, 对于阐明HCMV感染的发病机制及对HCMV感染的防治有重要临床意义。
| [1] |
中华医学会儿科学分会感染学组. 儿童巨细胞病毒性疾病诊断和防治的建议[J]. 中华儿科杂志, 2012, 50(4): 290-292. (  0) 0) |
| [2] |
张广兰, 王西栋. 巨细胞病毒肝炎新生儿血清可溶性细胞间黏附分子-1和白细胞介素-18的表达变化及临床意义[J]. 中华围产医学杂志, 2012, 15(6): 370-371. (  0) 0) |
| [3] |
Tyler CJ, Doherty DG, Moser B, et al. Human Vγ9/Vδ2 T cells:innate adaptors of the immune system[J]. Cell Immunol, 2015, 296(1): 10-21. DOI:10.1016/j.cellimm.2015.01.008 (  0) 0) |
| [4] |
Latha TS, Reddy MC, Durbaka PV, et al. γδ T cell-mediated immune responses in disease and therapy[J]. Front Immunol, 2014, 10(5): 571. (  0) 0) |
| [5] |
朱晓华, 陈强, 李秋根, 等. 儿童巨细胞病毒感染致喘息发生的免疫学机制[J]. 中国当代儿科杂志, 2016, 18(9): 831-834. (  0) 0) |
| [6] |
孙晓红, 梁晓君, 周会祥, 等. 婴儿巨细胞病毒性肝炎外周血Treg及IL-l7表达水平与肝损伤的关联性[J]. 实验与检验医学, 2014, 32(5): 528-530. (  0) 0) |
| [7] |
Adams EJ, Gu S, Luoma AM. Human gamma delta T cells:Evolution and ligand recognition[J]. Cell Immunol, 2015, 296(1): 31-40. DOI:10.1016/j.cellimm.2015.04.008 (  0) 0) |
| [8] |
Vantourout P, Hayday A. Six-of-the-best:unique contributions of γδ T cells to immunology[J]. Nat Rev Immunol, 2013, 13(2): 88-100. DOI:10.1038/nri3384 (  0) 0) |
| [9] |
Couzi L, Pitard V, Moreau JF, et al. Direct and indirect effects of cytomegalovirus-induced gammadelta T cells after kidney transplantation[J]. Front Immunol, 2015, 6: 3. (  0) 0) |
| [10] |
Daguzan C, Moulin M, Kulyk-Barbier H, et al. Aminobisphosphonates synergize with human cytomegalovirus to activate the antiviral activity of Vγ9Vδ2 cells[J]. J Immunol, 2016, 196(5): 2219-2229. DOI:10.4049/jimmunol.1501661 (  0) 0) |
| [11] |
Cho JS, Pietras EM, Garcia NC, et al. IL-17 is essential for host defense against cutaneous staphylococcus aureus infection in mice[J]. J Clin Invest, 2010, 120(5): 1762-1773. DOI:10.1172/JCI40891 (  0) 0) |
| [12] |
Cua DJ, Tato CM. Innate IL-17-producing cells:the sentinels of the immune system[J]. Nat Rev Immunol, 2010, 10(7): 479-489. DOI:10.1038/nri2800 (  0) 0) |
| [13] |
Umemura M, Kawabe T, Shudo K, et al. Involvement of IL-17 in Fas ligand-induce inflammation[J]. Int Immunol, 2004, 16(8): 1099-1108. DOI:10.1093/intimm/dxh111 (  0) 0) |
| [14] |
Corpuz TM, Vazquez-Lombardi R, Luong JK, et al. IL-2 shapes the survival and plasticity of IL-17-producing γδT cells[J]. J Immunol, 2017, 199(7): 2366-2376. DOI:10.4049/jimmunol.1700335 (  0) 0) |
| [15] |
Vaidya A, Kale VP. TGF-β signaling and its role in the regulation of hematopoietic stem cells[J]. Syst Synth Biol, 2015, 9(1-2): 1-10. DOI:10.1007/s11693-015-9161-2 (  0) 0) |
| [16] |
Acost-Rodriguez EV, Napolitani G, Lanzavecchia A, et al. Interleukins 1 beta and 6 but not transforming growth fator-beta are essential for the differentiation of interleukin17-producing human T helper cells[J]. Nat Immumol, 2007, 8(9): 942-949. DOI:10.1038/ni1496 (  0) 0) |
| [17] |
黄雪琨, 杨钦泰, 陈玉莲, 等. γδT细胞、调节性T细胞、白细胞介素17及转化生长因子β1在变应性鼻炎患者外周血中的表达[J]. 中华耳鼻咽喉头颈外科杂志, 2013, 48(7): 544-548. (  0) 0) |
| [18] |
段炤, 林智平, 刘青, 等. CD4+CD25+调节性T淋巴细胞与辅助性T淋巴细胞17在川崎病发病机制中的作用[J]. 中华实用儿科临床杂志, 2017, 32(9): 652-655. (  0) 0) |
| [19] |
Petermann F, Rothhammer V, Claussen MC, et al. γδT cells enhance autoimmunity by restraining regulatory T cell responses via an interleukin-23-dependent mechanism[J]. Immunity, 2010, 33(3): 351-363. DOI:10.1016/j.immuni.2010.08.013 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


