2. 海南省人民医院病理科, 海南 海口 570311
新生儿坏死性小肠结肠炎(necrotizing enterocolitis, NEC)是新生儿最常见的致死性肠道危重症。有研究结果显示, 早产儿一旦发生NEC, 病死率高达20%~30%[1]。由于NEC的发病机制仍不甚清楚, 迄今缺乏有效的防治措施。目前认为肠道菌群失衡和肠道免疫应答失调在NEC复杂的发病机制中扮演重要的作用[2]。β-防御素-2(β-defensin 2, BD-2)是一种内源性小分子抗菌肽, 为肠道免疫的重要成员, BD-2表达异常已被证实参与炎性肠病的发病过程[3]。肠道的共生菌对于维持肠道的稳态至关重要, 参与肠道先天性免疫和适应性免疫调节[4]。近年应用益生菌防治NEC已成为临床实践策略, 但其疗效仍存争议[5-6]。双歧杆菌作为人体肠道最重要的益生菌之一, 具有许多微生态效应和生理效应。本研究采用新生大鼠NEC模型, 给予双歧杆菌干预, 检测各组肠道组织病理改变、BD-2蛋白及其mRNA的表达, 探讨BD-2在NEC发病中的作用以及双歧杆菌对肠道BD-2表达的影响, 从分子水平探讨双歧杆菌对肠道的作用机制, 为临床应用益生菌防治NEC提供理论基础。
1 材料与方法 1.1 实验材料新生1日龄Sprague-Dawley(SD)大鼠由浙江省医学科学院提供, 生产许可证号为SCXK(浙)2014-0001。大鼠代乳品(美国雅培公司, 批号:MFG20151030);双歧杆菌冻干粉(上海诺德生物实业有限公司, 浓度为1.5×1011 CFU/g); 一抗:兔抗大鼠BD-2多克隆抗体(北京博奥森生物技术有限公司, 批号:OA101369580);二抗:羊抗兔通用型IgG抗体-辣根过氧化物酶多聚体(北京中杉金桥生物技术有限公司, 批号:K152411G); 二氨基联苯胺(diaminobenzidine, DAB)(北京中杉金桥生物技术有限公司, 批号:K175914A); RNA提取试剂盒(上海捷瑞生物工程有限公司, 货号:GK3016);逆转录试剂盒(大连宝生物工程有限公司, 货号:RR036A); 定量PCR试剂盒(北京天根生化科技有限公司, 货号:FP215)。
1.2 实验动物及分组将40只SD新生大鼠按窝采用数字表法随机分为正常对照组、双歧杆菌对照组、NEC模型组和双歧杆菌干预组, 每组均10只。正常对照组和双歧杆菌对照组经母鼠喂养; NEC模型组和双歧杆菌干预组经人工喂养代乳品, 每4 h喂养1次, 首次灌胃0.1 mL, 隔天增加0.1 mL, 最大不超过0.3 mL。
1.3 模型建立与处理采用缺氧+冷刺激+人工喂养的方法建立NEC模型[7]。将NEC模型组和双歧杆菌干预组SD新生大鼠放入自制的缺氧箱, 充入氧浓度 < 1%的氮气缺氧1 min, 取出待恢复正常呼吸后, 放入4℃冰柜内冷刺激10 min, 每天2次, 连续3 d。双歧杆菌对照组和双歧杆菌干预组在每日冷刺激后经胃管注入双歧杆菌, 双歧杆菌给药选用双歧杆菌冻干粉(1.5×1011 CFU/g, 含青春双歧杆菌、短双歧杆菌及两歧双歧杆菌)1 g, 加入到10 mL代乳品中, 浓度为1.5×1010 CFU/mL, 每天灌胃1次, 连续3 d。正常对照组、双歧杆菌对照组不行缺氧和冷刺激处理, 正常对照组以等量生理盐水替代进行灌胃。每天观察各组SD新生大鼠一般情况和腹部情况。
1.4 肠道组织病理学检查造模后96 h取回盲部近段回肠标本, 经4%甲醛溶液固定、脱水、石蜡包埋、组织切片及苏木精-伊红(HE)染色, 采用双盲法对各组大鼠小肠组织进行损伤评分。按照Nadler标准[8]评分:0分:肠黏膜绒毛正常; 1分:黏膜下层或固有层轻度分离; 2分:黏膜下层或固有层中度分离, 或者黏膜下层和肌层水肿; 3分:黏膜下层或固有层重度分离, 或者黏膜下层和肌层严重水肿; 4分:肠壁全层坏死。评分≥2分, 提示NEC阳性。
1.5 免疫组织化学染色检测BD-2表达取末段回肠组织固定、切片(4 µm)。每只大鼠肠组织分别取5张切片, 采用枸橼酸盐缓冲液(pH 6.0)微波修复抗原, 滴加1:100稀释的一抗4℃冰箱孵育过夜(用PBS缓冲液代替一抗作阴性对照), 转至室温, PBS冲洗; 滴加二抗, 37℃孵育15 min, PBS冲洗。DAB反应显色, 苏木素复染, 脱水透明后封片。每张免疫组化切片随机选择5个不同的视野观察, 并对结果进行判读。BD-2表达结果采用半定量分析方法, 以染色强度结合阳性细胞数百分比进行评分[9-10]。染色强度以多数细胞呈现的染色强度并减去背景着色计分:无明显着色为0分, 轻微为1分, 中度为2分, 重度为3分; 阳性细胞百分比:0~5%评为0分, 6%~25%评为1分, 26%~50%评为2分, 51%~75%评为3分, > 75%评为4分。最终BD-2表达以阳性细胞百分比与染色强度的评分加和进行表示:0分为阴性(-), 1~3分为弱阳性, 4~5分为中度阳性, 6~7分为强阳性。
1.6 qRT-PCR法检测BD-2的mRNA表达水平按照RNA提取试剂盒说明书提取肠道组织RNA, 检测RNA浓度后, 使用PrimeScript RT Master Mix逆转录试剂盒将mRNA反转录成cDNA。待测目的基因以β-actin为内参, 引物序列正义链为5' -CTTCCTTCCTGGGTATGG-3' ,反义链为5' -GATGTCAACGTCACACTTC-3' ,片段长度77 bp; BD-2的引物序列正义链为5' -ACTGGCGGTTTTCGACAGAT-3' ,反义链为5' -TGTGCATTTTCATGGAGGAGC-3' ,片段长度124 bp。利用SuperReal PreMix Color(SYBR Green)定量PCR试剂盒行实时荧光定量PCR, 反应体系20 μL, 包括cDNA 8 μL, 10×PCR预混液10 μL, 正反引物各1 μL。反应条件:50℃预热3 min; 95℃预变性15 min; 95℃变性10 s, 61.5℃退火并延伸30 s, 40个循环。结果以2-ΔΔCt来计算目的基因的相对表达量。
1.7 统计学分析应用SSPS 22.0统计软件对数据进行统计学分析, 正态分布计量资料以均数±标准差(x±s)表示, 多组间比较采用单因素方差分析, 组间两两比较采用SNK-q检验; 非正态分布计量资料以中位数(四分位间距)表示, 多组间比较采用Kruskal-Wallis H检验, 组间两两比较采用Nemenyi检验。P < 0.05为差异有统计学意义。
2 结果 2.1 NEC模型的评价两个对照组新生大鼠肠壁色泽红润, 富有弹性, 镜下绒毛完整, 肠壁结构正常。NEC模型组大鼠肠组织外观明显扩张充气, 弹性差, 肠壁菲薄呈红黑色, 部分穿孔, 肠壁水肿、充血、坏死; 镜下出现不同程度的固有层与肌层分离或水肿, 部分绒毛脱落坏死, 腺体排列紊乱, 炎症细胞浸润。双歧杆菌干预组肠管扩张充气程度较NEC模型组减轻, 肠管呈暗红色, 弹性及光泽较差, 镜下可见肠壁轻中度水肿、充血, 部分绒毛坏死脱落, 部分肠管病变不十分明显。见图 1。
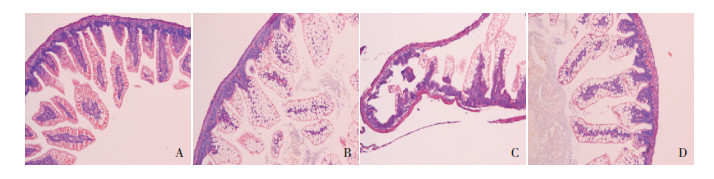
|
图 1 各组大鼠肠组织病理改变(苏木精-伊红染色, ×100) 正常对照组(A):肠黏膜绒毛结构完整, 肠腺体排列规则, 黏膜层、黏膜下层、固有层无充血水肿, 肌层完整; 双歧杆菌对照组(B):与正常对照组相似; NEC模型组(C):绒毛坏死脱落、缺失, 固有层和肌层分离; 双歧杆菌干预组(D):肠黏膜及黏膜下层可见轻中度水肿充血, 部分绒毛脱落坏死。 |
各组肠道损伤病理评分比较差异有统计学意义(P < 0.001)。进一步两两比较, NEC模型组肠道损伤评分分别高于正常对照组、双歧杆菌对照组、双歧杆菌干预组(P < 0.05);双歧杆菌干预组的肠道损伤评分高于正常对照组和双歧杆菌对照组(P < 0.05)。提示双歧杆菌对NEC模型具有保护作用, 见表 1。
| 表 1 各组新生大鼠肠道损伤评分及回肠组织BD-2表达水平比较 |
|
|
各组BD-2 mRNA表达水平比较差异有统计学意义(P < 0.001)。进一步两两比较, 正常对照组BD-2 mRNA的表达低于双歧杆菌对照组、NEC模型组和双歧杆菌干预组(P < 0.05);双歧杆菌对照组BD-2 mRNA的表达高于NEC模型组和双歧杆菌干预组(P < 0.05);双歧杆菌干预组BD-2 mRNA的表达高于NEC模型组(P < 0.05)。见表 1。
2.4 各组新生大鼠回肠黏膜BD-2蛋白的表达各组BD-2蛋白半定量表达比较差异有统计学意义(P < 0.001)。进一步两两比较, 双歧杆菌对照组BD-2的表达高于正常对照组(P < 0.05);NEC模型组BD-2表达高于正常对照组, 但低于双歧杆菌对照组(P < 0.05);双歧杆菌干预组BD-2的表达高于正常对照组和NEC模型组, 但低于双歧杆菌对照组(P < 0.05)。见表 1, 图 2。
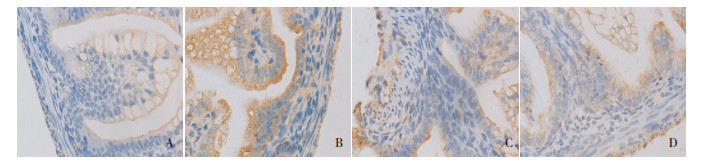
|
图 2 免疫组织化学法检测BD-2在各组新生大鼠末段回肠组织中的表达(DAB, ×400) 正常对照组(A):肠黏膜上皮细胞有BD-2弱阳性表达; 双歧杆菌对照组(B):BD-2为强阳性表达, 呈弥漫性或颗粒状分布; NEC模型组(C):在绒毛、隐窝处均有BD-2弱阳性表达; 双歧杆菌干预组(D):肠黏膜上皮胞质顶端有BD-2中等阳性染色。BD-2阳性表达呈棕色。 |
肠黏膜屏障由机械屏障(肠黏膜上皮)、生态屏障(肠道菌群)、免疫屏障(免疫细胞及免疫因子)等构成, 肠黏膜屏障的破坏是肠功能障碍发生的病理基础[2, 11]。BD-2是肠道免疫屏障的重要组成部分, 参与肠道先天性免疫和适应性免疫应答反应。BD-2具有较强的广谱抗菌、抗病毒、抗螺旋体及免疫调节等生物学活性。BD-2主要表达于皮肤、肠道、口腔、呼吸道、泌尿道等上皮组织中, 在肠道主要由肠壁上皮细胞分泌, 生理情况下在肠道呈低水平表达, 感染或炎症时BD-2表达增加。早产儿适应性免疫功能未成熟, 其肠道更依赖于先天免疫系统抵御致病因素的侵袭[12-13]。Trend等[14]报道了母乳内含量丰富的β-防御素对新生儿肠道具有保护作用。早产儿脐带血BD-2含量低于足月儿, 被认为是早产儿发生晚发败血症的危险因素[15]。研究发现粪便BD-2的含量不受喂养方式、分娩方式影响, 但与胎龄密切相关, 胎龄越小BD-2含量越低, 肠道BD-2不足可能增加早产儿罹患NEC的风险[16]。Campeotto等[17]研究显示NEC患儿粪便中的BD-2升高, 认为肠道BD-2升高可作为NEC的诊断标志物, 但Jenke等[18]研究发现中度NEC患儿肠黏膜BD-2的表达升高, 而重症NEC却下降。本研究结果显示BD-2呈低水平表达于正常大鼠肠道组织中; 与正常对照组比较, NEC模型组的肠道BD-2表达升高, 提示BD-2参与NEC的发病过程。NEC时BD-2表达虽有升高, 但升高的幅度有限, 经双歧杆菌干预的NEC模型BD-2水平高于NEC模型组, 肠道病理损伤程度也减轻, 由此可见, BD-2表达量不足是NEC发生发展的重要原因。
肠道菌群具有许多重要生理功能, 包括维持肠黏膜屏障的完整性以及参与肠道的免疫调节等, 无菌的肠道不会发生NEC, NEC存在肠道微生态失衡, 肠道菌群紊乱是NEC重要的发病机制之一[19], 肠道添加益生菌可能有助于降低NEC的风险, 但其切确作用机制尚不清楚, 或许存在多种机制发挥保护肠道的作用, 其中包括刺激黏膜免疫防御反应、增强黏膜屏障完整性、增加分泌型IgA生成, 促进肠道免疫功能的发育成熟和肠道微生态菌群多样化等[20], 近年来随着分子生物学的研究进展, 认为益生菌的治疗作用可能还涉及调节抗菌肽的生成而发挥肠道保护作用。有研究发现NEC病人的肠道菌群与宿主肠道免疫之间的稳态发生失衡, 粪便BD-2的含量与肠道菌群组成变化相关, 认为肠道固有免疫受肠道菌群影响[21]。双歧杆菌是人体肠道最重要的益生菌之一, 肠道双歧杆菌属等益生菌减少, 是NEC发病机制中的重要因素[22]。在本研究中, 选择双歧杆菌调控BD-2的表达, 利用qRT-PCR和免疫组化方法均检测到添加双歧杆菌的NEC肠道BD-2 mRNA及蛋白表达水平高于NEC模型组, 肠道损伤也轻于NEC模型组, 推测双歧杆菌通过诱导BD-2的生成而发挥肠道保护作用。微生物诱导BD-2的表达呈菌株特异性, Habil等[23]研究发现乳酸杆菌Shiora株可强劲诱导BD-2生成, 然而乳酸杆菌MS15株却抑制BD-2的生成。BD-2基因如何被诱导表达的确切机制仍不甚明了, 研究表明p38丝裂原活化蛋白激酶(MAPK)、KB抑制蛋白激酶和核转录因子κB(NF-κB)是暴露于脆弱类杆菌毒素环境下的肠上皮细胞产生BD-2所必需的[24]。Lewis等[25]研究发现出血性大肠杆菌鞭毛所介导的肠上皮细胞BD-2表达可被NF-κB、p38 MAPK和c-Jun氨基末端激酶的抑制剂阻断。目前主要认为BD-2通过激活NF-κB信号通路实现, 该机制的途径为:微生物和炎症刺激上皮细胞→病原体模式识别受体被结合→NF-κB等转录因子激活→BD-2基因启动子被结合→BD-2基因被激活, 转录并翻译, 表达上调, BD-2 mRNA增加[26]。
综上所述, 本研究表明BD-2表达不足是NEC发生发展的重要因素, 参与NEC的发病过程, 双歧杆菌可上调BD-2表达而发挥对NEC的肠道保护作用。BD-2具有极其广泛的抗菌谱, 迄今尚未发现有致病菌株对其产生耐药性, 通过寻找合适的益生菌种类调控机体内源性BD-2表达将为NEC的防治提供新的方法。
| [1] |
Neu J, Walker WA. Necrotizing enterocolitis[J]. N Engl J Med, 2011, 364(3): 255-264. DOI:10.1056/NEJMra1005408 (  0) 0) |
| [2] |
Halpern MD, Denning PW. The role of intestinal epithelial barrier function in the development of NEC[J]. Tissue Barriers, 2015, 3(1-2): e1000707. DOI:10.1080/21688370.2014.1000707 (  0) 0) |
| [3] |
Kim MJ, Lee WY, Choe YH. Expression of TIM-3, human β-defensin-2, and FOXP3 and correlation with disease activity in pediatric Crohn's disease with infliximab therapy[J]. Gut Liver, 2015, 9(3): 370-380. (  0) 0) |
| [4] |
Underwood MA. Probiotics and innate and adaptive immune responses in premature infants[J]. For Immunopathol Dis Therap, 2016, 7(1-2): 1-15. DOI:10.1615/ForumImmunDisTher.v7.i1-2 (  0) 0) |
| [5] |
Costeloe K, Hardy P, Juszczak E, et al. Bifidobacterium breve BBG-001 in very preterm infants:a randomized controlled phase 3 trial[J]. Lancet, 2016, 387(10019): 649-660. DOI:10.1016/S0140-6736(15)01027-2 (  0) 0) |
| [6] |
AlFaleh K, Anabrees J. Probiotics for prevention of necrotizing enterocolitis in preterm infants[J]. Evid Based Child Health, 2014, 9(3): 584-671. DOI:10.1002/ebch.v9.3 (  0) 0) |
| [7] |
盛庆丰, 吕志葆, 蔡威, 等. 重组人β-防御素3干预新生大鼠坏死性小肠结肠炎模型的研究[J]. 中华小儿外科杂志, 2015, 36(2): 109-112. (  0) 0) |
| [8] |
Nadler EP, Dickinson E, Knisely A, et al. Expression of inducible nitric oxide synthase and interleukin-12 in experimental necrotizing enterocolitis[J]. J Surg Res, 2000, 92(1): 71-77. DOI:10.1006/jsre.2000.5877 (  0) 0) |
| [9] |
Birner P, Schindl M, Obermair A, et al. Overexpression of hypoxia-inducible factor 1 alpha is a marker for an unfavorable prognosis in early-stage invasive cervical cancer[J]. Cancer Res, 2000, 60(17): 4693-4696. (  0) 0) |
| [10] |
何彦册, 贺湘英, 黄永坤, 等. 酪酸梭菌对坏死性小肠结肠炎新生鼠肠损伤的保护作用[J]. 临床儿科杂志, 2016, 34(7): 547-552. (  0) 0) |
| [11] |
Denning TL, Bhatia AM, Kane AF, et al. Pathogenesis of NEC:Role of the innate and adaptive immune response[J]. Semin Perinatol, 2017, 41(1): 15-28. DOI:10.1053/j.semperi.2016.09.014 (  0) 0) |
| [12] |
Battersby AJ, Khara J, Wright VJ, et al. Antimicrobial proteins and peptides in early life:ontogeny and translational opportunities[J]. Front Immunol, 2016, 7: 309. (  0) 0) |
| [13] |
Weitkamp JH, Koyama T, Rock MT, et al. Necrotising enterocolitis is characterised by disrupted immune regulation and diminished mucosal regulatory(FOXP3)/effector(CD4, CD8) T cell ratios[J]. Gut, 2013, 62(1): 73-82. DOI:10.1136/gutjnl-2011-301551 (  0) 0) |
| [14] |
Trend S, Strunk T, Hibbert J, et al. Antimicrobial protein and Peptide concentrations and activity in human breast milk consumed by preterm infants at risk of late-onset neonatal sepsis[J]. PLoS One, 2015, 10(2): e0117038. DOI:10.1371/journal.pone.0117038 (  0) 0) |
| [15] |
Olbrich P, Pavón A, Rosso ML, et al. Association of human beta-defensin-2 serum levels and sepsis in preterm neonates[J]. Pediatr Crit Care Med, 2013, 14(8): 796-800. DOI:10.1097/PCC.0b013e3182975e0f (  0) 0) |
| [16] |
Richter M, Topf HG, Gröschl M, et al. Influence of gestational age, cesarean section, and type of feeding on fecal human beta-defensin 2 and tumor necrosis factor-alpha[J]. J Pediatr Gastroenterol Nutr, 2010, 51(1): 103-105. DOI:10.1097/MPG.0b013e3181cd26f9 (  0) 0) |
| [17] |
Campeotto F, Baldassarre M, Laforgia N, et al. Fecal expression of human β-defensin-2 following birth[J]. Neonatology, 2010, 98(4): 365-369. DOI:10.1159/000315872 (  0) 0) |
| [18] |
Jenke AC, Zilbauer M, Postberg J, et al. Human β-defensin 2 expression in ELBW infants with severe necrotizing enterocolitis[J]. Pediatr Res, 2012, 72(5): 513-520. DOI:10.1038/pr.2012.110 (  0) 0) |
| [19] |
Patel RM, Denning PW. Intestinal microbiota and its relationship with necrotizing enterocolitis[J]. Pediatr Res, 2015, 78(3): 232-238. DOI:10.1038/pr.2015.97 (  0) 0) |
| [20] |
郭城, 张琳. 益生菌在新生儿坏死性小肠结肠炎中的应用[J]. 中国实用儿科杂志, 2017, 32(2): 120-125. (  0) 0) |
| [21] |
Jenke AC, Postberg J, Mariel B, et al. S100A12 and hBD2 correlate with the composition of the fecal microflora in ELBW infants and expansion of E.coli is associated with NEC[J]. Biomed Res Int, 2013, 2013: 150372. (  0) 0) |
| [22] |
李阳, 余加林, 艾青, 等. 早产儿坏死性小肠结肠炎肠道菌群多样性及其动态研究[J]. 中国循证儿科杂志, 2014, 9(2): 117-121. (  0) 0) |
| [23] |
Habil N, Abate W, Beal J, et al. Heat-killed probiotic bacteria differentially regulate colonic epithelial cell production of human β-defensin-2:dependence on inflammatory cytokines[J]. Beneficial Microbes, 2014, 5(4): 483-495. DOI:10.3920/BM2013.0061 (  0) 0) |
| [24] |
Yoon YM, Lee JY, Yoo D, et al. Bacteroides fragilis enterotoxin induces human beta-defensin-2 expression in intestinal epithelial cells via a mitogen-activated protein kinase/I kappaB kinase/NF-kappaB-dependent pathway[J]. Infect Immun, 2010, 78(5): 2024-2033. DOI:10.1128/IAI.00118-10 (  0) 0) |
| [25] |
Lewis SB, Prior A, Ellis SJ, et al. Flagellin induces β-defensin 2 in human colonic Ex vivo infection with enterohemorrhagic Escherichia coli[J]. Front Cell Infect Microbiol, 2016, 6: 68. (  0) 0) |
| [26] |
Omagari D, Takenouchi-Ohkubo N, Endo S, et al. Nuclear factor kappa B plays a pivotal role in polyinosinic-polycytidylic acid-induced expression of human β-defensin 2 in intestinal epithelial cells[J]. Clin Exp Immunol, 2011, 165(1): 85-93. DOI:10.1111/cei.2011.165.issue-1 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20

